课题1 生活中常见的盐 - 盐的化学性质 (34张PPT)
文档属性
| 名称 | 课题1 生活中常见的盐 - 盐的化学性质 (34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 613.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-20 10:53:49 | ||
图片预览











文档简介
(共34张PPT)
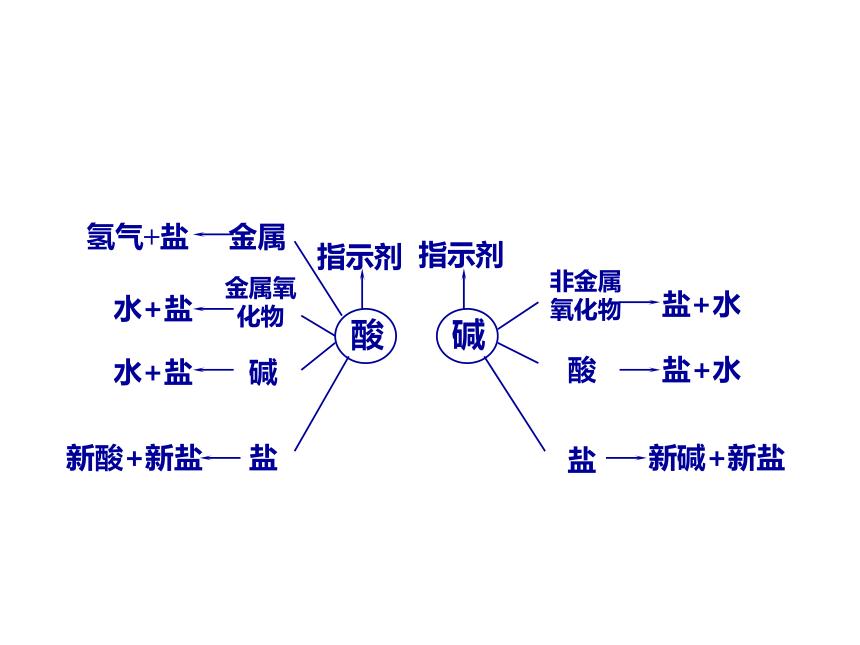
盐的化学性质
酸
碱
指示剂
指示剂
金属
氢气+盐
金属氧化物
水+盐
碱
水+盐
盐
新酸+新盐
非金属氧化物
盐+水
酸
盐+水
盐
新碱+新盐
晶体,
溶于水,有
味,
有较高的熔点和沸点,纯净NaCl不潮解,因含杂质而易潮解。
一、氯化钠(NaCl)
1.氯化钠物理性质:
是食盐的主要成分
白色
易
咸
2.氯化钠化学性质:
NaCl
+
AgNO3===
AgCl
↓
+
NaNO3
白色
1.水溶液呈中性
2.可以和硝酸银溶液反应
(1)Na2CO3:玻璃、造纸、纺织和洗涤剂等。
(2)NaHCO3:糕点发酵粉,治疗胃酸过多等。
(3)CaCO3:建筑材料,补钙剂等。
二、碳酸钠、碳酸氢钠和碳酸钙
主要用途:
(1)Na2CO3:白色粉末,俗名:苏打、纯碱
(纯碱不是碱,它是盐)易溶于水
(2)NaHCO3:白色粉末,
俗名:小苏打。易溶于水
(3)CaCO3:白色固体,石灰石、大理石主要成分,
不溶于水。
碳酸钠的化学性质
2.能与酸反应,
Na2CO3
+
2
HCl
===
2NaCl
+
CO2↑+H2O
生成新盐和新酸
3.
能与碱反应,
生成新盐和新碱
Na2CO3
+
Ca(OH)2
===
CaCO3
↓+
2
NaOH
4
.能与某些盐反应
Na2CO3+
CaCl2==CaCO3
↓+
2NaCl
Na2CO3
+Ba(OH)2
===
BaCO3
↓+
2
NaOH
Na2CO3+
BaCl2==BaCO3
↓+
2NaCl
1.水溶液呈碱性
生成新盐1和新盐2
(2)能与酸反应,
NaHCO3
+
HCl
===
NaCl
+
CO2↑+H2O
生成新盐和新酸
2NaHCO3
===
Na2CO3
+
CO2↑+H2O
碳酸氢钠的化学性质
(1)水溶液呈碱性
(3)不稳定受热易分解
△
(1)能与酸反应,
CaCO3
+
2HCl
===
CaCl
2
+
CO2↑+H2O
生成新盐和新酸
CaCO3
===
CaO3+
CO2↑
碳酸钙的化学性质
(3)与溶有二氧化碳的水反应,生成溶解度较大的碳酸氢钙
(2)高温煅烧分解
高温
CaCO3
+
H
2
O+
CO2
===
Ca(HCO3)2
Ca(HCO3)2
===
CaCO3
+
H
2
O+
CO2
↑
△
(1)配制农药波尔多液
(2)无水CuSO4常用于实验室检验水蒸气。与水反应变蓝
三、硫酸铜
主要用途:
(1)CuSO4:白色粉末,易溶于水,水溶液呈蓝色
(2)CuSO4?5H2O
蓝色晶体,
俗名:胆矾、蓝矾。易溶于水,水溶液呈蓝色
2.
可溶性的碱反应
1.水溶液呈酸性
CuSO4+
2NaOH
====
Cu(OH)2↓
(蓝)
+
Na2SO4
CuSO4+
Ba(OH)2
=
Cu(OH)2↓
(蓝)
+
BaSO4↓(白)
3.
可溶性的钡盐反应
CuSO4+
Ba(NO3)2
=
Cu(NO3)2
+
BaSO4↓(白)
CuSO4+
BaCl2
=
CuCl2
+
BaSO4↓(白)
硫酸铜的化学性质
⒈盐+酸→新盐+新酸
AgNO3+
HCl
==AgCl↓+
HNO3
BaCl2+H2SO4
==BaSO4↓+2HCl
CaCO3+2HCl
==CaCl2+H2O+CO2↑
一、盐的化学性质
⒉盐+碱→新盐+新碱
CuSO4+2NaOH
==Na2SO4+Cu(OH)2↓
FeCl3+3NaOH
==3NaCl+Fe(OH)3↓
Na2CO3+Ca(OH)2
==CaCO3↓+2NaOH
Mg+2HCl==MgCl2+H2↑
2Al+3H2SO4==Al2
(SO4)3+3H2↑
Zn+
H2SO4==
ZnSO4+
H2↑
Fe+2HCl==FeCl2+
H2↑
★活泼金属+酸→盐+氢气
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Ag
Pt
Au
金属活动性由强逐渐减弱
金属
盐
溶液
现象
Al
CuSO4
铝条的表面
_________________
Cu
AgNO3
铜丝的表面
_________________
Cu
ZnSO4
铜丝的表面
_________________
覆盖一层红色物质
覆盖一层银白色物质
没有变化
3CuSO4+2Al==
Al2(SO4)3+3Cu
2AgNO3+
Cu==Cu(NO3)2+2Ag
ZnSO4+Cu≠不反应
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Ag
Pt
Au
金属活动性由强逐渐减弱
3CuSO4+2Al==
Al2(SO4)3+3Cu
2AgNO3+
Cu==Cu(NO3)2+2Ag
⒊盐+金属→新盐+新金属
⒊盐+金属→新盐+新金属
结论:在金属活动顺序中,只有排
在前面的金属,才能把排在
后面的金属从它们的盐溶液
里置换出来。
★不用K、Ca、Na去置换盐溶液的金属
盐+盐→两种新盐
?
盐
溶液
盐
溶液
现象
NaCl
AgNO3
溶液中____________
Na2SO4
BaCl2
溶液中
____________
生成白色沉淀
生成白色沉淀
AgNO3+
NaCl==AgCl↓+NaNO3
BaCl2+
Na2SO4==BaSO4↓+2NaCl
⒊盐+盐→两种新盐
盐
金属
酸
碱
盐
盐+金属
盐+酸
盐+碱
盐+盐
Na2CO3+2HCl==2NaCl+H2O+CO2↑
AgNO3+HCl==AgCl↓+HNO3
Zn+
H2SO4==
ZnSO4+
H2↑
ZnO+
H2SO4==
ZnSO4+
H2O
Zn(OH)2+
H2SO4==
ZnSO4+
2H2O
ZnCO3+
H2SO4==
ZnSO4+
H2O+CO2↑
Zn+FeSO4==ZnSO4+Fe
讨论:举出四种制备硫酸锌的方法
◆
◆
◆
复分解反应包括:
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸+金属氧化物——盐+水
由两种化合物相互交换成分,生成另外两种化合物的反应。
盐+酸→新盐+新酸
AgNO3+
HCl
==
AgCl
+
HNO3
BaCl2+H2SO4==BaSO4
+2HCl
CaCO3+2HCl==CaCl2+
+CO2
盐+碱→新盐+新碱
CuSO4+2NaOH==Na2SO4+Cu(OH)2
FeCl3+3NaOH==3NaCl+Fe(OH)3
Na2CO3+Ca(OH)2==CaCO3
+2NaOH
盐+盐→两种新盐
AgNO3+
NaCl==AgCl
+NaNO3
BaCl2+
Na2SO4==BaSO4
+2NaCl
酸+碱→盐+水
2HCl+
Ca(OH)2==CaCl2+2
H2SO4+
2NaOH==Na2SO4+
↓
↓
↓
↓
↓
↓
↓
H2O
↑
H2O
H2O
NaCl+KNO3→
?
二、复分解反应发生的条件
反应物:有酸可不溶,无酸都需溶
生成物:沉淀、气体或水
酸、碱、盐的溶解性口诀
常见酸能溶于水,
碱溶钾、钠、钡、氨、钙,
钾、钠、硝、铵盐溶水快,
硫酸盐不溶硫酸钡,
氯化物不溶氯化银,
碳酸盐只溶钾、钠、铵。
酸
碱
盐
金属氧化物
盐
非金属氧化物
金属
盐
金属
+
酸
盐
+
金属
碱性氧化物
+
酸
碱
+
酸性氧化物
酸
+
碱
碱
+
盐
盐
+
盐
盐
+
酸
下列几组物质能否在水溶液里发生反应,若不反应说明理由
⑴Zn+Pb(NO3)2
⑵Cu+
Hg(NO3)2
⑶Cu+FeCl2
⑷3AgNO3+FeCl3
⑸BaCl2+(NH4)2SO4
⑹AgCl+NaNO3
⑺Ca(OH)2+Na2CO3
⑻Na2SO4+HCl
⑼Ag2CO3+2HCl
⑽Cu+HCl
==
Pb
+Zn(NO3)2
==
Hg
+Cu(NO3)2
≠不反应
==3AgCl↓+Fe(NO3)3
==BaSO4↓+2NH4Cl
≠不反应
==CaCO3↓+2NaOH
≠不反应
==AgCl↓+H2O+CO2↑
≠不反应
一、下列复分解反应不能发生的是:
A、NaCl+Na2CO3
B、Zn(OH)2+CuSO4
C、FeCl3+NaOH
D、NaCl+KNO3
E、CaCl2+Na2CO3
F、Na2CO3+HNO3
G、Cu(OH)2+HCl
H、NaNO3+H2SO4
I、AgCl+HNO3
J、BaCO3+H2SO4
练习:
A、B、D、H、I
二、完成下列物质的转化
1)CuO
CuSO4
Cu(OH)2
CuCl2
2)FeCl3
Fe(OH)3
Fe2(SO4)3
3)NaCl
NaNO3
4)H2SO4
HCl
6)H2SO4
MgSO4
5)NaOH
Mg(OH)2
氧化镁 氢氧化钠溶液 稀硫酸
硫酸铜溶液 氯化钡溶液
二氧化碳
三、写出下列物质中两两之间能相互发生反应的化学方程式:
MgO
NaOH
H2SO4
CuSO4
BaCl2
CO2
1
2
3
4
5
6
1+3
2+3
2+4
2+6
3+5
4+5
各举一例酸、碱、盐,写出它们
之间相互反应的化学方程式。
如:H2SO4
NaOH
BaCl2
H2SO4+2NaOH==Na2SO4+2H2O
H2SO4+BaCl2==BaSO4↓+2HCl
★盐的性质
金属→新金属+新盐
酸
→新盐+新酸
盐
+
碱
→新盐+新碱
盐
→两种新盐
★复分解反应发生的条件
反应物:均可溶于水(包括溶于酸)
生成物:沉淀、气体或水
盐的化学性质
酸
碱
指示剂
指示剂
金属
氢气+盐
金属氧化物
水+盐
碱
水+盐
盐
新酸+新盐
非金属氧化物
盐+水
酸
盐+水
盐
新碱+新盐
晶体,
溶于水,有
味,
有较高的熔点和沸点,纯净NaCl不潮解,因含杂质而易潮解。
一、氯化钠(NaCl)
1.氯化钠物理性质:
是食盐的主要成分
白色
易
咸
2.氯化钠化学性质:
NaCl
+
AgNO3===
AgCl
↓
+
NaNO3
白色
1.水溶液呈中性
2.可以和硝酸银溶液反应
(1)Na2CO3:玻璃、造纸、纺织和洗涤剂等。
(2)NaHCO3:糕点发酵粉,治疗胃酸过多等。
(3)CaCO3:建筑材料,补钙剂等。
二、碳酸钠、碳酸氢钠和碳酸钙
主要用途:
(1)Na2CO3:白色粉末,俗名:苏打、纯碱
(纯碱不是碱,它是盐)易溶于水
(2)NaHCO3:白色粉末,
俗名:小苏打。易溶于水
(3)CaCO3:白色固体,石灰石、大理石主要成分,
不溶于水。
碳酸钠的化学性质
2.能与酸反应,
Na2CO3
+
2
HCl
===
2NaCl
+
CO2↑+H2O
生成新盐和新酸
3.
能与碱反应,
生成新盐和新碱
Na2CO3
+
Ca(OH)2
===
CaCO3
↓+
2
NaOH
4
.能与某些盐反应
Na2CO3+
CaCl2==CaCO3
↓+
2NaCl
Na2CO3
+Ba(OH)2
===
BaCO3
↓+
2
NaOH
Na2CO3+
BaCl2==BaCO3
↓+
2NaCl
1.水溶液呈碱性
生成新盐1和新盐2
(2)能与酸反应,
NaHCO3
+
HCl
===
NaCl
+
CO2↑+H2O
生成新盐和新酸
2NaHCO3
===
Na2CO3
+
CO2↑+H2O
碳酸氢钠的化学性质
(1)水溶液呈碱性
(3)不稳定受热易分解
△
(1)能与酸反应,
CaCO3
+
2HCl
===
CaCl
2
+
CO2↑+H2O
生成新盐和新酸
CaCO3
===
CaO3+
CO2↑
碳酸钙的化学性质
(3)与溶有二氧化碳的水反应,生成溶解度较大的碳酸氢钙
(2)高温煅烧分解
高温
CaCO3
+
H
2
O+
CO2
===
Ca(HCO3)2
Ca(HCO3)2
===
CaCO3
+
H
2
O+
CO2
↑
△
(1)配制农药波尔多液
(2)无水CuSO4常用于实验室检验水蒸气。与水反应变蓝
三、硫酸铜
主要用途:
(1)CuSO4:白色粉末,易溶于水,水溶液呈蓝色
(2)CuSO4?5H2O
蓝色晶体,
俗名:胆矾、蓝矾。易溶于水,水溶液呈蓝色
2.
可溶性的碱反应
1.水溶液呈酸性
CuSO4+
2NaOH
====
Cu(OH)2↓
(蓝)
+
Na2SO4
CuSO4+
Ba(OH)2
=
Cu(OH)2↓
(蓝)
+
BaSO4↓(白)
3.
可溶性的钡盐反应
CuSO4+
Ba(NO3)2
=
Cu(NO3)2
+
BaSO4↓(白)
CuSO4+
BaCl2
=
CuCl2
+
BaSO4↓(白)
硫酸铜的化学性质
⒈盐+酸→新盐+新酸
AgNO3+
HCl
==AgCl↓+
HNO3
BaCl2+H2SO4
==BaSO4↓+2HCl
CaCO3+2HCl
==CaCl2+H2O+CO2↑
一、盐的化学性质
⒉盐+碱→新盐+新碱
CuSO4+2NaOH
==Na2SO4+Cu(OH)2↓
FeCl3+3NaOH
==3NaCl+Fe(OH)3↓
Na2CO3+Ca(OH)2
==CaCO3↓+2NaOH
Mg+2HCl==MgCl2+H2↑
2Al+3H2SO4==Al2
(SO4)3+3H2↑
Zn+
H2SO4==
ZnSO4+
H2↑
Fe+2HCl==FeCl2+
H2↑
★活泼金属+酸→盐+氢气
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Ag
Pt
Au
金属活动性由强逐渐减弱
金属
盐
溶液
现象
Al
CuSO4
铝条的表面
_________________
Cu
AgNO3
铜丝的表面
_________________
Cu
ZnSO4
铜丝的表面
_________________
覆盖一层红色物质
覆盖一层银白色物质
没有变化
3CuSO4+2Al==
Al2(SO4)3+3Cu
2AgNO3+
Cu==Cu(NO3)2+2Ag
ZnSO4+Cu≠不反应
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Ag
Pt
Au
金属活动性由强逐渐减弱
3CuSO4+2Al==
Al2(SO4)3+3Cu
2AgNO3+
Cu==Cu(NO3)2+2Ag
⒊盐+金属→新盐+新金属
⒊盐+金属→新盐+新金属
结论:在金属活动顺序中,只有排
在前面的金属,才能把排在
后面的金属从它们的盐溶液
里置换出来。
★不用K、Ca、Na去置换盐溶液的金属
盐+盐→两种新盐
?
盐
溶液
盐
溶液
现象
NaCl
AgNO3
溶液中____________
Na2SO4
BaCl2
溶液中
____________
生成白色沉淀
生成白色沉淀
AgNO3+
NaCl==AgCl↓+NaNO3
BaCl2+
Na2SO4==BaSO4↓+2NaCl
⒊盐+盐→两种新盐
盐
金属
酸
碱
盐
盐+金属
盐+酸
盐+碱
盐+盐
Na2CO3+2HCl==2NaCl+H2O+CO2↑
AgNO3+HCl==AgCl↓+HNO3
Zn+
H2SO4==
ZnSO4+
H2↑
ZnO+
H2SO4==
ZnSO4+
H2O
Zn(OH)2+
H2SO4==
ZnSO4+
2H2O
ZnCO3+
H2SO4==
ZnSO4+
H2O+CO2↑
Zn+FeSO4==ZnSO4+Fe
讨论:举出四种制备硫酸锌的方法
◆
◆
◆
复分解反应包括:
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸+金属氧化物——盐+水
由两种化合物相互交换成分,生成另外两种化合物的反应。
盐+酸→新盐+新酸
AgNO3+
HCl
==
AgCl
+
HNO3
BaCl2+H2SO4==BaSO4
+2HCl
CaCO3+2HCl==CaCl2+
+CO2
盐+碱→新盐+新碱
CuSO4+2NaOH==Na2SO4+Cu(OH)2
FeCl3+3NaOH==3NaCl+Fe(OH)3
Na2CO3+Ca(OH)2==CaCO3
+2NaOH
盐+盐→两种新盐
AgNO3+
NaCl==AgCl
+NaNO3
BaCl2+
Na2SO4==BaSO4
+2NaCl
酸+碱→盐+水
2HCl+
Ca(OH)2==CaCl2+2
H2SO4+
2NaOH==Na2SO4+
↓
↓
↓
↓
↓
↓
↓
H2O
↑
H2O
H2O
NaCl+KNO3→
?
二、复分解反应发生的条件
反应物:有酸可不溶,无酸都需溶
生成物:沉淀、气体或水
酸、碱、盐的溶解性口诀
常见酸能溶于水,
碱溶钾、钠、钡、氨、钙,
钾、钠、硝、铵盐溶水快,
硫酸盐不溶硫酸钡,
氯化物不溶氯化银,
碳酸盐只溶钾、钠、铵。
酸
碱
盐
金属氧化物
盐
非金属氧化物
金属
盐
金属
+
酸
盐
+
金属
碱性氧化物
+
酸
碱
+
酸性氧化物
酸
+
碱
碱
+
盐
盐
+
盐
盐
+
酸
下列几组物质能否在水溶液里发生反应,若不反应说明理由
⑴Zn+Pb(NO3)2
⑵Cu+
Hg(NO3)2
⑶Cu+FeCl2
⑷3AgNO3+FeCl3
⑸BaCl2+(NH4)2SO4
⑹AgCl+NaNO3
⑺Ca(OH)2+Na2CO3
⑻Na2SO4+HCl
⑼Ag2CO3+2HCl
⑽Cu+HCl
==
Pb
+Zn(NO3)2
==
Hg
+Cu(NO3)2
≠不反应
==3AgCl↓+Fe(NO3)3
==BaSO4↓+2NH4Cl
≠不反应
==CaCO3↓+2NaOH
≠不反应
==AgCl↓+H2O+CO2↑
≠不反应
一、下列复分解反应不能发生的是:
A、NaCl+Na2CO3
B、Zn(OH)2+CuSO4
C、FeCl3+NaOH
D、NaCl+KNO3
E、CaCl2+Na2CO3
F、Na2CO3+HNO3
G、Cu(OH)2+HCl
H、NaNO3+H2SO4
I、AgCl+HNO3
J、BaCO3+H2SO4
练习:
A、B、D、H、I
二、完成下列物质的转化
1)CuO
CuSO4
Cu(OH)2
CuCl2
2)FeCl3
Fe(OH)3
Fe2(SO4)3
3)NaCl
NaNO3
4)H2SO4
HCl
6)H2SO4
MgSO4
5)NaOH
Mg(OH)2
氧化镁 氢氧化钠溶液 稀硫酸
硫酸铜溶液 氯化钡溶液
二氧化碳
三、写出下列物质中两两之间能相互发生反应的化学方程式:
MgO
NaOH
H2SO4
CuSO4
BaCl2
CO2
1
2
3
4
5
6
1+3
2+3
2+4
2+6
3+5
4+5
各举一例酸、碱、盐,写出它们
之间相互反应的化学方程式。
如:H2SO4
NaOH
BaCl2
H2SO4+2NaOH==Na2SO4+2H2O
H2SO4+BaCl2==BaSO4↓+2HCl
★盐的性质
金属→新金属+新盐
酸
→新盐+新酸
盐
+
碱
→新盐+新碱
盐
→两种新盐
★复分解反应发生的条件
反应物:均可溶于水(包括溶于酸)
生成物:沉淀、气体或水
同课章节目录
