人教版高中化学必修Ⅱ3.3.1乙醇(共21张ppt)
文档属性
| 名称 | 人教版高中化学必修Ⅱ3.3.1乙醇(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-21 17:08:28 | ||
图片预览







文档简介
(共21张PPT)
?第三节?生活中常见的有机物
第一课时??乙醇
诗歌填空
劝君更尽一杯
,西出阳关无故人。
醉翁之意不在
,在乎山水之间也。
东篱把
黄昏后,有暗香盈袖。
酒
酒
酒
杜康将未吃完的剩饭,放置在桑园的树洞里,剩饭在
洞中发酵后,有芳香的气味传出,这就是酒的由来。
酒的主要成分是
乙醇的物理性质
乙醇俗称酒精,是无色、有特殊香味的液体。
密度比水小,20℃时,为0.789g/cm3,沸点78.5℃,熔点
-117.3℃,易挥发。
能够溶解多种有机物和无机物,能与水以任意比互溶。
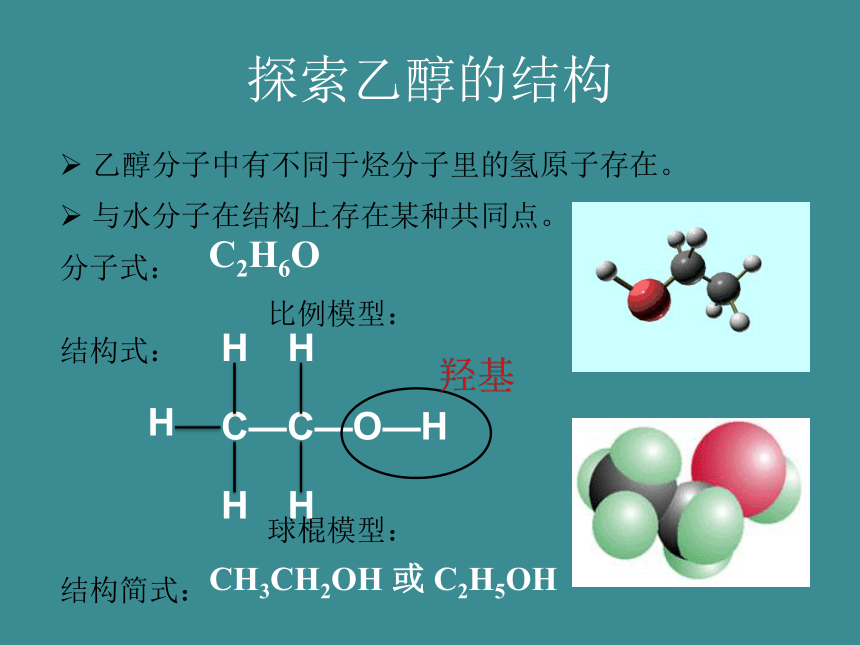
探索乙醇的结构
实验室用什么保存钠?为什么不使用乙醇?
乙醇分子里的氢与烃分子里的氢相同吗?乙醇分子可能是什么结构呢?
或
探索乙醇的结构
视频播放:
水与钠反应:http://my.tv./us/5371266/3917551.shtml?fromvsogou
乙醇与钠反应:
http://www./u19/v_MTM5Nzk2ODk2.html?fromvsogou
比较钠与水、乙醇的反应,完成下表:
探索乙醇的结构
无水乙醇与Na的反应比起水跟Na的反应要缓和得多;
反应过程中有气体放出,经检验确认为H2。
金属钠的变化
气体燃烧现象
检验产物
水
乙醇
“浮、熔、
游、响”
“沉、不熔、
不响”
发出淡蓝
色火焰
发出淡蓝色
火焰,烧杯
内壁有水珠
加酚酞后溶液变红,
说明有碱(NaOH)
生成。
烧杯中石灰水无明显
现象,说明无CO2生
成;
探索乙醇的结构
乙醇分子中有不同于烃分子里的氢原子存在。
与水分子在结构上存在某种共同点。
分子式:
比例模型:
结构式:
球棍模型:
结构简式:
C2H6O
C—C—O—H
H
H
H
H
H
CH3CH2OH
或
C2H5OH
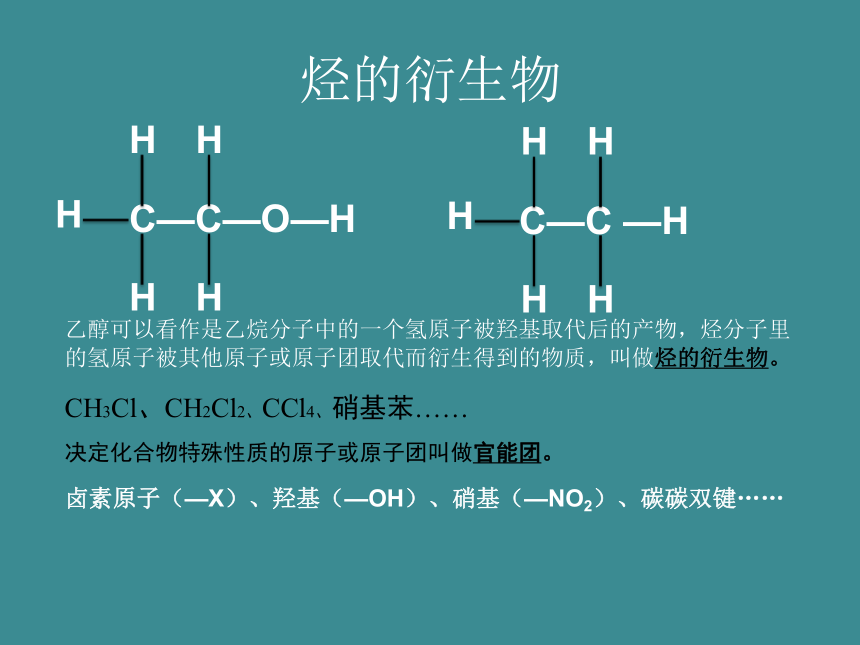
烃的衍生物
乙醇可以看作是乙烷分子中的一个氢原子被羟基取代后的产物,烃分子里的氢原子被其他原子或原子团取代而衍生得到的物质,叫做烃的衍生物。
CH3Cl、CH2Cl2、CCl4、硝基苯……
决定化合物特殊性质的原子或原子团叫做官能团。
卤素原子(—X)、羟基(—OH)、硝基(—NO2)、碳碳双键……
C—C—O—H
H
H
H
H
H
C—C
—H
H
H
H
H
H
乙醇的化学性质
乙醇的化学性质
乙醇与金属钠的反应
在该反应中,金属钠置换了羟基中的氢,生成了氢气和乙醇钠。
O-H键断开
注意:羟基中的H原子的活泼性:醇<水
C—C—O—H
H
H
H
H
H
乙醇钠
2CH3CH2OH
+
2Na
2CH3CH2ONa
+
H2↑
乙醇的化学性质
乙醇的氧化反应
2004年10月19日,巴西飞机制造商恩布拉尔试飞一种号称是全世界第一架不用燃油、而是以酒精为燃料的飞机。
乙醇的燃烧:
现象:产生淡蓝色火焰,放出大量热。
2CO2
+3H2O
C2H5OH
+
3
O2
点燃
乙醇的化学性质
焊接银器、铜器时,表面会生成发黑的氧化膜,银匠只要先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初。
乙醇的化学性质
乙醇的催化氧化
实验探究:
在试管中加入2mL无水乙醇,把光亮的铜丝绕成螺旋状,在酒精灯的外焰上加热烧红,当表面生成一层黑色的氧化铜时,趁热插到盛有乙醇的试管底部,反复操作几次。
观察到了什么现象?
整个过程中,发生了哪些化学反应?Cu的作用是什么?
乙醇的化学性质
乙醇的催化氧化
实验现象:
加热变黑的铜丝伸入乙醇后又变为光亮的红色,反复经历红色→黑色→红色的颜色变化,有大量的气泡,有刺激性气味气体生成。
化学反应:
红变黑:
黑变红,并产生特殊气味的气体:
2Cu
+
O2
2CuO
△
乙醇的化学性质
乙醇的催化氧化
总反应式及断键部位:
CH3CH2OH+CuO
CH3CHO+Cu+H2O
△
乙醛
乙醇
2Cu
+
O2
2CuO
红色变为黑色
△
2CH3—C—O—H
H
H
+
O2
2CH3CHO+2H2O
Cu或Ag
△
①
②
①、②位断键
注意:实际的氧化剂是CuO,Cu的作用是催化剂
乙醇的化学性质
交通警察检查司机是否酒后驾车的装置中,含有橙色的酸性重铬酸钾,当其遇到乙醇时橙色变为绿色,由此可以判定司机是否酒后驾车。
乙醇还可以与酸性高锰酸钾溶液或酸性重铬酸钾溶液反应,直接被氧化成乙酸。
乙醇的用途
结构决定性质,性质决定用途,乙醇有哪些用途?
燃料
良好的有机溶剂
制造香精、饮料
医用消毒剂(体积分数75%)
作为化工原料,制乙酸、乙烯等
……
饮料
溶剂
练习
1、下列有关乙醇的物理性质的应用中不正确的是
(
)
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
A
练习
2、能证明乙醇分子中含有一个羟基的事实是(
)
A.乙醇完全燃烧生成水
B.0.1mol乙醇与足量金属钠反应生成0.05mol
H2
C.乙醇能与水以任意比例互溶
D.乙醇容易挥发
B
练习
3、醇分子中不同的化学键,如右图:关于乙醇在各种反应中断裂键的说法不正确的是(
)
A.乙醇和钠反应,键①断裂
B.在铜催化下和O2反应,键①③断裂
C.乙醇完全燃烧时所有键断裂。
D.在铜催化下和O2反应,键①②断裂
D
小结
乙醇
物理性质
结构
化学性质
与金属钠反应
氧化反应
燃烧
催化氧化
被直接氧化为乙酸(检验酒驾)
用途
C—C—O—H
H
H
H
H
H
①
②
①位断键
①、②位断键
均断键
?第三节?生活中常见的有机物
第一课时??乙醇
诗歌填空
劝君更尽一杯
,西出阳关无故人。
醉翁之意不在
,在乎山水之间也。
东篱把
黄昏后,有暗香盈袖。
酒
酒
酒
杜康将未吃完的剩饭,放置在桑园的树洞里,剩饭在
洞中发酵后,有芳香的气味传出,这就是酒的由来。
酒的主要成分是
乙醇的物理性质
乙醇俗称酒精,是无色、有特殊香味的液体。
密度比水小,20℃时,为0.789g/cm3,沸点78.5℃,熔点
-117.3℃,易挥发。
能够溶解多种有机物和无机物,能与水以任意比互溶。
探索乙醇的结构
实验室用什么保存钠?为什么不使用乙醇?
乙醇分子里的氢与烃分子里的氢相同吗?乙醇分子可能是什么结构呢?
或
探索乙醇的结构
视频播放:
水与钠反应:http://my.tv./us/5371266/3917551.shtml?fromvsogou
乙醇与钠反应:
http://www./u19/v_MTM5Nzk2ODk2.html?fromvsogou
比较钠与水、乙醇的反应,完成下表:
探索乙醇的结构
无水乙醇与Na的反应比起水跟Na的反应要缓和得多;
反应过程中有气体放出,经检验确认为H2。
金属钠的变化
气体燃烧现象
检验产物
水
乙醇
“浮、熔、
游、响”
“沉、不熔、
不响”
发出淡蓝
色火焰
发出淡蓝色
火焰,烧杯
内壁有水珠
加酚酞后溶液变红,
说明有碱(NaOH)
生成。
烧杯中石灰水无明显
现象,说明无CO2生
成;
探索乙醇的结构
乙醇分子中有不同于烃分子里的氢原子存在。
与水分子在结构上存在某种共同点。
分子式:
比例模型:
结构式:
球棍模型:
结构简式:
C2H6O
C—C—O—H
H
H
H
H
H
CH3CH2OH
或
C2H5OH
烃的衍生物
乙醇可以看作是乙烷分子中的一个氢原子被羟基取代后的产物,烃分子里的氢原子被其他原子或原子团取代而衍生得到的物质,叫做烃的衍生物。
CH3Cl、CH2Cl2、CCl4、硝基苯……
决定化合物特殊性质的原子或原子团叫做官能团。
卤素原子(—X)、羟基(—OH)、硝基(—NO2)、碳碳双键……
C—C—O—H
H
H
H
H
H
C—C
—H
H
H
H
H
H
乙醇的化学性质
乙醇的化学性质
乙醇与金属钠的反应
在该反应中,金属钠置换了羟基中的氢,生成了氢气和乙醇钠。
O-H键断开
注意:羟基中的H原子的活泼性:醇<水
C—C—O—H
H
H
H
H
H
乙醇钠
2CH3CH2OH
+
2Na
2CH3CH2ONa
+
H2↑
乙醇的化学性质
乙醇的氧化反应
2004年10月19日,巴西飞机制造商恩布拉尔试飞一种号称是全世界第一架不用燃油、而是以酒精为燃料的飞机。
乙醇的燃烧:
现象:产生淡蓝色火焰,放出大量热。
2CO2
+3H2O
C2H5OH
+
3
O2
点燃
乙醇的化学性质
焊接银器、铜器时,表面会生成发黑的氧化膜,银匠只要先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初。
乙醇的化学性质
乙醇的催化氧化
实验探究:
在试管中加入2mL无水乙醇,把光亮的铜丝绕成螺旋状,在酒精灯的外焰上加热烧红,当表面生成一层黑色的氧化铜时,趁热插到盛有乙醇的试管底部,反复操作几次。
观察到了什么现象?
整个过程中,发生了哪些化学反应?Cu的作用是什么?
乙醇的化学性质
乙醇的催化氧化
实验现象:
加热变黑的铜丝伸入乙醇后又变为光亮的红色,反复经历红色→黑色→红色的颜色变化,有大量的气泡,有刺激性气味气体生成。
化学反应:
红变黑:
黑变红,并产生特殊气味的气体:
2Cu
+
O2
2CuO
△
乙醇的化学性质
乙醇的催化氧化
总反应式及断键部位:
CH3CH2OH+CuO
CH3CHO+Cu+H2O
△
乙醛
乙醇
2Cu
+
O2
2CuO
红色变为黑色
△
2CH3—C—O—H
H
H
+
O2
2CH3CHO+2H2O
Cu或Ag
△
①
②
①、②位断键
注意:实际的氧化剂是CuO,Cu的作用是催化剂
乙醇的化学性质
交通警察检查司机是否酒后驾车的装置中,含有橙色的酸性重铬酸钾,当其遇到乙醇时橙色变为绿色,由此可以判定司机是否酒后驾车。
乙醇还可以与酸性高锰酸钾溶液或酸性重铬酸钾溶液反应,直接被氧化成乙酸。
乙醇的用途
结构决定性质,性质决定用途,乙醇有哪些用途?
燃料
良好的有机溶剂
制造香精、饮料
医用消毒剂(体积分数75%)
作为化工原料,制乙酸、乙烯等
……
饮料
溶剂
练习
1、下列有关乙醇的物理性质的应用中不正确的是
(
)
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
A
练习
2、能证明乙醇分子中含有一个羟基的事实是(
)
A.乙醇完全燃烧生成水
B.0.1mol乙醇与足量金属钠反应生成0.05mol
H2
C.乙醇能与水以任意比例互溶
D.乙醇容易挥发
B
练习
3、醇分子中不同的化学键,如右图:关于乙醇在各种反应中断裂键的说法不正确的是(
)
A.乙醇和钠反应,键①断裂
B.在铜催化下和O2反应,键①③断裂
C.乙醇完全燃烧时所有键断裂。
D.在铜催化下和O2反应,键①②断裂
D
小结
乙醇
物理性质
结构
化学性质
与金属钠反应
氧化反应
燃烧
催化氧化
被直接氧化为乙酸(检验酒驾)
用途
C—C—O—H
H
H
H
H
H
①
②
①位断键
①、②位断键
均断键
