人教版高中化学必修二1.3化学键(共23张ppt)
文档属性
| 名称 | 人教版高中化学必修二1.3化学键(共23张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 768.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-21 17:24:38 | ||
图片预览







文档简介
(共23张PPT)
第一章
物质结构
元素周期表
第三节
化学健
实验1—2:钠在氯气中燃烧
现象
化学方程式
Na在Cl2中剧烈燃烧,产生黄色火焰,集气瓶中充满白烟
2Na
+
Cl2
====
2NaCl
点燃
思考与交流:
试从原子结构角度解释NaCl是怎样形成的。
Na+
Cl-
电子转移
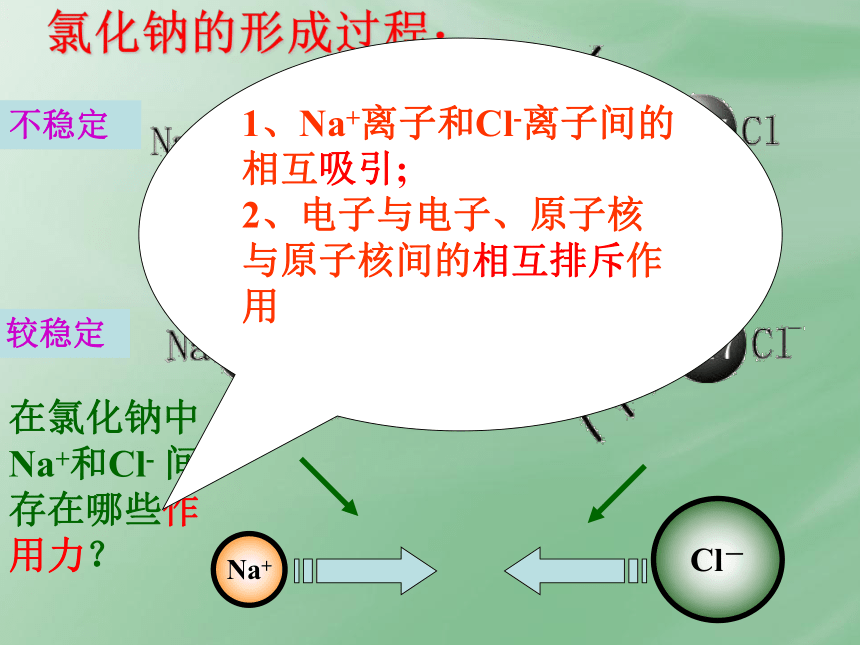
氯化钠的形成过程:
不稳定
较稳定
在氯化钠中Na+和Cl-
间存在哪些作用力?
1、Na+离子和Cl-离子间的相互吸引;
2、电子与电子、原子核与原子核间的相互排斥作用
化学键
1、离子键
(1)定义:带相反电荷离子之间的相互作用称为离子键。
(2)
构成离子键的粒子:
阴、阳离子
(3)离子键的实质:
静电作用
静电引力
静电斥力
(4)成键条件
①活泼金属和活泼非金属化合是易形成离子键。(AlCl3例外)
由离子键构成的化合物叫做离子化合物。
H
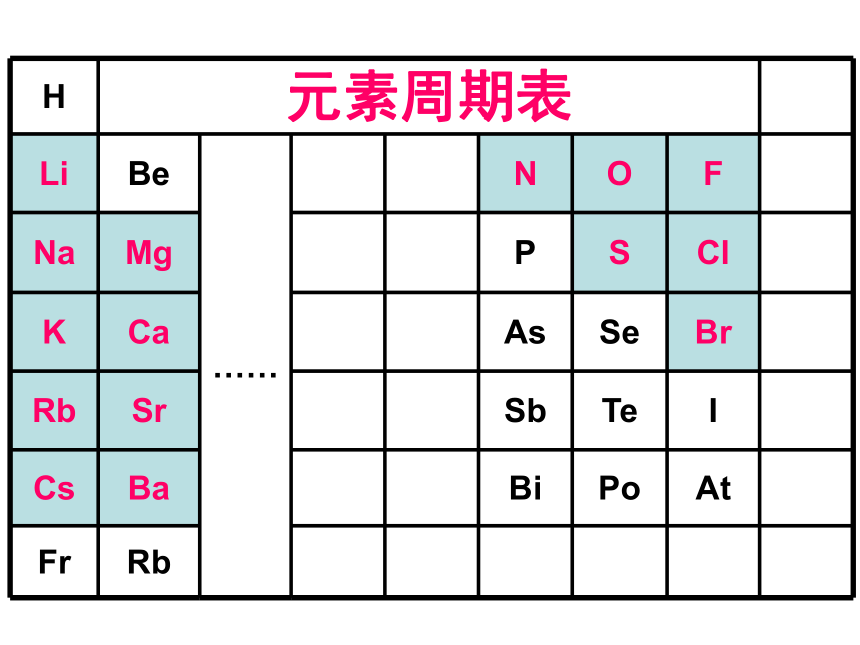
元素周期表
Li
Be
……
N
O
F
Na
Mg
P
S
Cl
K
Ca
As
Se
Br
Rb
Sr
Sb
Te
I
Cs
Ba
Bi
Po
At
Fr
Rb
思考
哪些物质属于离子化合物,含有离子键?
活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间形成的化合物以及铵盐。
强碱、大部分金属氧化物
、大部分盐:
如:KCl、Na2O、Na2S、MgCl2等
如:NaOH、KOH、MgO、Na2O2、
K2SO4、Na2CO3、Mg(NO3)2
NH4Cl
[NH4]2SO4
[NH4]2S等
课堂练习
练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠离子与氯离子通过离子键结合形成氯化钠
D
练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12
B.8与17
C.
11与17
D.6与14
C
二、表示方法
在元素符号周围用“.”或“x”表示最外层电子的式子叫电子式
在元素符号周围用“
·
”或“×”来表示原子最外层电子的式子,叫电子式。
·Mg
·
·O·
··
··
Cl
·
··
··
··
1、原子的电子式:
原子的电子式:在元素符号周围用小点“.”或小叉“×”来表示其最外层电子数。
电子式
·
C
·
·
·
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Na
·
F
2、离子的电子式:
阳离子的电子式:简单阳离子的电子式就是它的离子符号,复杂阳离子(NH4+)例外。
Na+
Ca2+
[
O
]2-
··
··
:
:
[
Cl
]-
··
··
:
:
阴离子的电子式:不但要画出最外层电子数,而且还要用中括号“[
]”括起来,并在右上角标出所带电荷“n-”。
[
练习]
写出下列微粒的电子式:
硫原子、
溴原子、
硫离子、溴离子、铝离子
·S·
··
··
Br
·
··
··
··
[
S
]2-
··
··
:
:
[
Br
]-
··
··
:
:
Al3+
w
离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并
书写时
少的写在中间多的写在两边
请同学们动笔写出H原子和Cl原子结构示意图,两种原子怎样才能形成稳定结构呢?
思考:
从微观角度分析氯化氢分子的形成过程
共用电子对
1.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
2.成键条件:同种或不同种非金属元素
3.仅含有共价键的化合物是共价化合物
二、共价键
成键微粒
本质
同种元素原子
不同种元素原子
原子吸引电子
能力相同
原子吸引电子
能力不相同
电子对不发生偏移成键原子不显电性
电子对发生偏移成键原子显电性
4.共价键的类型
H
H
··
Cl
··
··
H
··
··
极性共价键(极性键)
非极性共价键
(非极性键)
一些分子的电子式(P22表1-3)
[练习]
写出下列物质的电子式和结构式。
电子式
HCl
H2O
NH3
N2
CO2
H2O2
反馈检测:
1、下列物质中,只含有非极性共价键的是(
)
A、
NaBr
B、NaCI
C、
Br2
D、
H2S
C
CD
2、下列物质中,含有极性共价键的是(
)
A、I
2
B、MgCI2
C、
NaOH
D、
H2O
阅读课本P23讨论:
什么是化学键,并用化学键的观点来分析化学反应的本质是什么?
化学反应的实质
反应物分子被破坏
生成物分子生成
旧化学键被破坏
新化学键的生成
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
离子键和共价键的比较
[小结]
离子键
共价键
成键微粒
阴、阳离子
原子
相互作用
静电作用
共用电子对
成键元素
活泼的金属元素(IA,IIA族)
和活泼的非金属元素(VIA,IIA族)
同种或不同种
非金属元素
存在
离子化合物中
某些离子化合物共价化合物
非金属单质中
第一章
物质结构
元素周期表
第三节
化学健
实验1—2:钠在氯气中燃烧
现象
化学方程式
Na在Cl2中剧烈燃烧,产生黄色火焰,集气瓶中充满白烟
2Na
+
Cl2
====
2NaCl
点燃
思考与交流:
试从原子结构角度解释NaCl是怎样形成的。
Na+
Cl-
电子转移
氯化钠的形成过程:
不稳定
较稳定
在氯化钠中Na+和Cl-
间存在哪些作用力?
1、Na+离子和Cl-离子间的相互吸引;
2、电子与电子、原子核与原子核间的相互排斥作用
化学键
1、离子键
(1)定义:带相反电荷离子之间的相互作用称为离子键。
(2)
构成离子键的粒子:
阴、阳离子
(3)离子键的实质:
静电作用
静电引力
静电斥力
(4)成键条件
①活泼金属和活泼非金属化合是易形成离子键。(AlCl3例外)
由离子键构成的化合物叫做离子化合物。
H
元素周期表
Li
Be
……
N
O
F
Na
Mg
P
S
Cl
K
Ca
As
Se
Br
Rb
Sr
Sb
Te
I
Cs
Ba
Bi
Po
At
Fr
Rb
思考
哪些物质属于离子化合物,含有离子键?
活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间形成的化合物以及铵盐。
强碱、大部分金属氧化物
、大部分盐:
如:KCl、Na2O、Na2S、MgCl2等
如:NaOH、KOH、MgO、Na2O2、
K2SO4、Na2CO3、Mg(NO3)2
NH4Cl
[NH4]2SO4
[NH4]2S等
课堂练习
练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠离子与氯离子通过离子键结合形成氯化钠
D
练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12
B.8与17
C.
11与17
D.6与14
C
二、表示方法
在元素符号周围用“.”或“x”表示最外层电子的式子叫电子式
在元素符号周围用“
·
”或“×”来表示原子最外层电子的式子,叫电子式。
·Mg
·
·O·
··
··
Cl
·
··
··
··
1、原子的电子式:
原子的电子式:在元素符号周围用小点“.”或小叉“×”来表示其最外层电子数。
电子式
·
C
·
·
·
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Na
·
F
2、离子的电子式:
阳离子的电子式:简单阳离子的电子式就是它的离子符号,复杂阳离子(NH4+)例外。
Na+
Ca2+
[
O
]2-
··
··
:
:
[
Cl
]-
··
··
:
:
阴离子的电子式:不但要画出最外层电子数,而且还要用中括号“[
]”括起来,并在右上角标出所带电荷“n-”。
[
练习]
写出下列微粒的电子式:
硫原子、
溴原子、
硫离子、溴离子、铝离子
·S·
··
··
Br
·
··
··
··
[
S
]2-
··
··
:
:
[
Br
]-
··
··
:
:
Al3+
w
离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并
书写时
少的写在中间多的写在两边
请同学们动笔写出H原子和Cl原子结构示意图,两种原子怎样才能形成稳定结构呢?
思考:
从微观角度分析氯化氢分子的形成过程
共用电子对
1.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
2.成键条件:同种或不同种非金属元素
3.仅含有共价键的化合物是共价化合物
二、共价键
成键微粒
本质
同种元素原子
不同种元素原子
原子吸引电子
能力相同
原子吸引电子
能力不相同
电子对不发生偏移成键原子不显电性
电子对发生偏移成键原子显电性
4.共价键的类型
H
H
··
Cl
··
··
H
··
··
极性共价键(极性键)
非极性共价键
(非极性键)
一些分子的电子式(P22表1-3)
[练习]
写出下列物质的电子式和结构式。
电子式
HCl
H2O
NH3
N2
CO2
H2O2
反馈检测:
1、下列物质中,只含有非极性共价键的是(
)
A、
NaBr
B、NaCI
C、
Br2
D、
H2S
C
CD
2、下列物质中,含有极性共价键的是(
)
A、I
2
B、MgCI2
C、
NaOH
D、
H2O
阅读课本P23讨论:
什么是化学键,并用化学键的观点来分析化学反应的本质是什么?
化学反应的实质
反应物分子被破坏
生成物分子生成
旧化学键被破坏
新化学键的生成
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
离子键和共价键的比较
[小结]
离子键
共价键
成键微粒
阴、阳离子
原子
相互作用
静电作用
共用电子对
成键元素
活泼的金属元素(IA,IIA族)
和活泼的非金属元素(VIA,IIA族)
同种或不同种
非金属元素
存在
离子化合物中
某些离子化合物共价化合物
非金属单质中
