山东省济宁市2020-2021学年高一上学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 山东省济宁市2020-2021学年高一上学期期末考试化学试题 Word版含答案 |

|
|
| 格式 | doc | ||
| 文件大小 | 887.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-22 08:09:23 | ||
图片预览


文档简介
绝密★启用前
济宁市2020~2021学年度第一学期质量检测
高 一 化 学 试 题 2021.01
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量: H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Cl:35.5 Cu:64
第I卷 选择题(共50分)
一、选择题(本题共20小题,第1~10题,每题2分;第11~20题,每题3分,共50分。每小题只有一个选项符合题意。)
1.当前新冠肺炎疫情防控形势复杂严俊,为了切断传播途径,经常会用到各类消毒剂。下列消毒剂不具有强氧化性的是
A.84消毒液 B.医用酒精
C.双氧水 D.二氧化氯
2.下列物质中,含有非极性共价键的是
A.KOH B.H2S
C.Na2O2 D.MgCl2
3.下列变化中只涉及物理变化的是
A.铁粉作食品的抗氧化剂 B.盐酸除锈
C.氯化铁作净水剂 D.氯气加压液化
4.经一束单色光照射,下列分散系中能出现明显丁达尔效应的是
A.澄清石灰水 B.氢氧化铁红褐色液体
C.饱和食盐水 D.石灰浆
5.下列各组性质的比较,正确的是
A.热稳定性:NaHCO3>Na2CO3 B.氧化性:Br2>I2
C.酸性:HClO>H2CO3 D.还原性:Cl->S2-
6.下列溶液中,能使铁粉溶解,但不会产生沉淀和气体的是
A.稀H2SO4 B.CuSO4溶液
C.Fe2(SO4)3 D.FeCl2
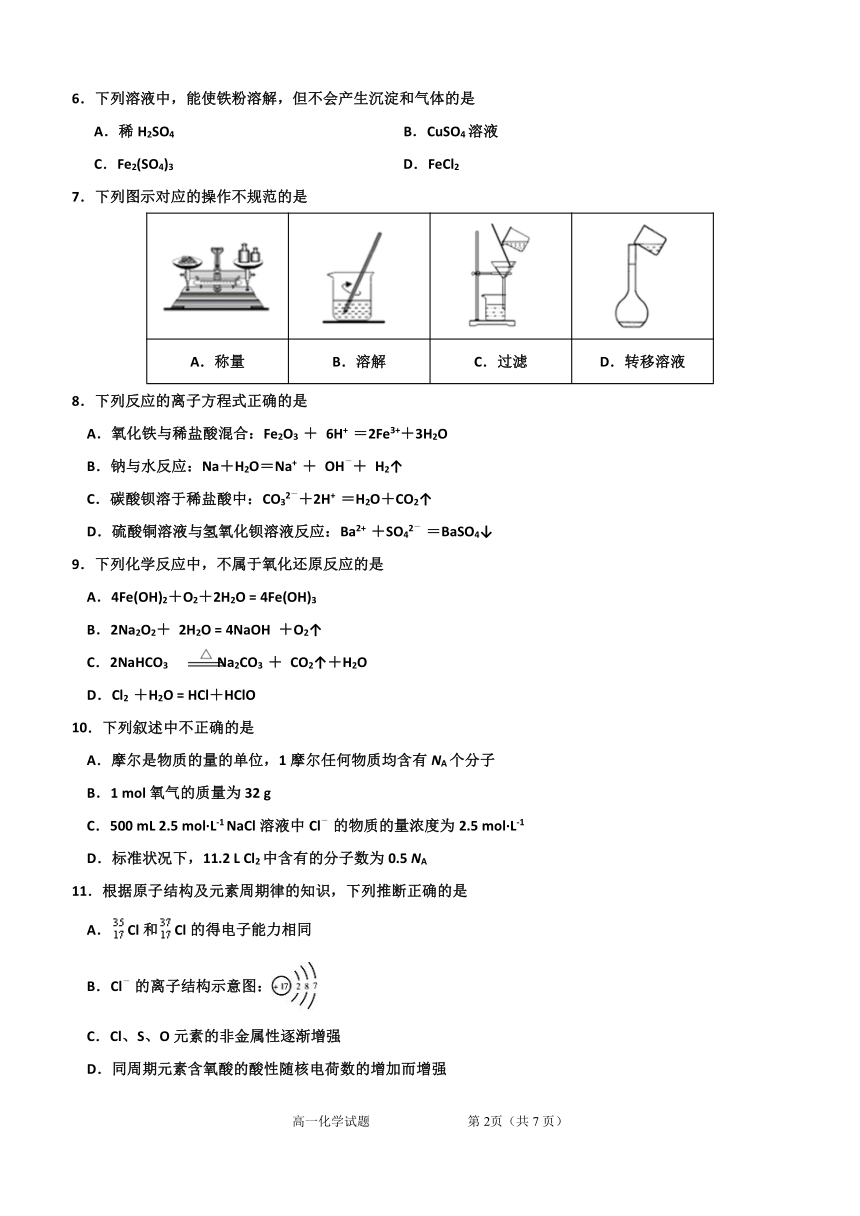
7.下列图示对应的操作不规范的是
A.称量 B.溶解 C.过滤 D.转移溶液
8.下列反应的离子方程式正确的是
A.氧化铁与稀盐酸混合:Fe2O3 + 6H+ =2Fe3++3H2O
B.钠与水反应:Na+H2O=Na+ + OH-+ H2↑
C.碳酸钡溶于稀盐酸中:CO32-+2H+ =H2O+CO2↑
D.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ +SO42- =BaSO4↓
9.下列化学反应中,不属于氧化还原反应的是
A.4Fe(OH)2+O2+2H2O = 4Fe(OH)3
B.2Na2O2+ 2H2O = 4NaOH +O2↑
C.2NaHCO3 Na2CO3 + CO2↑+H2O
D.Cl2 +H2O = HCl+HClO
10.下列叙述中不正确的是
A.摩尔是物质的量的单位,1摩尔任何物质均含有NA个分子
B.1 mol氧气的质量为32?g
C.500 mL 2.5 mol·L-1 NaCl溶液中Cl- 的物质的量浓度为2.5 mol·L-1
D.标准状况下,11.2 L?Cl2中含有的分子数为0.5 NA
11.根据原子结构及元素周期律的知识,下列推断正确的是
A.Cl和Cl的得电子能力相同
B.Cl- 的离子结构示意图:
C.Cl、S、O元素的非金属性逐渐增强
D.同周期元素含氧酸的酸性随核电荷数的增加而增强
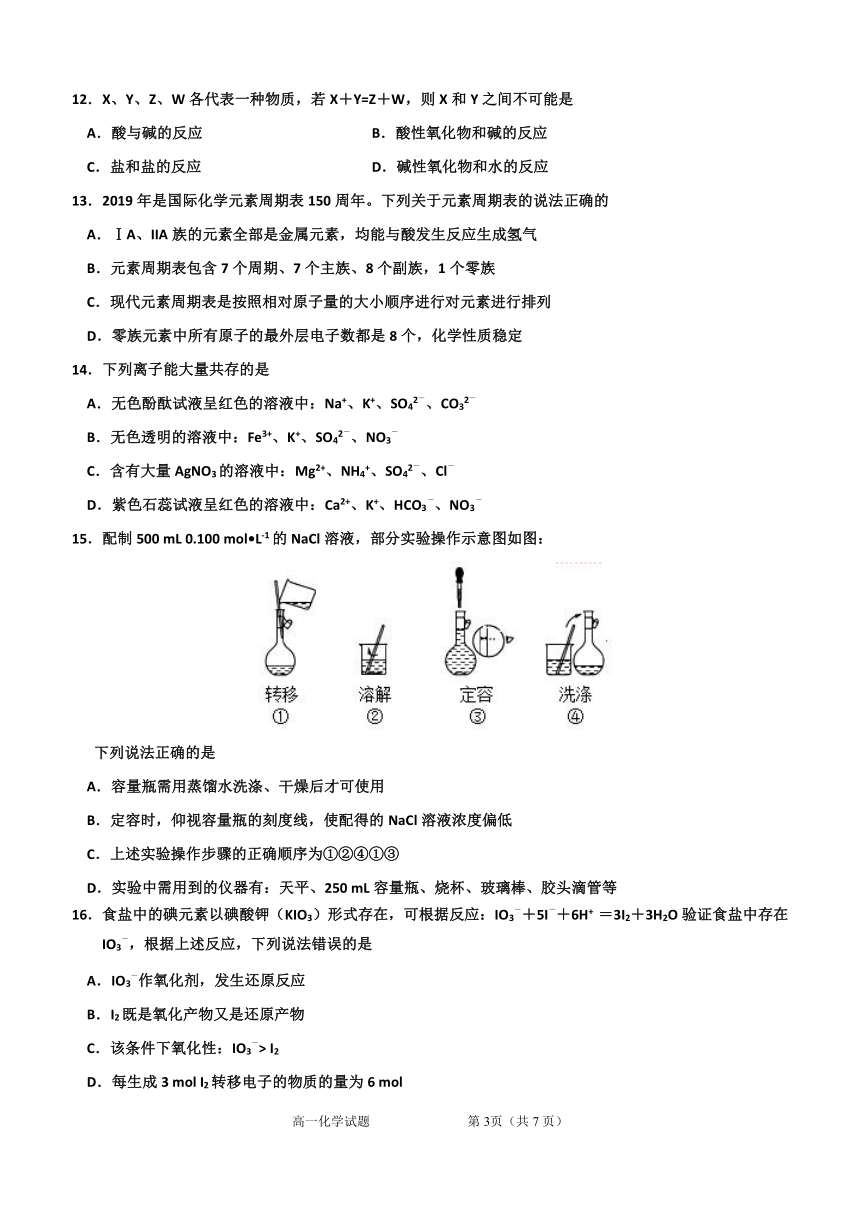
12.X、Y、Z、W各代表一种物质,若X+Y=Z+W,则X和Y之间不可能是
A.酸与碱的反应 B.酸性氧化物和碱的反应
C.盐和盐的反应 D.碱性氧化物和水的反应
13.2019年是国际化学元素周期表150周年。下列关于元素周期表的说法正确的
A.ⅠA、IIA族的元素全部是金属元素,均能与酸发生反应生成氢气
B.元素周期表包含7个周期、7个主族、8个副族,1个零族
C.现代元素周期表是按照相对原子量的大小顺序进行对元素进行排列
D.零族元素中所有原子的最外层电子数都是8个,化学性质稳定
14.下列离子能大量共存的是
A.无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32-
B.无色透明的溶液中:Fe3+、K+、SO42-、NO3-
C.含有大量AgNO3的溶液中:Mg2+、NH4+、SO42-、Cl-
D.紫色石蕊试液呈红色的溶液中:Ca2+、K+、HCO3-、NO3-
15.配制500 mL 0.100 mol?L-1的NaCl溶液,部分实验操作示意图如图:
下列说法正确的是
A.容量瓶需用蒸馏水洗涤、干燥后才可使用
B.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
C.上述实验操作步骤的正确顺序为①②④①③
D.实验中需用到的仪器有:天平、250 mL容量瓶、烧杯、玻璃棒、胶头滴管等
16.食盐中的碘元素以碘酸钾(KIO3)形式存在,可根据反应:IO3-+5I-+6H+ =3I2+3H2O验证食盐中存在IO3-,根据上述反应,下列说法错误的是
A.IO3-作氧化剂,发生还原反应
B.I2既是氧化产物又是还原产物
C.该条件下氧化性:IO3-> I2
D.每生成3 mol I2转移电子的物质的量为6 mol
17.某学生以铁丝和Cl2为原料进行下列三个实验。下列从分类角度分析不正确的是
A.实验①铁丝过量时产物为FeCl2
B.实验②中玻璃棒的作用为搅拌加速溶解
C.实验①、②涉及化合物均为电解质
D.实验③发生化学变化,最终得到的分散系为胶体
18.关于新制饱和氯水的说法不正确的是
A.氯水的颜色呈浅黄绿色
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀
C.氯水经光照后,颜色逐渐消失并放出气体,溶液的酸性增强
D.向氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
19.溴化碘(IBr)的化学性质与卤素(X2)很相似,下列说法不正确的是
A.溴化碘(IBr)为共价化合物
B.IBr与水的反应IBr+H2O=HBr+HIO,为非氧化还原反应
C.IBr与金属锌反应:2IBr+2Zn=ZnI2+ZnBr2,IBr作还原剂
D.在NaI和KBr混合溶液中通入少量Cl2:Cl2+2I- =2Cl-+I2
20.有①、②两个完全相同的装置,分别在装置①、②中加入1.06 g Na2CO3和0.84 g NaHCO3,然后再分别注入相同体积的盐酸,下列有关叙述正确的是
A.①、②装置中的气球都会膨胀,①装置中的气球膨胀的更快
B.若最终两气球体积不同,则盐酸溶液中n(HCl)≤0.01mol
C.若最终两气球体积相同,则盐酸溶液中n(HCl)≥0.02mol
D.溶液体积变化忽略不计,则最终两试管中Na+的物质的量浓度相等
第II卷非选择题(共50分)
注意事项:
1.考生务必在答题卡上规定的地方,将学校、班级、姓名、考号、座号填写清楚。
2.考生将第II卷的答案用0.5毫米黑色中性笔直接写在答题卡上。考试结束后,只收答题卡。
21.物质的分类是学习化学的一种重要方法,科学合理的分类对于系统掌握知识、提高学习效率、解决问题都有着重要的意义。
Ⅰ、厨房中有下列用品:
①食盐 ②小苏打 ③纯碱 ④食醋(主要成分为醋酸)。
(1)水溶液呈碱性的是 (填序号);
(2)食盐在水中的电离方程式是
(3)某同学将食盐、小苏打、纯碱划分为一类。该同学的分类依据为___________(填字母)
A.酸类 B.盐类 C.碱类 D.氧化物
(4)纯碱中含有少量NaCl,设计实验检验此混合物中的Cl-、CO32-。
实验操作步骤:将少量混合物加水溶解后,分别置于两支试管中。向第一支试管中加入稀盐酸,可观察到产生无色气泡,该反应的离子方程式为 ,说明溶液中存在CO32-;向第二支试管中先加入足量稀硝酸,再加入 溶液,可观察到白色沉淀,说明溶液中存在Cl-。
Ⅱ、右图是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。
(1)“纳米药物分子车”分散于水中所得的分散系 胶体
(填“属于”或“不属于”)。
(2)纳米级的Fe3O4(其中二价铁与三价铁个数比为1:2)
是一种非常重要的磁性材料。
①Fe3O4溶于稀盐酸的离子方程式为 。
②铁在氧气中燃烧生成Fe3O4,反应中每生成1mol Fe3O4转移 mol电子。
22.矿物白云母是一种重要的化工原料,其化学式的氧化物形式为:K2O·3Al2O3·6SiO2·2H2O。就其组成元素完成下列填空:
(1) Al 元素在元素周期表中的位置为 ,K2O的电子式为 。
(2)上述元素中(Si除外),形成的简单离子的半径由大到小的顺序为 (填离子符号)。
(3)简单氢化物的稳定性:H2O___________SiH4(填“>”、“<”或“=”)
(4)白云石所含的两种金属元素中,金属性较强的元素是 ,写出一个能说明这一事实的化学方程式 。
(5)已知硅酸(H2SiO3)为白色胶状沉淀。若要利用下图装置证明非金属性:
C>Si,则A中加 ,B中加Na2CO3,C中加 。
(可供选择的药品:稀硫酸、盐酸、稀硝酸、硅酸钠溶液、饱和碳酸氢钠溶液。)
23.已知氯气与碱反应时,产物受温度的影响。实验室中利用如图装置(部分
装置省略)制备KClO3和NaClO,并探究其氧化还原性质。
回答下列问题:
(1)仪器a的名称是
(2)装置A产生氯气的化学方程式为
(3)装置B中的试剂为___________, 该装置作用为___________。
(4)装置C采用的加热方式是___________,装置D中发生反应的离子反应方程式为___________。
(5)装置E的作用是 ,可选用试剂_____ (填标号)。
A.NaCl溶液 B.NaOH溶液 C.澄清石灰水 D.稀硫酸
(6)探究KClO3、NaClO的氧化能力
操作:向 1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3______ NaClO(填“大于”或“小于”)。
24.化学与人类生活、生产和社会可持续发展密切相关,请回答下列问题:
Ⅰ、(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式
(2)用1 L 1.0 mol·L-1的NaOH溶液吸收0.8 mol CO2,所得溶液Na2CO3中和NaHCO3物质的量浓度之比为
Ⅱ、如图为铁及其化合物的“价—类”二维图。
(1)①的类别是 ,②的化学式为
(2)向沸水中逐滴滴加饱和的FeCl3溶液,至液体呈红褐色,该分散系中分散质粒子的直径范围是
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出FeCl3溶液与铜箔发生反应的化学方程式 ,检验废腐蚀液中含有Fe3+的实验操作是
(4)某小组在探究Fe2+性质的实验中观察到异常现象(实验1),观察到溶液变红,片刻红色褪去,有气体生成(经检验为O2)。
用实验2探究“红色褪去”的原因,则红色褪去的原因是 。
济宁市2020~2021学年度第一学期期末考试
化学试题参考答案及评分标准细则 2021.01.27
选择题(本题共20小题,第1-10题,每题2分;第11-20题,每题3分,共50分。每小题只有一个选项符合题意。)
1 ~ 5 B C D B B 6~10 C D A C A
11~15 A D B A B 16~20 D A D C C
21.(13分)
Ⅰ、(1)②③ (2分,各1分) (2)NaCl=Na++Cl- (2分) (3) B (1分)
(4)CO+2H+=CO2↑+H2O (2分) AgNO3 (1分)
Ⅱ、(1)不属于 (1分)(2)Fe3O4+8H+=Fe2++2Fe3++4H2O (2分) 8 (2分)
22.(12分)
(1)第三周期第ⅢA族 (2分) (2分)
(2)K+>O2->Al3+>H+ (2分) (3) > (1分)
(4)K (1分) KOH+Al(OH)3=KAlO2+2H2O (2分)
(5)稀硫酸(1分) 硅酸钠溶液 (1分)
23.(12分)
(1)分液漏斗 (1分)
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(不写加热扣1分)(2分)
(3)饱和食盐水 (1分) 除去氯气中的氯化氢气体 (1分)
(4)水浴加热 (1分) 2OH-+Cl2=Cl-+ClO-+H2O (2分)
(5)吸收尾气Cl2,防止污染空气 (1分) B (1分)
(6)小于 (2分)
24.(13分)
Ⅰ、(1)Na2CO3+H2O+CO2=2NaHCO3 (2分) (2)1:3 (2分)
Ⅱ、(1)单质 (1分) Fe(OH)3 (1分) (2)1nm ~ 100nm (1分)
(3)2FeCl3+Cu=2FeCl2+CuCl2 (2分)
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+(2分)
(4)SCN-[或Fe(SCN)3]被氧化为SO42-(SCN-[或Fe(SCN)3]被氧化也给分)(2分)
高一化学试题 第8页(共7页)
济宁市2020~2021学年度第一学期质量检测
高 一 化 学 试 题 2021.01
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量: H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Cl:35.5 Cu:64
第I卷 选择题(共50分)
一、选择题(本题共20小题,第1~10题,每题2分;第11~20题,每题3分,共50分。每小题只有一个选项符合题意。)
1.当前新冠肺炎疫情防控形势复杂严俊,为了切断传播途径,经常会用到各类消毒剂。下列消毒剂不具有强氧化性的是
A.84消毒液 B.医用酒精
C.双氧水 D.二氧化氯
2.下列物质中,含有非极性共价键的是
A.KOH B.H2S
C.Na2O2 D.MgCl2
3.下列变化中只涉及物理变化的是
A.铁粉作食品的抗氧化剂 B.盐酸除锈
C.氯化铁作净水剂 D.氯气加压液化
4.经一束单色光照射,下列分散系中能出现明显丁达尔效应的是
A.澄清石灰水 B.氢氧化铁红褐色液体
C.饱和食盐水 D.石灰浆
5.下列各组性质的比较,正确的是
A.热稳定性:NaHCO3>Na2CO3 B.氧化性:Br2>I2
C.酸性:HClO>H2CO3 D.还原性:Cl->S2-
6.下列溶液中,能使铁粉溶解,但不会产生沉淀和气体的是
A.稀H2SO4 B.CuSO4溶液
C.Fe2(SO4)3 D.FeCl2
7.下列图示对应的操作不规范的是
A.称量 B.溶解 C.过滤 D.转移溶液
8.下列反应的离子方程式正确的是
A.氧化铁与稀盐酸混合:Fe2O3 + 6H+ =2Fe3++3H2O
B.钠与水反应:Na+H2O=Na+ + OH-+ H2↑
C.碳酸钡溶于稀盐酸中:CO32-+2H+ =H2O+CO2↑
D.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ +SO42- =BaSO4↓
9.下列化学反应中,不属于氧化还原反应的是
A.4Fe(OH)2+O2+2H2O = 4Fe(OH)3
B.2Na2O2+ 2H2O = 4NaOH +O2↑
C.2NaHCO3 Na2CO3 + CO2↑+H2O
D.Cl2 +H2O = HCl+HClO
10.下列叙述中不正确的是
A.摩尔是物质的量的单位,1摩尔任何物质均含有NA个分子
B.1 mol氧气的质量为32?g
C.500 mL 2.5 mol·L-1 NaCl溶液中Cl- 的物质的量浓度为2.5 mol·L-1
D.标准状况下,11.2 L?Cl2中含有的分子数为0.5 NA
11.根据原子结构及元素周期律的知识,下列推断正确的是
A.Cl和Cl的得电子能力相同
B.Cl- 的离子结构示意图:
C.Cl、S、O元素的非金属性逐渐增强
D.同周期元素含氧酸的酸性随核电荷数的增加而增强
12.X、Y、Z、W各代表一种物质,若X+Y=Z+W,则X和Y之间不可能是
A.酸与碱的反应 B.酸性氧化物和碱的反应
C.盐和盐的反应 D.碱性氧化物和水的反应
13.2019年是国际化学元素周期表150周年。下列关于元素周期表的说法正确的
A.ⅠA、IIA族的元素全部是金属元素,均能与酸发生反应生成氢气
B.元素周期表包含7个周期、7个主族、8个副族,1个零族
C.现代元素周期表是按照相对原子量的大小顺序进行对元素进行排列
D.零族元素中所有原子的最外层电子数都是8个,化学性质稳定
14.下列离子能大量共存的是
A.无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32-
B.无色透明的溶液中:Fe3+、K+、SO42-、NO3-
C.含有大量AgNO3的溶液中:Mg2+、NH4+、SO42-、Cl-
D.紫色石蕊试液呈红色的溶液中:Ca2+、K+、HCO3-、NO3-
15.配制500 mL 0.100 mol?L-1的NaCl溶液,部分实验操作示意图如图:
下列说法正确的是
A.容量瓶需用蒸馏水洗涤、干燥后才可使用
B.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
C.上述实验操作步骤的正确顺序为①②④①③
D.实验中需用到的仪器有:天平、250 mL容量瓶、烧杯、玻璃棒、胶头滴管等
16.食盐中的碘元素以碘酸钾(KIO3)形式存在,可根据反应:IO3-+5I-+6H+ =3I2+3H2O验证食盐中存在IO3-,根据上述反应,下列说法错误的是
A.IO3-作氧化剂,发生还原反应
B.I2既是氧化产物又是还原产物
C.该条件下氧化性:IO3-> I2
D.每生成3 mol I2转移电子的物质的量为6 mol
17.某学生以铁丝和Cl2为原料进行下列三个实验。下列从分类角度分析不正确的是
A.实验①铁丝过量时产物为FeCl2
B.实验②中玻璃棒的作用为搅拌加速溶解
C.实验①、②涉及化合物均为电解质
D.实验③发生化学变化,最终得到的分散系为胶体
18.关于新制饱和氯水的说法不正确的是
A.氯水的颜色呈浅黄绿色
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀
C.氯水经光照后,颜色逐渐消失并放出气体,溶液的酸性增强
D.向氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
19.溴化碘(IBr)的化学性质与卤素(X2)很相似,下列说法不正确的是
A.溴化碘(IBr)为共价化合物
B.IBr与水的反应IBr+H2O=HBr+HIO,为非氧化还原反应
C.IBr与金属锌反应:2IBr+2Zn=ZnI2+ZnBr2,IBr作还原剂
D.在NaI和KBr混合溶液中通入少量Cl2:Cl2+2I- =2Cl-+I2
20.有①、②两个完全相同的装置,分别在装置①、②中加入1.06 g Na2CO3和0.84 g NaHCO3,然后再分别注入相同体积的盐酸,下列有关叙述正确的是
A.①、②装置中的气球都会膨胀,①装置中的气球膨胀的更快
B.若最终两气球体积不同,则盐酸溶液中n(HCl)≤0.01mol
C.若最终两气球体积相同,则盐酸溶液中n(HCl)≥0.02mol
D.溶液体积变化忽略不计,则最终两试管中Na+的物质的量浓度相等
第II卷非选择题(共50分)
注意事项:
1.考生务必在答题卡上规定的地方,将学校、班级、姓名、考号、座号填写清楚。
2.考生将第II卷的答案用0.5毫米黑色中性笔直接写在答题卡上。考试结束后,只收答题卡。
21.物质的分类是学习化学的一种重要方法,科学合理的分类对于系统掌握知识、提高学习效率、解决问题都有着重要的意义。
Ⅰ、厨房中有下列用品:
①食盐 ②小苏打 ③纯碱 ④食醋(主要成分为醋酸)。
(1)水溶液呈碱性的是 (填序号);
(2)食盐在水中的电离方程式是
(3)某同学将食盐、小苏打、纯碱划分为一类。该同学的分类依据为___________(填字母)
A.酸类 B.盐类 C.碱类 D.氧化物
(4)纯碱中含有少量NaCl,设计实验检验此混合物中的Cl-、CO32-。
实验操作步骤:将少量混合物加水溶解后,分别置于两支试管中。向第一支试管中加入稀盐酸,可观察到产生无色气泡,该反应的离子方程式为 ,说明溶液中存在CO32-;向第二支试管中先加入足量稀硝酸,再加入 溶液,可观察到白色沉淀,说明溶液中存在Cl-。
Ⅱ、右图是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。
(1)“纳米药物分子车”分散于水中所得的分散系 胶体
(填“属于”或“不属于”)。
(2)纳米级的Fe3O4(其中二价铁与三价铁个数比为1:2)
是一种非常重要的磁性材料。
①Fe3O4溶于稀盐酸的离子方程式为 。
②铁在氧气中燃烧生成Fe3O4,反应中每生成1mol Fe3O4转移 mol电子。
22.矿物白云母是一种重要的化工原料,其化学式的氧化物形式为:K2O·3Al2O3·6SiO2·2H2O。就其组成元素完成下列填空:
(1) Al 元素在元素周期表中的位置为 ,K2O的电子式为 。
(2)上述元素中(Si除外),形成的简单离子的半径由大到小的顺序为 (填离子符号)。
(3)简单氢化物的稳定性:H2O___________SiH4(填“>”、“<”或“=”)
(4)白云石所含的两种金属元素中,金属性较强的元素是 ,写出一个能说明这一事实的化学方程式 。
(5)已知硅酸(H2SiO3)为白色胶状沉淀。若要利用下图装置证明非金属性:
C>Si,则A中加 ,B中加Na2CO3,C中加 。
(可供选择的药品:稀硫酸、盐酸、稀硝酸、硅酸钠溶液、饱和碳酸氢钠溶液。)
23.已知氯气与碱反应时,产物受温度的影响。实验室中利用如图装置(部分
装置省略)制备KClO3和NaClO,并探究其氧化还原性质。
回答下列问题:
(1)仪器a的名称是
(2)装置A产生氯气的化学方程式为
(3)装置B中的试剂为___________, 该装置作用为___________。
(4)装置C采用的加热方式是___________,装置D中发生反应的离子反应方程式为___________。
(5)装置E的作用是 ,可选用试剂_____ (填标号)。
A.NaCl溶液 B.NaOH溶液 C.澄清石灰水 D.稀硫酸
(6)探究KClO3、NaClO的氧化能力
操作:向 1号(KClO3)和2号(NaClO)试管中,滴加中性KI溶液。
现象:1号试管溶液颜色不变,2号试管溶液变为棕色。
结论:该条件下氧化能力KClO3______ NaClO(填“大于”或“小于”)。
24.化学与人类生活、生产和社会可持续发展密切相关,请回答下列问题:
Ⅰ、(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式
(2)用1 L 1.0 mol·L-1的NaOH溶液吸收0.8 mol CO2,所得溶液Na2CO3中和NaHCO3物质的量浓度之比为
Ⅱ、如图为铁及其化合物的“价—类”二维图。
(1)①的类别是 ,②的化学式为
(2)向沸水中逐滴滴加饱和的FeCl3溶液,至液体呈红褐色,该分散系中分散质粒子的直径范围是
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出FeCl3溶液与铜箔发生反应的化学方程式 ,检验废腐蚀液中含有Fe3+的实验操作是
(4)某小组在探究Fe2+性质的实验中观察到异常现象(实验1),观察到溶液变红,片刻红色褪去,有气体生成(经检验为O2)。
用实验2探究“红色褪去”的原因,则红色褪去的原因是 。
济宁市2020~2021学年度第一学期期末考试
化学试题参考答案及评分标准细则 2021.01.27
选择题(本题共20小题,第1-10题,每题2分;第11-20题,每题3分,共50分。每小题只有一个选项符合题意。)
1 ~ 5 B C D B B 6~10 C D A C A
11~15 A D B A B 16~20 D A D C C
21.(13分)
Ⅰ、(1)②③ (2分,各1分) (2)NaCl=Na++Cl- (2分) (3) B (1分)
(4)CO+2H+=CO2↑+H2O (2分) AgNO3 (1分)
Ⅱ、(1)不属于 (1分)(2)Fe3O4+8H+=Fe2++2Fe3++4H2O (2分) 8 (2分)
22.(12分)
(1)第三周期第ⅢA族 (2分) (2分)
(2)K+>O2->Al3+>H+ (2分) (3) > (1分)
(4)K (1分) KOH+Al(OH)3=KAlO2+2H2O (2分)
(5)稀硫酸(1分) 硅酸钠溶液 (1分)
23.(12分)
(1)分液漏斗 (1分)
(2)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(不写加热扣1分)(2分)
(3)饱和食盐水 (1分) 除去氯气中的氯化氢气体 (1分)
(4)水浴加热 (1分) 2OH-+Cl2=Cl-+ClO-+H2O (2分)
(5)吸收尾气Cl2,防止污染空气 (1分) B (1分)
(6)小于 (2分)
24.(13分)
Ⅰ、(1)Na2CO3+H2O+CO2=2NaHCO3 (2分) (2)1:3 (2分)
Ⅱ、(1)单质 (1分) Fe(OH)3 (1分) (2)1nm ~ 100nm (1分)
(3)2FeCl3+Cu=2FeCl2+CuCl2 (2分)
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+(2分)
(4)SCN-[或Fe(SCN)3]被氧化为SO42-(SCN-[或Fe(SCN)3]被氧化也给分)(2分)
高一化学试题 第8页(共7页)
同课章节目录
