2011年高一化学精品课件:2.3.1 化学能转化为电能(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:2.3.1 化学能转化为电能(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 424.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 00:00:00 | ||
图片预览







文档简介
(共31张PPT)
第1课时 化学能转化为电能
第1课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、原电池的定义
把_____能转化为___能的装置叫做原电池。
二、原电池的构成条件
(1)电极材料,两种金属活动性不同的金属或金属和其他导电的材料(非金属或某些氧化物等)。
(2)两电极必须浸在___________中,两电极
之间要用导线连接,形成__________。
(3)_________ 反应自发进行。
化学
电
电解质溶液
闭合回路
氧化还原
思考感悟
下列装置能否形成原电池,其理由是什么?
【提示】 都不能。第一个没有形成闭合回路;第二个两个电极相同;第三个没有电解质溶液(乙醇是非电解质)。
三、原电池的工作原理
外电路中:较活泼金属材料作____,_____
电子,电子经外电路流向较不活泼金属或导体
(正极),而使外电路中产生电流。
内电路中:电解质溶液内,阳离子向_____移
动,阴离子向_____移动,使电流通过电解质
溶液。
四、电极反应
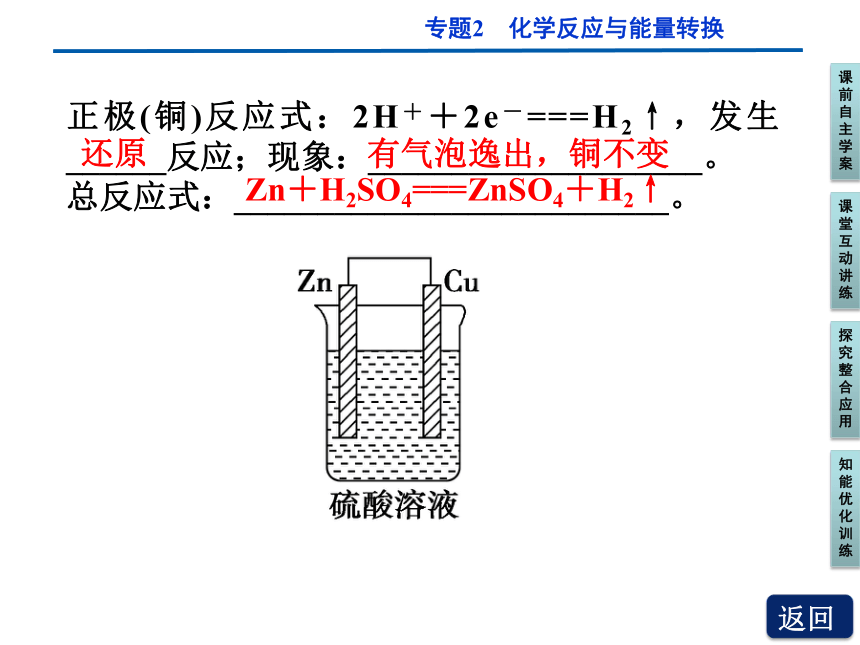
以铜—锌(稀硫酸)原电池为例,如图所示
负极(锌)反应式:________________,发生
_____反应;现象:____________。
负极
失去
正极
负极
氧化
Zn-2e-===Zn2+
锌不断溶解
正极(铜)反应式:2H++2e-===H2↑,发生______反应;现象:____________________。
总反应式:__________________________。
还原
有气泡逸出,铜不变
Zn+H2SO4===ZnSO4+H2↑
自主体验
1.关于原电池的叙述中正确的是( )
A.构成原电池的必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池工作时总是负极溶解,正极上有物质生成
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
答案:B
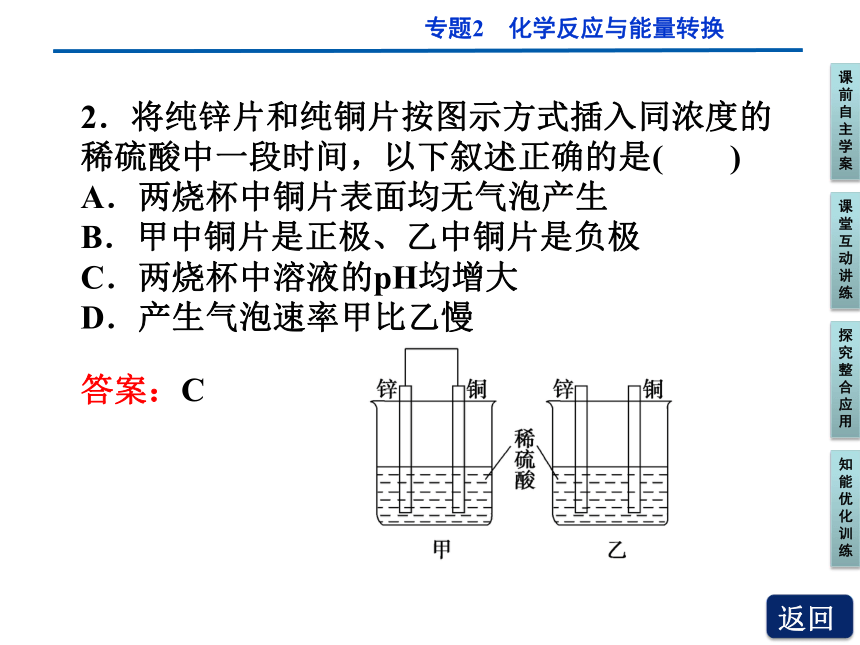
2.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极、乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡速率甲比乙慢
答案:C
3.对铜—锌—稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g ②锌片增重32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④
C.②和③ D.②和④
答案:A
课堂互动讲练
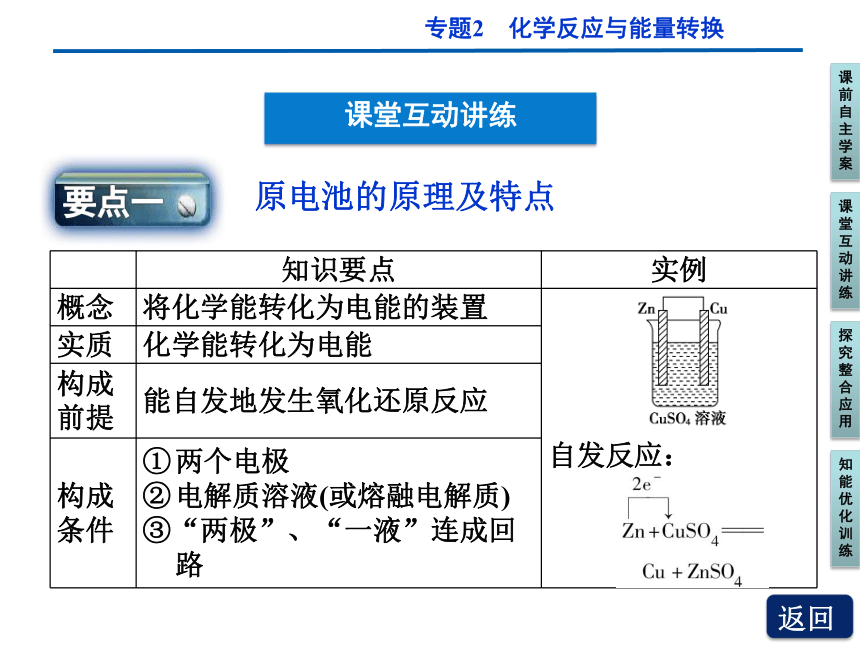
原电池的原理及特点
知识要点 实例
概念 将化学能转化为电能的装置
自发反应:
实质 化学能转化为电能
构成前提 能自发地发生氧化还原反应
构成条件 两个电极
电解质溶液(或熔融电解质)
③“两极”、“一液”连成回路
知识要点 实例
电极 负极:还原性相对较强的材料正极:还原性相对较弱的材料 锌板——负极
铜板——正极
电极反应 负极:失去电子,氧化反应
正极:得到电子,还原反应 负极:Zn-2e-===Zn2+
正极:Cu2++2e-===Cu
电极反应式与总反应式的关系 两个电极反应式加和,即得总反应式 总电极反应式:
Zn+Cu2+===Zn2++Cu
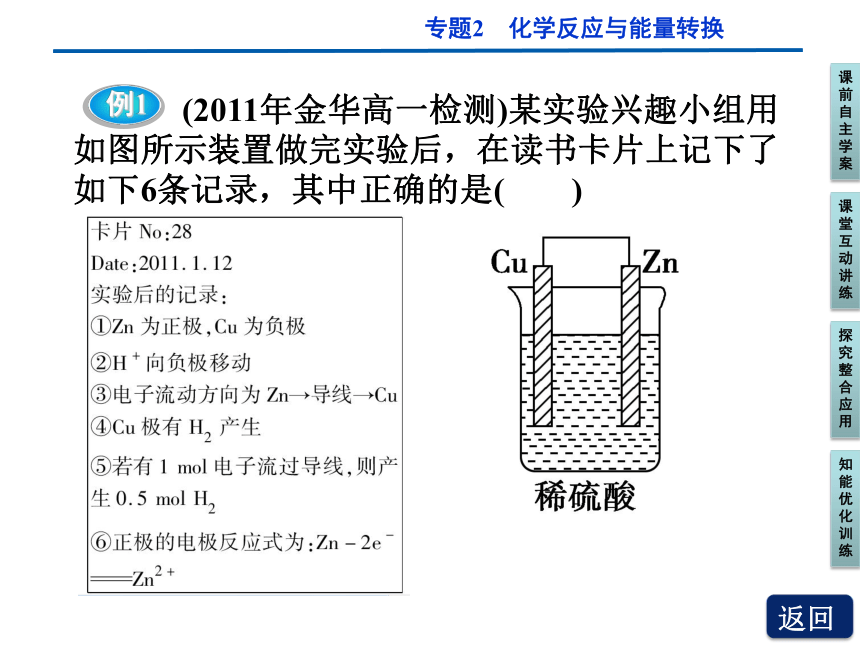
例1
(2011年金华高一检测)某实验兴趣小组用如图所示装置做完实验后,在读书卡片上记下了如下6条记录,其中正确的是( )
A.①②③ B.③④⑤
C.④⑤⑥ D.②③④
【解析】 本题考查了原电池的组成及反应原理。在铜锌原电池中,锌为负极,失去电子,发生氧化反应,电极反应为Zn-2e-===Zn2+。Cu为正极,得到电子,发生还原反应,电极反应为2H++2e-===H2↑。所以H+向正极移动,电子由锌流出,经过导线流向铜,每流过1 mol电子,生成0.5 mol H2,正确选项为③④⑤。
【答案】 B
变式训练1 关于如图所示装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
解析:选D。以稀硫酸作为电解质溶液的Cu—Zn原电池中,Zn作为负极,发生的反应为:Zn-2e-===Zn2+,现象为锌片质量减少;铜作为正极,发生的反应为:2H++2e-===H2↑,现象为铜片上有气泡产生。电子从锌片流出经导线流入铜片,电流从铜片流入锌片。
原电池原理的应用
1.加快氧化还原反应速率
如实验室用Zn和稀H2SO4(或稀盐酸)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌
、稀H2SO4形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
2.比较金属的活泼性强弱
原电池中,一般活泼性强的金属为负极,活泼性相对较弱的金属为正极。例如,有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活泼性A>B。
例2
(2011年宁波高一检测)把a、b、c、d四块金属板浸入稀硫酸中,用导线两两相连,可以形成原电池。若a、b相连时,a为负极;c、d相连时,c溶解;a、c相连时,c极上产生大量气泡;b、d相连时,b极上有大量气泡。四块金属的活动性顺序是( )
A.a>c>d>b B.c>a>b>d
C.a>c>b>d D.c>a>d>b
【解析】 该题考查根据原电池原理比较金属的活动性强弱。较活泼的金属为负极,被氧化溶解;相对不活泼的金属为正极,冒气泡或析出金属。所以,四块金属的活动顺序是a>c>d>b。
【答案】 A
【规律方法】 金属活泼性的判断依据:
(1)单质与水或酸反应难易:反应越剧烈,该金属越活泼。
(2)最高价氧化物的水化物的碱性强弱:碱性越强,金属越活泼。
(3)金属间的置换反应:若A能从B的盐溶液中置换出B,则A的活泼性比B的强。
(4)简单阳离子氧化性强弱:氧化性越强,该金属的活泼性越弱。
(5)两金属构成原电池时,作负极(或电子流出,电流流入或发生氧化反应等)的金属比作正极(或电子流
入,电流流出或发生还原反应等)的金属活泼性强。
变式训练2
解析:选D。在氢氧化钠溶液中能反应生成气体的金属,其活泼性不一定强,如Mg和Al。
设计原电池
从理论上说,任何一个能自发进行的氧化还原反应都可以设计成原电池。例如,利用Cu+2FeCl3===2FeCl2+CuCl2的氧化还原反应可设计成如图所示的原电池,该原电池的电极反应式为:
负极(Cu):Cu-2e-=== Cu2+(氧化反应)
正极(C):2Fe3++2e-===2Fe2+(还原反应)
例3
现有如下两个反应:
(A)NaOH+HCl===NaCl+H2O
(B)Zn+H2SO4===ZnSO4+H2↑
(1)根据两反应本质,判断能否设计成原电池_______________________________________________________________________。
(2)如果不能,说明其原因________________________________________________________________________
________________________________________________________________________。
(3)如果可以,则写出正、负极材料及其电极反应式、电解质溶液名称:
负极:__________,________________________________________________________________________;
正极:__________,________________________________________________________________________。
电解质溶液:__________。
【解析】 解答本题应先根据原电池的实质——发生氧化还原反应,判断出能否设计成原电池,再根据判断原电池的正负极的方法进行分析求解。由于原电池的实质是发生氧化还原反应,所以,只有发生氧化还原反应才能设计成原电池。对于:Zn+H2SO4===ZnSO4+H2↑,Zn失去电子作原电池的负极,H+得到电子在正极上发生还原反应,正极为活泼性比Zn弱的导电固体材料,如Cu、Ag、石墨等。
【答案】 (1)(A)不能;(B)能
(2)(A)的反应为非氧化还原反应,没有电子转移
(3)锌 Zn-2e-===Zn2+
铜(银、石墨等) 2H++2e-===H2↑ 稀硫酸
变式训练3 利用反应Zn+2FeCl3===ZnCl2+2FeCl2设计一个原电池。在图中方格内画出实验装置图,并指出正极为______,电极反应式为________________________________________________________________________;
负极为________,电极反应式为________________________________________________________________________。
解析:先将反应拆成得电子和失电子的两个电极反应,再结合原电池的电极反应特点进行分析。Zn+2FeCl3===ZnCl2+2FeCl2可拆为两个电极反应:失电子反应:Zn-2e-===Zn2+,得电子反应:2Fe3++2e-===2Fe2+,根据原电池的电极反应特点知,该电池用Zn作负极,正极要保证Fe3+得到负极失去的电子,一般用不能还原Fe3+的材料,如碳棒、铂等,电解液须提供Fe3+,可用FeCl3溶液。
答案:
Pt 2Fe3++2e-===2Fe2+ Zn
Zn-2e-===Zn2+
探究整合应用
探究铝电极在原电池中的作用
在原电池中,电解质溶液的浓度、酸碱性等会影响电极反应,使发生的电极反应有区别,电极材料(负极)是否参加反应也与电解质溶液有关,在书写电极反应时应注意分析。
例
某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 电极材料 电解质溶液 电流计指针偏转方向
1 Mg、Al 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、C(石墨) 稀盐酸 偏向石墨
4 Mg、Al 氢氧化钠溶液 偏向Mg
5 Al、Zn 浓硝酸 偏向Al
根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同________(填“是”或“否”)。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:___________________________。
②石墨为________极,电极反应式:___________________________。
③电池总反应方程式:___________________________。
(3)实验4中铝作负极还是正极________,理由是__________________________________________。写出铝电极的电极反应式___________________________。
(4)解释实验5中电流计指针偏向铝的原因:________________________________________________________________________
________________________________________________________________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:________________________________________________________________________。
【解析】 在这样的原电池中,相对较活泼的金属材料作负极。在稀盐酸中的活泼性Mg>Al、Al>Cu。由实验1和2可知,在这里的原电池中电流计指针是偏向正极。
在实验3中电流计指针偏向石墨,由上述规律可知,Al是负极,石墨是正极。化学反应是Al失去电子被氧化为Al3+,盐酸中的H+得到电子被还原为H2。
在NaOH溶液中活泼性Al>Mg,则Al是负极,Mg是正极。
Al在浓硝酸中被钝化,Zn在浓硝酸中被氧化,即在浓硝酸中活泼性Zn>Al,Zn是负极,Al是正极,所以在实验5中电流计指针偏向Al。
【答案】 (1)否
(2)①负 2Al-6e-===2Al3+
②正 6H++6e-===3H2↑
③2Al+6HCl===2AlCl3+3H2↑
(3)负极 在NaOH溶液中,活泼性Al>Mg
2Al-6e-+8OH-===2AlO+4H2O
(4)在浓硝酸中,活泼性Zn>Al,Zn是原电池的负极
(5)①另一个电极材料的活泼性;②电解质溶液的氧化性
第1课时 化学能转化为电能
第1课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、原电池的定义
把_____能转化为___能的装置叫做原电池。
二、原电池的构成条件
(1)电极材料,两种金属活动性不同的金属或金属和其他导电的材料(非金属或某些氧化物等)。
(2)两电极必须浸在___________中,两电极
之间要用导线连接,形成__________。
(3)_________ 反应自发进行。
化学
电
电解质溶液
闭合回路
氧化还原
思考感悟
下列装置能否形成原电池,其理由是什么?
【提示】 都不能。第一个没有形成闭合回路;第二个两个电极相同;第三个没有电解质溶液(乙醇是非电解质)。
三、原电池的工作原理
外电路中:较活泼金属材料作____,_____
电子,电子经外电路流向较不活泼金属或导体
(正极),而使外电路中产生电流。
内电路中:电解质溶液内,阳离子向_____移
动,阴离子向_____移动,使电流通过电解质
溶液。
四、电极反应
以铜—锌(稀硫酸)原电池为例,如图所示
负极(锌)反应式:________________,发生
_____反应;现象:____________。
负极
失去
正极
负极
氧化
Zn-2e-===Zn2+
锌不断溶解
正极(铜)反应式:2H++2e-===H2↑,发生______反应;现象:____________________。
总反应式:__________________________。
还原
有气泡逸出,铜不变
Zn+H2SO4===ZnSO4+H2↑
自主体验
1.关于原电池的叙述中正确的是( )
A.构成原电池的必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池工作时总是负极溶解,正极上有物质生成
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
答案:B
2.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极、乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡速率甲比乙慢
答案:C
3.对铜—锌—稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g ②锌片增重32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④
C.②和③ D.②和④
答案:A
课堂互动讲练
原电池的原理及特点
知识要点 实例
概念 将化学能转化为电能的装置
自发反应:
实质 化学能转化为电能
构成前提 能自发地发生氧化还原反应
构成条件 两个电极
电解质溶液(或熔融电解质)
③“两极”、“一液”连成回路
知识要点 实例
电极 负极:还原性相对较强的材料正极:还原性相对较弱的材料 锌板——负极
铜板——正极
电极反应 负极:失去电子,氧化反应
正极:得到电子,还原反应 负极:Zn-2e-===Zn2+
正极:Cu2++2e-===Cu
电极反应式与总反应式的关系 两个电极反应式加和,即得总反应式 总电极反应式:
Zn+Cu2+===Zn2++Cu
例1
(2011年金华高一检测)某实验兴趣小组用如图所示装置做完实验后,在读书卡片上记下了如下6条记录,其中正确的是( )
A.①②③ B.③④⑤
C.④⑤⑥ D.②③④
【解析】 本题考查了原电池的组成及反应原理。在铜锌原电池中,锌为负极,失去电子,发生氧化反应,电极反应为Zn-2e-===Zn2+。Cu为正极,得到电子,发生还原反应,电极反应为2H++2e-===H2↑。所以H+向正极移动,电子由锌流出,经过导线流向铜,每流过1 mol电子,生成0.5 mol H2,正确选项为③④⑤。
【答案】 B
变式训练1 关于如图所示装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
解析:选D。以稀硫酸作为电解质溶液的Cu—Zn原电池中,Zn作为负极,发生的反应为:Zn-2e-===Zn2+,现象为锌片质量减少;铜作为正极,发生的反应为:2H++2e-===H2↑,现象为铜片上有气泡产生。电子从锌片流出经导线流入铜片,电流从铜片流入锌片。
原电池原理的应用
1.加快氧化还原反应速率
如实验室用Zn和稀H2SO4(或稀盐酸)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌
、稀H2SO4形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
2.比较金属的活泼性强弱
原电池中,一般活泼性强的金属为负极,活泼性相对较弱的金属为正极。例如,有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活泼性A>B。
例2
(2011年宁波高一检测)把a、b、c、d四块金属板浸入稀硫酸中,用导线两两相连,可以形成原电池。若a、b相连时,a为负极;c、d相连时,c溶解;a、c相连时,c极上产生大量气泡;b、d相连时,b极上有大量气泡。四块金属的活动性顺序是( )
A.a>c>d>b B.c>a>b>d
C.a>c>b>d D.c>a>d>b
【解析】 该题考查根据原电池原理比较金属的活动性强弱。较活泼的金属为负极,被氧化溶解;相对不活泼的金属为正极,冒气泡或析出金属。所以,四块金属的活动顺序是a>c>d>b。
【答案】 A
【规律方法】 金属活泼性的判断依据:
(1)单质与水或酸反应难易:反应越剧烈,该金属越活泼。
(2)最高价氧化物的水化物的碱性强弱:碱性越强,金属越活泼。
(3)金属间的置换反应:若A能从B的盐溶液中置换出B,则A的活泼性比B的强。
(4)简单阳离子氧化性强弱:氧化性越强,该金属的活泼性越弱。
(5)两金属构成原电池时,作负极(或电子流出,电流流入或发生氧化反应等)的金属比作正极(或电子流
入,电流流出或发生还原反应等)的金属活泼性强。
变式训练2
解析:选D。在氢氧化钠溶液中能反应生成气体的金属,其活泼性不一定强,如Mg和Al。
设计原电池
从理论上说,任何一个能自发进行的氧化还原反应都可以设计成原电池。例如,利用Cu+2FeCl3===2FeCl2+CuCl2的氧化还原反应可设计成如图所示的原电池,该原电池的电极反应式为:
负极(Cu):Cu-2e-=== Cu2+(氧化反应)
正极(C):2Fe3++2e-===2Fe2+(还原反应)
例3
现有如下两个反应:
(A)NaOH+HCl===NaCl+H2O
(B)Zn+H2SO4===ZnSO4+H2↑
(1)根据两反应本质,判断能否设计成原电池_______________________________________________________________________。
(2)如果不能,说明其原因________________________________________________________________________
________________________________________________________________________。
(3)如果可以,则写出正、负极材料及其电极反应式、电解质溶液名称:
负极:__________,________________________________________________________________________;
正极:__________,________________________________________________________________________。
电解质溶液:__________。
【解析】 解答本题应先根据原电池的实质——发生氧化还原反应,判断出能否设计成原电池,再根据判断原电池的正负极的方法进行分析求解。由于原电池的实质是发生氧化还原反应,所以,只有发生氧化还原反应才能设计成原电池。对于:Zn+H2SO4===ZnSO4+H2↑,Zn失去电子作原电池的负极,H+得到电子在正极上发生还原反应,正极为活泼性比Zn弱的导电固体材料,如Cu、Ag、石墨等。
【答案】 (1)(A)不能;(B)能
(2)(A)的反应为非氧化还原反应,没有电子转移
(3)锌 Zn-2e-===Zn2+
铜(银、石墨等) 2H++2e-===H2↑ 稀硫酸
变式训练3 利用反应Zn+2FeCl3===ZnCl2+2FeCl2设计一个原电池。在图中方格内画出实验装置图,并指出正极为______,电极反应式为________________________________________________________________________;
负极为________,电极反应式为________________________________________________________________________。
解析:先将反应拆成得电子和失电子的两个电极反应,再结合原电池的电极反应特点进行分析。Zn+2FeCl3===ZnCl2+2FeCl2可拆为两个电极反应:失电子反应:Zn-2e-===Zn2+,得电子反应:2Fe3++2e-===2Fe2+,根据原电池的电极反应特点知,该电池用Zn作负极,正极要保证Fe3+得到负极失去的电子,一般用不能还原Fe3+的材料,如碳棒、铂等,电解液须提供Fe3+,可用FeCl3溶液。
答案:
Pt 2Fe3++2e-===2Fe2+ Zn
Zn-2e-===Zn2+
探究整合应用
探究铝电极在原电池中的作用
在原电池中,电解质溶液的浓度、酸碱性等会影响电极反应,使发生的电极反应有区别,电极材料(负极)是否参加反应也与电解质溶液有关,在书写电极反应时应注意分析。
例
某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 电极材料 电解质溶液 电流计指针偏转方向
1 Mg、Al 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、C(石墨) 稀盐酸 偏向石墨
4 Mg、Al 氢氧化钠溶液 偏向Mg
5 Al、Zn 浓硝酸 偏向Al
根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同________(填“是”或“否”)。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:___________________________。
②石墨为________极,电极反应式:___________________________。
③电池总反应方程式:___________________________。
(3)实验4中铝作负极还是正极________,理由是__________________________________________。写出铝电极的电极反应式___________________________。
(4)解释实验5中电流计指针偏向铝的原因:________________________________________________________________________
________________________________________________________________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:________________________________________________________________________。
【解析】 在这样的原电池中,相对较活泼的金属材料作负极。在稀盐酸中的活泼性Mg>Al、Al>Cu。由实验1和2可知,在这里的原电池中电流计指针是偏向正极。
在实验3中电流计指针偏向石墨,由上述规律可知,Al是负极,石墨是正极。化学反应是Al失去电子被氧化为Al3+,盐酸中的H+得到电子被还原为H2。
在NaOH溶液中活泼性Al>Mg,则Al是负极,Mg是正极。
Al在浓硝酸中被钝化,Zn在浓硝酸中被氧化,即在浓硝酸中活泼性Zn>Al,Zn是负极,Al是正极,所以在实验5中电流计指针偏向Al。
【答案】 (1)否
(2)①负 2Al-6e-===2Al3+
②正 6H++6e-===3H2↑
③2Al+6HCl===2AlCl3+3H2↑
(3)负极 在NaOH溶液中,活泼性Al>Mg
2Al-6e-+8OH-===2AlO+4H2O
(4)在浓硝酸中,活泼性Zn>Al,Zn是原电池的负极
(5)①另一个电极材料的活泼性;②电解质溶液的氧化性
