2011年高一化学精品课件:3.1.1 甲烷、烷烃(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:3.1.1 甲烷、烷烃(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 505.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 00:00:00 | ||
图片预览





文档简介
(共36张PPT)
第1课时 甲烷、烷烃
第1课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
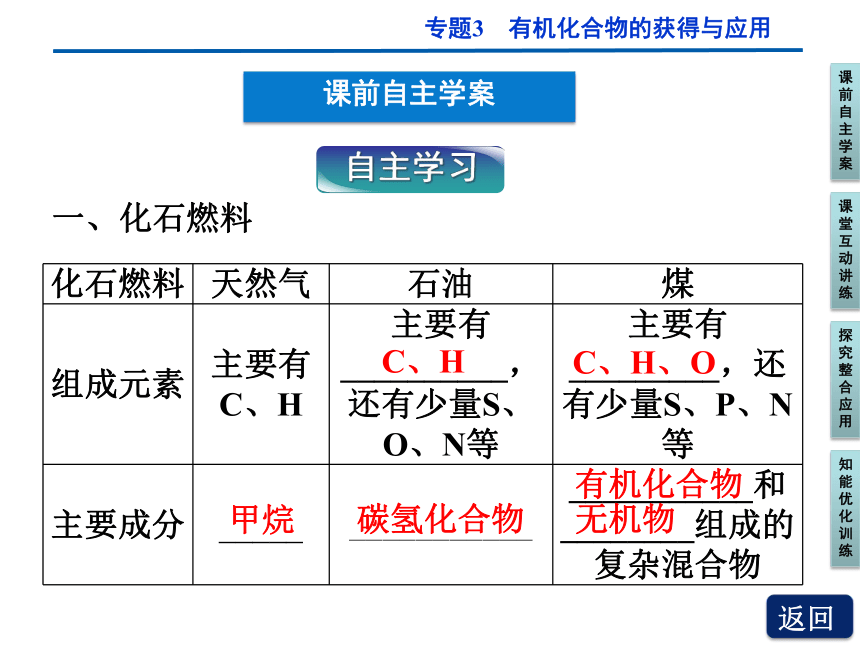
一、化石燃料
化石燃料 天然气 石油 煤
组成元素 主要有C、H 主要有__________,还有少量S、O、N等 主要有_________,还有少量S、P、N等
主要成分 _____ ___________ ___________和________组成的复杂混合物
C、H
C、H、O
甲烷
碳氢化合物
有机化合物
无机物
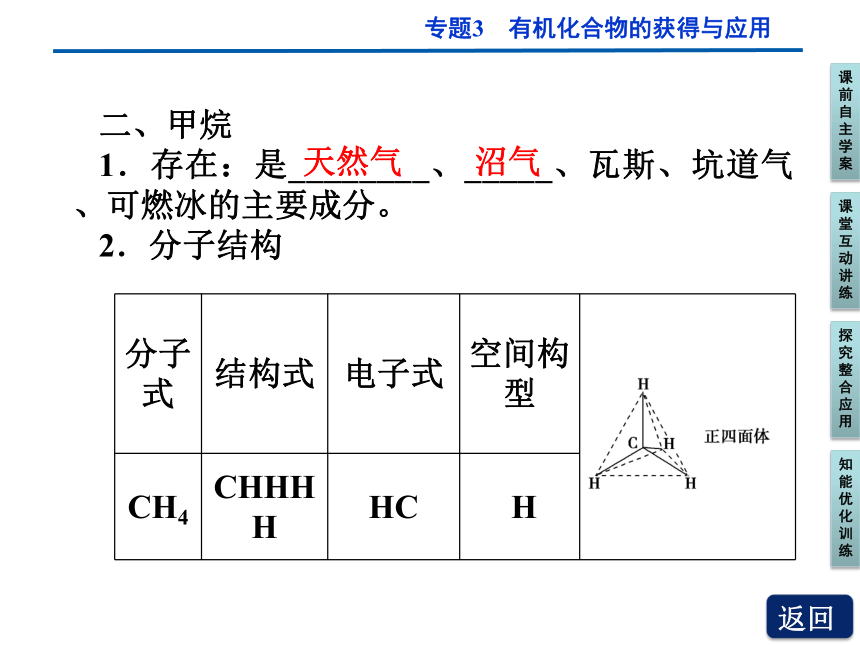
二、甲烷
1.存在:是________、_____、瓦斯、坑道气、可燃冰的主要成分。
2.分子结构
分子式 结构式 电子式 空间构型
CH4 CHHHH HC H
天然气
沼气
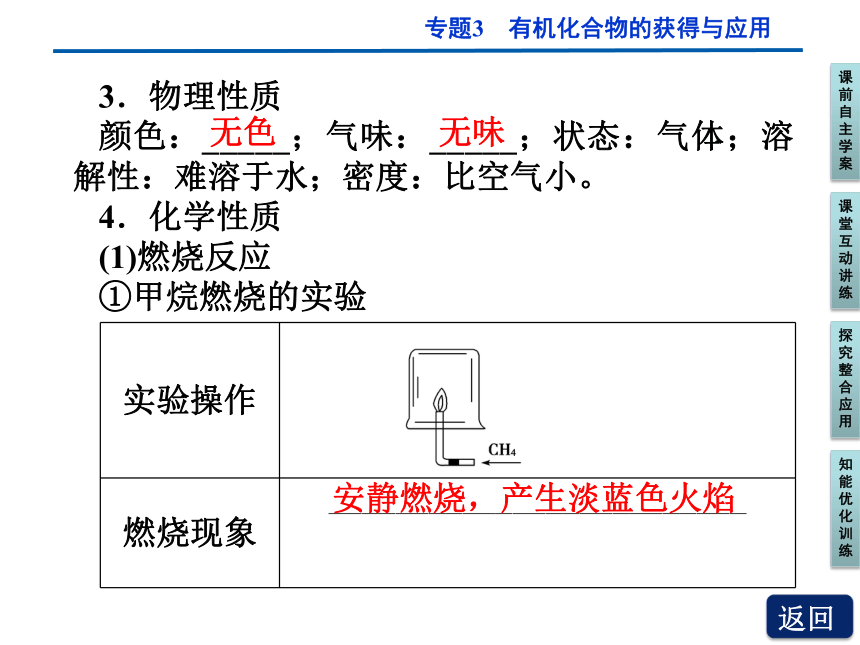
3.物理性质
颜色:_____;气味:_____;状态:气体;溶解性:难溶于水;密度:比空气小。
4.化学性质
(1)燃烧反应
①甲烷燃烧的实验
实验操作
燃烧现象 _________________________
无色
无味
安静燃烧,产生淡蓝色火焰
产物检验
方法 罩一只干燥的烧杯 罩一只内壁用澄清石灰水润洗过的烧杯
现象 __________________ ____________
结论 _____________ __________
烧杯内壁有水珠生成
石灰水变浑浊
有H2O生成
有CO2生成
②甲烷燃烧的热化学方程式
1 mol甲烷完全燃烧生成液态水时可以放出890 kJ的热量,其燃烧的热化学方程式为: _________________________________________ 。
(2)取代反应
①定义
有机化合物分子中的某种__________________
被另一种______________________所取代的反应。
原子(或原子团)
原子(或原子团)
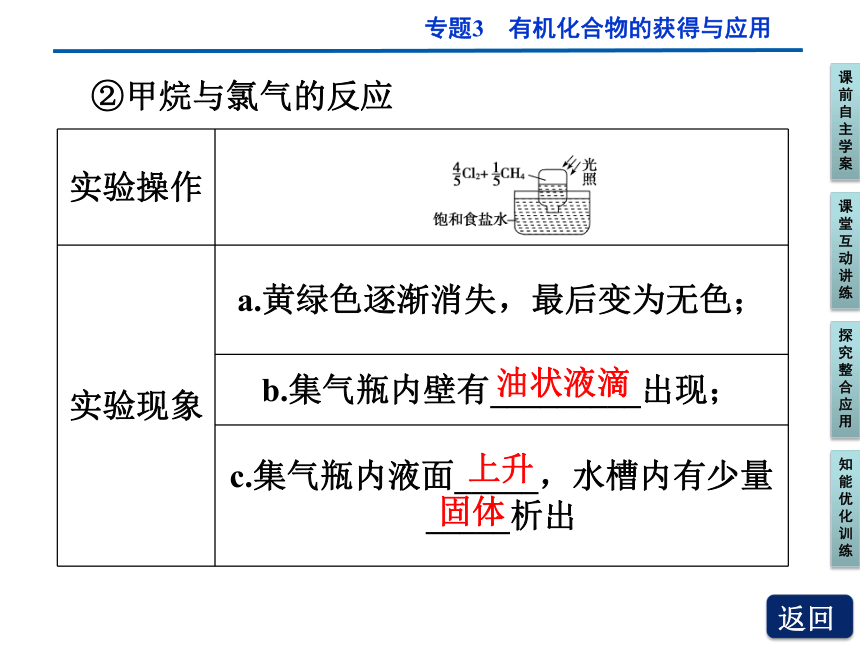
②甲烷与氯气的反应
实验操作
实验现象 a.黄绿色逐渐消失,最后变为无色;
b.集气瓶内壁有_________出现;
c.集气瓶内液面_____,水槽内有少量_____析出
油状液滴
上升
固体
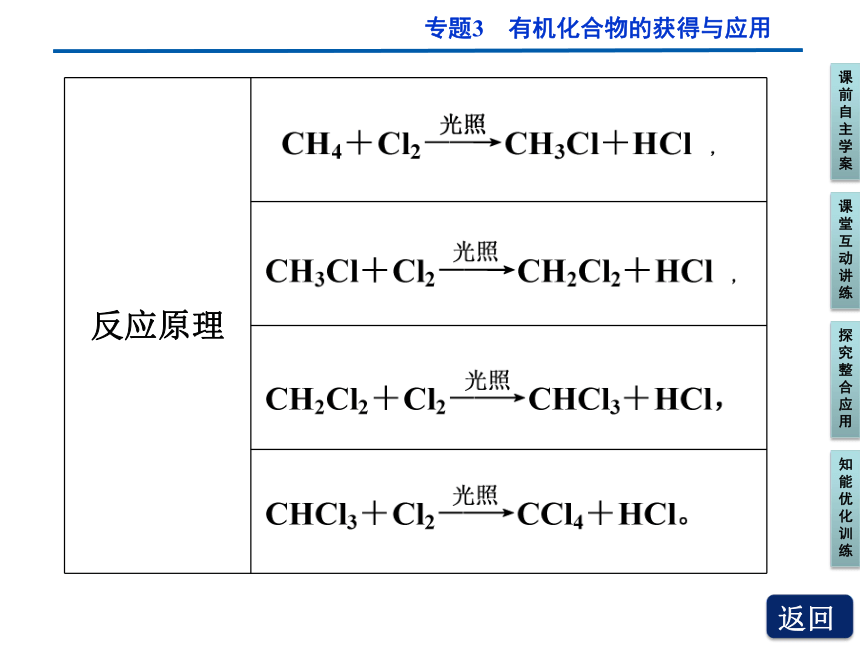
反应原理
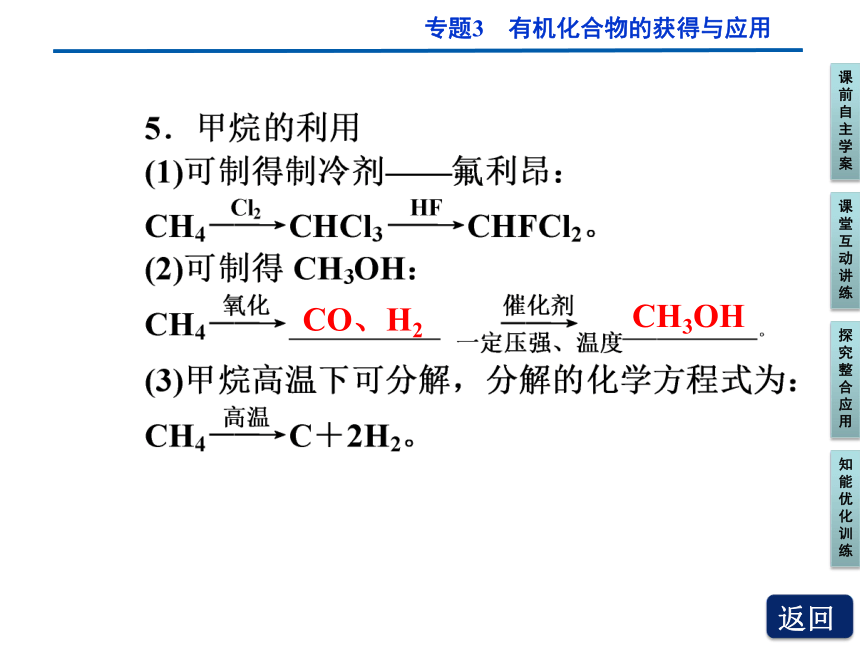
CO、H2
CH3OH
1.(1)若把甲烷分子中的一个氢原子换成氯原子,还是正四面体结构吗?
(2)在甲烷和氯气的取代反应实验中,集气瓶内液面为什么会上升?
【提示】 (1)因C—H键与C—Cl键的键长不同,故CH3Cl是四面体结构,但不是正四面体结构。
(2)该反应是气体体积减小的反应,而且生成的HCl极易溶于水,导致集气瓶内气体压强减小,在外界大气压的作用下,水槽内的饱和食盐水将会被压入集气瓶中,导致液面上升。
思考感悟
三、烷烃
1.烃
仅含_______两种元素的有机化合物,又叫___________。
2.烷烃
(1)结构:碳原子都以_________相连,其余的价键全部与_______结合,达到“饱和”。
(2)通式:______________。
碳和氢
碳氢化合物
碳碳单键
氢原子
CnH2n+2(n≥1)
(3)命名:
①n≤10:依次称为甲烷、乙烷、丙烷、丁烷……
②n≥11:直接根据碳原子数称为某烷,如C16H34称为_______。
(4)性质:和甲烷相似。
①可与O2发生燃烧反应,其化学方程式为:
十六烷
取代
3.同系物
分子结构______,组成上相差1个或若干个“_____”原子团的有机化合物互称为同系物。如甲烷(CH4)、乙烷(_________)、丙烷(___________)互为同系物。
2.CH3CH2CH2CH3分子中碳原子在同一条直上?
【提示】 烷烃分子中的碳原子以单键与其他原子相连,因此与之成键的四个原子构成四面体结构,碳原子不在同一条直线上,直链烷烃碳原子之间呈锯齿形。
相似
CH2
CH3CH3
CH3CH2CH3
自主体验
思考感悟
1.第28届国际地质大会提供的资料显示,在海底蕴藏着大量的天然气水合物,俗称“可燃冰”。其蕴藏量是地球上煤和石油的几百倍,因而是一种等待开发的巨大能源物质。有关可燃冰的下列预测中错误的是( )
A.高压、低温有助于可燃冰的形成
B.可燃冰的主要成分是甲烷
C.可燃冰是一种比较清洁的能源
D.可燃冰的微粒间存在着离子键
答案:D
2.判断下列叙述中错误的是( )
A.点燃甲烷必须事先进行验纯
B.甲烷燃烧能放出大量的热,所以是一种很好的气体燃料
C.煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生
D.在空气中,将甲烷加热到1500 ℃以上,能分解成炭黑和氢气
答案:D
3.甲烷和氯气以物质的量比1∶1混合,在光照条件下得到的有机产物是( )
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4 ⑤HCl
A.只有① B.①和②的混合物
C.只有④ D.①②③④的混合物
答案:D
课堂互动讲练
甲烷与卤素单质的取代反应
项目 情况
反应条件 光照(放在光亮处,日光直接照射爆炸)
反应物要求 所用的卤素单质必须是纯净物,甲烷与卤素单质的水溶液不反应。卤素单质一般选用Cl2,因为F2与CH4反应太剧烈,而Br2、I2与CH4反应过于缓慢
反应特点 逐步取代,即CH4分子中的氢原子被氯原子逐步取代,但在同一个体系中,往往是各步反应同时发生,得到的产物是含多种成分的混合物
产物特点(以CH4与Cl2反应为例) (1)取代产物状态
常温下CH3Cl为气体,CH2Cl2、CHCl3、CCl4为液体。
(2)产物的量
①5种产物中HCl的物质的量最多。
②根据碳原子守恒,4种取代产物的物质的量之和与参加反应的CH4的物质的量相等。
③根据反应关系式,生成的HCl的物质的量一定等于参加反应的Cl2的物质的量
(2011年福州高一检测)如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:_________________________________________。
例1
(2)若题目中甲烷与氯气的体积比为1∶1,则得到的产物为________(填字母代号)。
A.CH3Cl HCl
B.CCl4 HCl
C.CH3Cl CH2Cl2
D.CH3Cl CH2Cl2 CHCl3 CCl4 HCl
(3)经过几个小时的反应后,U形管右端的水柱变化是________(填字母代号)。
A.升高 B.降低
C.不变 D.无法确定
(4)若水中含有Na2SiO3,则在U形管左端会观察到
________________________________________________________________________。
(5)右端玻璃管的作用是________________________________________________________________________。
【思路点拨】 解答该题需注意以下三点:
(1)甲烷的取代反应是一种连锁反应,第一步反应一旦开始后续反应立即进行。
(2)产物HCl易溶于水,会引起压强变小。
(3)硅酸是难溶性弱酸。
(4)因左侧生成HCl溶于水后发生反应2HCl+Na2SiO3===H2SiO3↓+2NaCl,所以观察到有白色胶状沉淀生成。
(5)为了平衡气压,在U形管右侧插有一个玻璃管。
变式训练1
把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛Na2SiO3溶液的水槽里,放在光亮处。
预测可能观察到的实验现象:
(1)试管中:
①_____________________________________;
②_____________________________________;
③___________________________________。
(2)水槽中:___________________________________。
解析:CH4和Cl2光照生成CH3Cl、CH2Cl2、CHCl3、CCl4、HCl等物质,随着反应的进行,Cl2不断消耗,黄绿色逐渐消失。又由于生成的CH2Cl2、CHCl3、CCl4常温下均为无色液体,Cl2易溶于有机溶剂,使试管壁上有黄色油滴。因生成的HCl易溶于水,导致反应后,试管内气体压强减小,水位在试管内上升。HCl溶于水后,与Na2SiO3反应生成白色胶状沉淀。
答案:(1)①气体颜色逐渐褪去
②水面上升
③试管壁上有黄色油状液滴
烷烃的化学性质
1.氧化反应
通常情况下性质稳定,不能使酸性KMnO4溶液和溴水褪色,不能与强酸、强碱反应。烷烃的氧化反应一般指燃烧反应,其通式为:
(2011年龙岩高一检测)下列有关烷烃的叙述中,不正确的是( )
A.在烷烃分子中,所有的化学键都为单键
B.所有的烷烃在光照条件下都能与Cl2发生取代反应
C.烷烃的分子通式为CnH2n+2,符合该通式的烃不一定是烷烃
D.随着碳原子数的增加,烷烃的熔、沸点逐渐升高
例2
【解析】 烷烃中的碳碳键、碳氢键均为单键;烷烃都能与Cl2发生取代反应,这是烷烃的主要特性之一;随着碳原子数的增加,烷烃的分子间作用力增大,使其熔、沸点逐渐升高;因分子通式中CnH2n+2中的氢原子已达饱和,故符合CnH2n+2的有机物只可能是烷烃。
【答案】 C
变式训练2 科学家对中国首颗探月卫星发回的数据进行了分析,发现月球形成时可能存在稀薄的原始大气层,主要由氖、氢、氦、氩等气体组成,不含甲烷等碳氢化合物。下列关于碳氢化合物的说法正确的是( )
A.碳氢化合物的通式为CnH2n+2
B.燃烧产物为二氧化碳和水的化合物一定是碳氢化合物
C.碳原子间以单键相连的烃是烷烃
D.碳氢化合物分子的相对分子质量一定是偶数
解析:选D。CnH2n+2是烷烃的通式,A错误;燃烧产物为二氧化碳和水的化合物不一定是碳氢化合物,化学式为CxHyOz的有机物的燃烧产物也是二氧化碳和水,B错误;碳原子间全部以单键相连的链烃才是烷烃,C错误;因为碳原子的相对原子质量(12)为偶数,烃分子中的氢原子数也为偶数,所以碳氢化合物分子的相对分子质量一定是偶数是正确的。
探究整合应用
如何确定烃类的分子式
1.最简式法
最简式,又叫实验式,与分子式在数值上相差n倍,如乙烷的实验式为CH3。根据烃中各元素的质量分数(或元素的质量比),求出该烃的实验式,再根据该烃的相对分子质量求n的值,即可确定分子式。
2.物质的量法
根据烃的摩尔质量和烃中各元素的质量分数(或元素的质量比),推算出1 mol该烃中各元素的原子的物质的量,从而确定分子中各原子的个数。
3.原子守恒法
主要思路是:首先要判断有机物中所含元素的种类,然后根据题目所给条件确定有机物中各元素的原子数目,从而得到分子式。例如:1 mol烃完全燃烧得到ɑ mol CO2,则1 mol烃中碳原子物质的量为ɑ mol;得到b mol水,则1 mol烃中氢原子物质的量为2b mol,分子式为CɑH2b。
4.化学方程式法
某气态烷烃20 mL,完全燃烧时,正好消耗同温同压下的氧气100 mL,该烃的化学式是( )
A.C2H6 B.C3H8
C.C4H10 D.C5H12
例
【解析】 气态烷烃的燃烧方程式为:
【答案】 B
第1课时 甲烷、烷烃
第1课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、化石燃料
化石燃料 天然气 石油 煤
组成元素 主要有C、H 主要有__________,还有少量S、O、N等 主要有_________,还有少量S、P、N等
主要成分 _____ ___________ ___________和________组成的复杂混合物
C、H
C、H、O
甲烷
碳氢化合物
有机化合物
无机物
二、甲烷
1.存在:是________、_____、瓦斯、坑道气、可燃冰的主要成分。
2.分子结构
分子式 结构式 电子式 空间构型
CH4 CHHHH HC H
天然气
沼气
3.物理性质
颜色:_____;气味:_____;状态:气体;溶解性:难溶于水;密度:比空气小。
4.化学性质
(1)燃烧反应
①甲烷燃烧的实验
实验操作
燃烧现象 _________________________
无色
无味
安静燃烧,产生淡蓝色火焰
产物检验
方法 罩一只干燥的烧杯 罩一只内壁用澄清石灰水润洗过的烧杯
现象 __________________ ____________
结论 _____________ __________
烧杯内壁有水珠生成
石灰水变浑浊
有H2O生成
有CO2生成
②甲烷燃烧的热化学方程式
1 mol甲烷完全燃烧生成液态水时可以放出890 kJ的热量,其燃烧的热化学方程式为: _________________________________________ 。
(2)取代反应
①定义
有机化合物分子中的某种__________________
被另一种______________________所取代的反应。
原子(或原子团)
原子(或原子团)
②甲烷与氯气的反应
实验操作
实验现象 a.黄绿色逐渐消失,最后变为无色;
b.集气瓶内壁有_________出现;
c.集气瓶内液面_____,水槽内有少量_____析出
油状液滴
上升
固体
反应原理
CO、H2
CH3OH
1.(1)若把甲烷分子中的一个氢原子换成氯原子,还是正四面体结构吗?
(2)在甲烷和氯气的取代反应实验中,集气瓶内液面为什么会上升?
【提示】 (1)因C—H键与C—Cl键的键长不同,故CH3Cl是四面体结构,但不是正四面体结构。
(2)该反应是气体体积减小的反应,而且生成的HCl极易溶于水,导致集气瓶内气体压强减小,在外界大气压的作用下,水槽内的饱和食盐水将会被压入集气瓶中,导致液面上升。
思考感悟
三、烷烃
1.烃
仅含_______两种元素的有机化合物,又叫___________。
2.烷烃
(1)结构:碳原子都以_________相连,其余的价键全部与_______结合,达到“饱和”。
(2)通式:______________。
碳和氢
碳氢化合物
碳碳单键
氢原子
CnH2n+2(n≥1)
(3)命名:
①n≤10:依次称为甲烷、乙烷、丙烷、丁烷……
②n≥11:直接根据碳原子数称为某烷,如C16H34称为_______。
(4)性质:和甲烷相似。
①可与O2发生燃烧反应,其化学方程式为:
十六烷
取代
3.同系物
分子结构______,组成上相差1个或若干个“_____”原子团的有机化合物互称为同系物。如甲烷(CH4)、乙烷(_________)、丙烷(___________)互为同系物。
2.CH3CH2CH2CH3分子中碳原子在同一条直上?
【提示】 烷烃分子中的碳原子以单键与其他原子相连,因此与之成键的四个原子构成四面体结构,碳原子不在同一条直线上,直链烷烃碳原子之间呈锯齿形。
相似
CH2
CH3CH3
CH3CH2CH3
自主体验
思考感悟
1.第28届国际地质大会提供的资料显示,在海底蕴藏着大量的天然气水合物,俗称“可燃冰”。其蕴藏量是地球上煤和石油的几百倍,因而是一种等待开发的巨大能源物质。有关可燃冰的下列预测中错误的是( )
A.高压、低温有助于可燃冰的形成
B.可燃冰的主要成分是甲烷
C.可燃冰是一种比较清洁的能源
D.可燃冰的微粒间存在着离子键
答案:D
2.判断下列叙述中错误的是( )
A.点燃甲烷必须事先进行验纯
B.甲烷燃烧能放出大量的热,所以是一种很好的气体燃料
C.煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生
D.在空气中,将甲烷加热到1500 ℃以上,能分解成炭黑和氢气
答案:D
3.甲烷和氯气以物质的量比1∶1混合,在光照条件下得到的有机产物是( )
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4 ⑤HCl
A.只有① B.①和②的混合物
C.只有④ D.①②③④的混合物
答案:D
课堂互动讲练
甲烷与卤素单质的取代反应
项目 情况
反应条件 光照(放在光亮处,日光直接照射爆炸)
反应物要求 所用的卤素单质必须是纯净物,甲烷与卤素单质的水溶液不反应。卤素单质一般选用Cl2,因为F2与CH4反应太剧烈,而Br2、I2与CH4反应过于缓慢
反应特点 逐步取代,即CH4分子中的氢原子被氯原子逐步取代,但在同一个体系中,往往是各步反应同时发生,得到的产物是含多种成分的混合物
产物特点(以CH4与Cl2反应为例) (1)取代产物状态
常温下CH3Cl为气体,CH2Cl2、CHCl3、CCl4为液体。
(2)产物的量
①5种产物中HCl的物质的量最多。
②根据碳原子守恒,4种取代产物的物质的量之和与参加反应的CH4的物质的量相等。
③根据反应关系式,生成的HCl的物质的量一定等于参加反应的Cl2的物质的量
(2011年福州高一检测)如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:_________________________________________。
例1
(2)若题目中甲烷与氯气的体积比为1∶1,则得到的产物为________(填字母代号)。
A.CH3Cl HCl
B.CCl4 HCl
C.CH3Cl CH2Cl2
D.CH3Cl CH2Cl2 CHCl3 CCl4 HCl
(3)经过几个小时的反应后,U形管右端的水柱变化是________(填字母代号)。
A.升高 B.降低
C.不变 D.无法确定
(4)若水中含有Na2SiO3,则在U形管左端会观察到
________________________________________________________________________。
(5)右端玻璃管的作用是________________________________________________________________________。
【思路点拨】 解答该题需注意以下三点:
(1)甲烷的取代反应是一种连锁反应,第一步反应一旦开始后续反应立即进行。
(2)产物HCl易溶于水,会引起压强变小。
(3)硅酸是难溶性弱酸。
(4)因左侧生成HCl溶于水后发生反应2HCl+Na2SiO3===H2SiO3↓+2NaCl,所以观察到有白色胶状沉淀生成。
(5)为了平衡气压,在U形管右侧插有一个玻璃管。
变式训练1
把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛Na2SiO3溶液的水槽里,放在光亮处。
预测可能观察到的实验现象:
(1)试管中:
①_____________________________________;
②_____________________________________;
③___________________________________。
(2)水槽中:___________________________________。
解析:CH4和Cl2光照生成CH3Cl、CH2Cl2、CHCl3、CCl4、HCl等物质,随着反应的进行,Cl2不断消耗,黄绿色逐渐消失。又由于生成的CH2Cl2、CHCl3、CCl4常温下均为无色液体,Cl2易溶于有机溶剂,使试管壁上有黄色油滴。因生成的HCl易溶于水,导致反应后,试管内气体压强减小,水位在试管内上升。HCl溶于水后,与Na2SiO3反应生成白色胶状沉淀。
答案:(1)①气体颜色逐渐褪去
②水面上升
③试管壁上有黄色油状液滴
烷烃的化学性质
1.氧化反应
通常情况下性质稳定,不能使酸性KMnO4溶液和溴水褪色,不能与强酸、强碱反应。烷烃的氧化反应一般指燃烧反应,其通式为:
(2011年龙岩高一检测)下列有关烷烃的叙述中,不正确的是( )
A.在烷烃分子中,所有的化学键都为单键
B.所有的烷烃在光照条件下都能与Cl2发生取代反应
C.烷烃的分子通式为CnH2n+2,符合该通式的烃不一定是烷烃
D.随着碳原子数的增加,烷烃的熔、沸点逐渐升高
例2
【解析】 烷烃中的碳碳键、碳氢键均为单键;烷烃都能与Cl2发生取代反应,这是烷烃的主要特性之一;随着碳原子数的增加,烷烃的分子间作用力增大,使其熔、沸点逐渐升高;因分子通式中CnH2n+2中的氢原子已达饱和,故符合CnH2n+2的有机物只可能是烷烃。
【答案】 C
变式训练2 科学家对中国首颗探月卫星发回的数据进行了分析,发现月球形成时可能存在稀薄的原始大气层,主要由氖、氢、氦、氩等气体组成,不含甲烷等碳氢化合物。下列关于碳氢化合物的说法正确的是( )
A.碳氢化合物的通式为CnH2n+2
B.燃烧产物为二氧化碳和水的化合物一定是碳氢化合物
C.碳原子间以单键相连的烃是烷烃
D.碳氢化合物分子的相对分子质量一定是偶数
解析:选D。CnH2n+2是烷烃的通式,A错误;燃烧产物为二氧化碳和水的化合物不一定是碳氢化合物,化学式为CxHyOz的有机物的燃烧产物也是二氧化碳和水,B错误;碳原子间全部以单键相连的链烃才是烷烃,C错误;因为碳原子的相对原子质量(12)为偶数,烃分子中的氢原子数也为偶数,所以碳氢化合物分子的相对分子质量一定是偶数是正确的。
探究整合应用
如何确定烃类的分子式
1.最简式法
最简式,又叫实验式,与分子式在数值上相差n倍,如乙烷的实验式为CH3。根据烃中各元素的质量分数(或元素的质量比),求出该烃的实验式,再根据该烃的相对分子质量求n的值,即可确定分子式。
2.物质的量法
根据烃的摩尔质量和烃中各元素的质量分数(或元素的质量比),推算出1 mol该烃中各元素的原子的物质的量,从而确定分子中各原子的个数。
3.原子守恒法
主要思路是:首先要判断有机物中所含元素的种类,然后根据题目所给条件确定有机物中各元素的原子数目,从而得到分子式。例如:1 mol烃完全燃烧得到ɑ mol CO2,则1 mol烃中碳原子物质的量为ɑ mol;得到b mol水,则1 mol烃中氢原子物质的量为2b mol,分子式为CɑH2b。
4.化学方程式法
某气态烷烃20 mL,完全燃烧时,正好消耗同温同压下的氧气100 mL,该烃的化学式是( )
A.C2H6 B.C3H8
C.C4H10 D.C5H12
例
【解析】 气态烷烃的燃烧方程式为:
【答案】 B
