2011年高一化学精品课件:3.2.1 乙醇(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:3.2.1 乙醇(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 454.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 00:00:00 | ||
图片预览







文档简介
(共36张PPT)
第二单元 食品中的有机化合物
第1课时 乙醇
第1课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
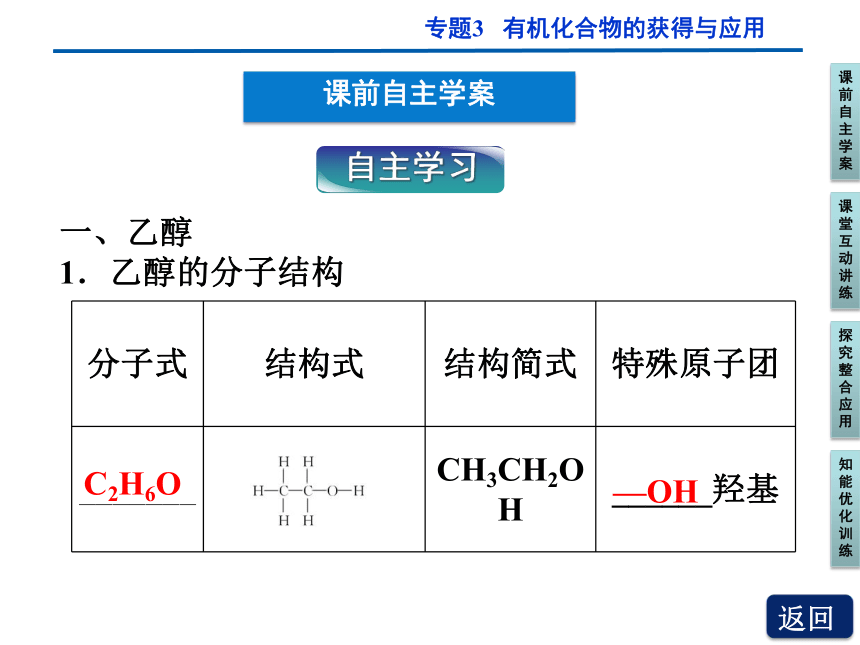
一、乙醇
1.乙醇的分子结构
分子式 结构式 结构简式 特殊原子团
_______ CH3CH2OH ______羟基
C2H6O
—OH
思考感悟
1.根据乙醇的分子模型,能判断出乙醇分子中有几种氢原子吗?—OH与OH-是相同的吗?
2.乙醇的物理性质
颜色 状态 气味 密度 水溶性
无色 液体 _________ 比水___ _______________
特殊香味
小
与水以任意比互溶
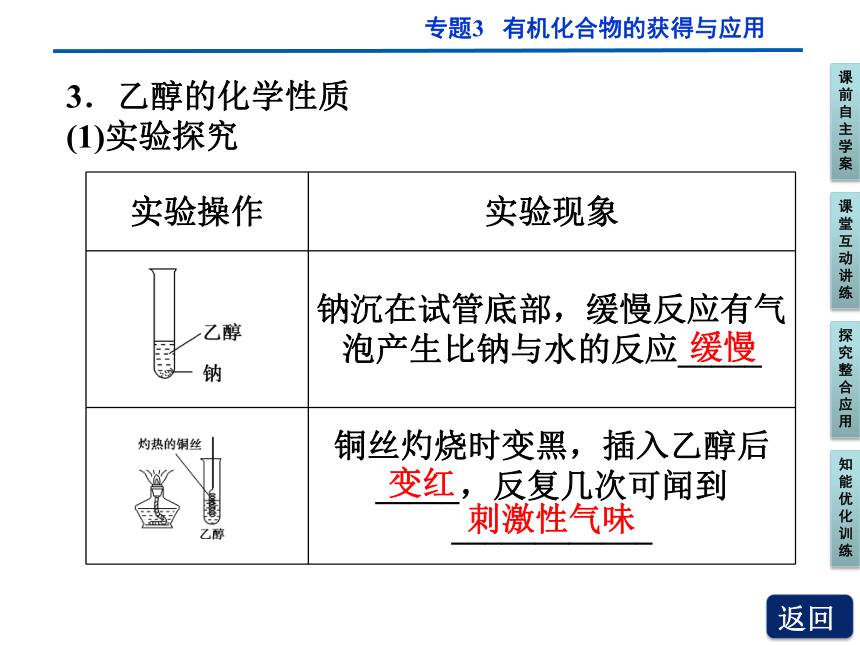
3.乙醇的化学性质
(1)实验探究
实验操作 实验现象
钠沉在试管底部,缓慢反应有气泡产生比钠与水的反应_____
铜丝灼烧时变黑,插入乙醇后_____,反复几次可闻到____________
缓慢
变红
刺激性气味
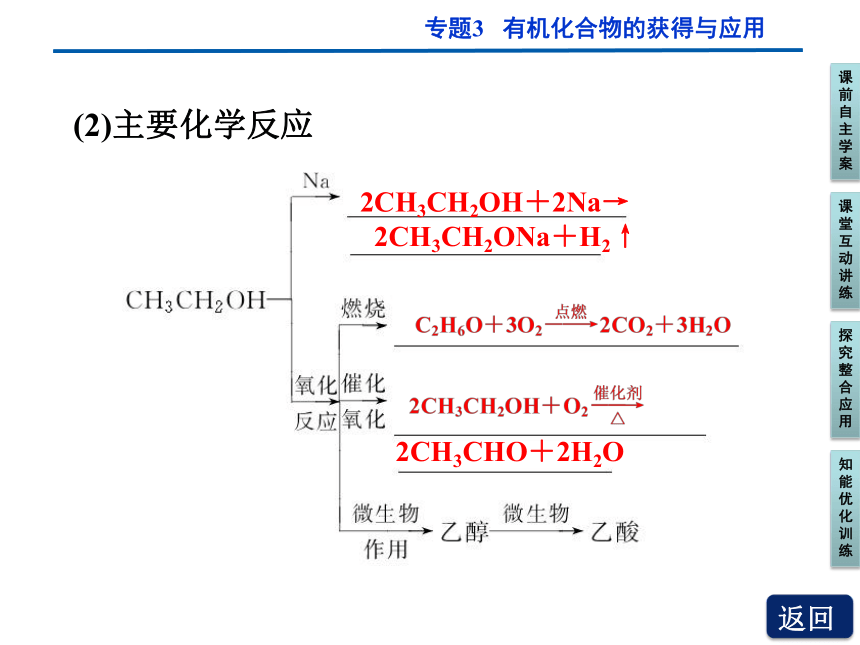
(2)主要化学反应
2CH3CH2OH+2Na→
2CH3CH2ONa+H2↑
2CH3CHO+2H2O
2.能否用酒精萃取溴水中的溴?直接加热蒸馏的方法能得到无水酒精吗?如果不能应如何操作?
【提示】 不能。因为酒精和水可以以任意比互溶,因此不能用酒精萃取溴水中的溴。水的沸点为100 ℃,酒精的沸点为78.5 ℃,因此不能用直接蒸馏的方法获得无水酒精,应先加生石灰,然后再蒸馏。
思考感悟
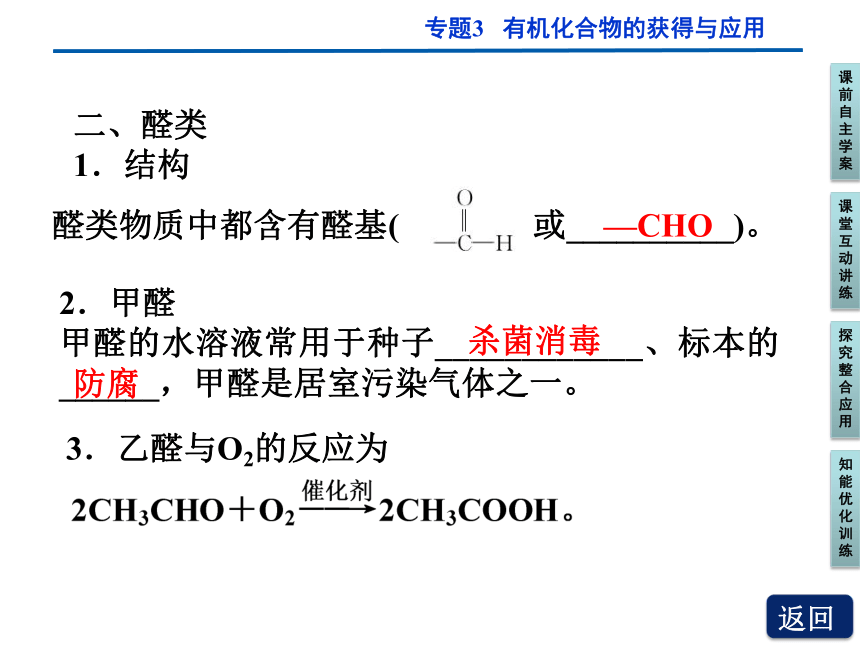
二、醛类
1.结构
醛类物质中都含有醛基( 或__________)。
—CHO
2.甲醛
甲醛的水溶液常用于种子____________、标本的______,甲醛是居室污染气体之一。
杀菌消毒
防腐
3.乙醛与O2的反应为
自主体验
思考感悟
1.比较乙烷和乙醇的结构,下列说法中错误的是( )
A.两个碳原子以单键相连
B.分子里都含有6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
答案:B
2.下列选项中能说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种再生能源
④燃烧时放出大量的热
A.①②③ B.①②④
C.①④ D.②③④
答案:D
课堂互动讲练
乙醇和水与金属钠反应的比较
乙醇分子可以看作水分子里的一个氢原子被乙基(—CH2CH3)取代后的产物。由于乙基对羟基的影响,使羟基上的氢原子活泼性减弱,不如水分子中的氢原子活泼,所以乙醇与钠的反应比水与钠的反应缓和得多。在乙醇分子中,羟基上的氢能被钠置换,而其他氢原子不能被钠置换。钠分别与水、乙醇反应的比较如下:
钠与水的反应 钠与乙醇的反应
现象 钠粒熔为闪亮的小球快速浮游于水面,并迅速消失,发出嘶嘶的声音,有无色、无味的气体生成 钠粒未熔化,沉于乙醇液体底部,并慢慢消失,无任何声音,有无色、无味气体生成
实验结论 钠的密度小于水的密度,熔点低。钠与水剧烈反应放出大量的热,生成氢气。2Na+2H2O===2NaOH+H2↑,水分子中氢原子相对较活泼 钠的密度大于乙醇的密度。钠与乙醇缓慢反应生成氢气。2Na+2CH3CH2OH―→H2↑+2CH3CH2ONa,乙醇分子里羟基氢原子相对不活泼
反应实质 水分子中的氢原子被置换的置换反应 乙醇分子羟基上的氢原子被置换的置换反应
特别提醒:(1)除Na外,其他活泼金属如K、Ca、Mg等也能与乙醇反应产生H2。
(2)证明乙醇与Na能反应的实验时,必须使用无水乙醇,可用无水CuSO4检验乙醇中是否有水存在。
实验室利用如图装置,测定乙醇与钠反应生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目。
例1
(3)有人设想用该实验装置测定钠的相对原子质量,用一定质量的钠与水反应,测定产生氢气的体积,并由此计算钠的相对原子质量。该实验操作时应特别注意的事项是________________________________________,否则会发生的事故为____________________。
【解析】 (1)排水法收集气体,应短管进气,长管出水。故集气瓶中两导管的长度应互换。
(2)乙醇和水物质的量相同时,与钠反应生成的氢气体积相同。相同质量的乙醇和水,水的物质的量多,故用含有少量水的乙醇代替相同质量的无水乙醇与钠反应时产生的氢气多。
(3)因为钠与水反应,非常剧烈,短时间内产生大量的氢气,并放出大量的热,使烧瓶内压强急剧增大,会使烧瓶爆炸。故操作时应特别注意滴加水的速度。要慢慢地逐滴加入水。
【答案】 (1)集气瓶中进气管太长,出水管太短 (2)偏大 (3)滴加水的速度,要非常缓慢地逐滴加水 会发生烧瓶爆炸
变式训练1 (2011年广东梅州高一质检)(1)乙醇和钠的反应与水和钠的反应在反应现象上的区别是____________________________;这说明____________________。
(2)无水乙醇仍含有少量水。将5 g Mg和0.5 g I2(I2为催化剂)放入一个2 L的烧杯中,注入75 mL无水乙醇,缓缓加热,有小气泡逸出。写出此时可能发生的化学反应方程式
_________________________________________
继续加热回流到镁条全部溶解。再加入900 mL无水乙醇,回流30 min,再直接蒸出乙醇,可得99.95%的酒精。写出有关的化学方程式________________________________________。
乙醇的氧化反应
醇的氧化反应主要包括两方面:(1)燃烧;(2)发生催化氧化。将弯成螺旋状的粗铜丝灼烧后,迅速插入乙醇中,会发生下列反应:
由此可以看出,其实质是脱去连接在羟基碳原子上的氢原子与羟基上的氢原子,Cu在其中作催化剂,反应前后质量不变。
按图所示装置,持续通入X气体,可以看到a处固体变为红色,b处变蓝,c处得到液体,则X气体是(已知NH3具有较强的还原性)( )
例2
A.H2 B.CO和H2
C.NH3 D.CH3CH2OH(气体)
【解析】 A、B、C、D四个选项中的气体均能使a处固体变红,b处变蓝,但c处能得到液体的仅有D,该液体是CH3CHO。
【答案】 D
变式训练2 可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1 mol乙醇燃烧生成3 mol水
B.1 mol乙醇可以生成1 mol乙醛
C.1 mol乙醇跟足量的金属Na作用得0.5 mol H2
D.乙醇可以制酒精饮料
解析:选C。乙醇和金属钠反应的性质就是由乙醇分子中的羟基决定的,由此我们可以推知凡分子中含有羟基的物质,都可以与金属钠反应放出氢气。在学习有机物性质时,要特别注意掌握这些特殊原子团的性质。我们可以根据有机物分子的结构推测它的性质,也可以根据有机物的性质来推测它的结构。
探究整合应用
通过实验确定乙醇的结构式的方法
根据乙醇的分子式(C2H6O)和各元素的化合价,其分子可能有两种结构:
我们可以利用乙醇与钠的反应,做下面的实验,装置图如下:
在烧瓶里放入几小块钠,从漏斗中缓缓滴入一定物质的量的无水乙醇,乙醇与适量钠完全反应放出的H2把中间瓶子里的水压入量筒。通过测量量筒中水的体积(应包括由广口瓶到量筒的导管内的水柱的体积),就可知反应生成H2的体积,即可换算成H2的物质的量。
若0.100 mol C2H6O能产生0.050 mol H2,也就是说在1个C2H6O分子中只有1个H可以被Na所置换,从而可以推断乙醇的结构式应为②式。
实验时注意:(1)金属钠要过量;(2)加入乙醇要缓慢;(3)读数时要冷却至室温,且量筒与广口瓶内的液面调至平齐。
某学生采用上图中的装置及实验方法来测定并推断乙醇的分子结构。
(1)该学生分别称取4.60 g乙醇进行多次实验,结果发现以排到量筒内的水的体积作为生成氢气的体积,换算成标准状况下都小于1.12 L。若忽略量筒本身及读数造成的误差,则该学生认为是由于样品中含有少量水造成的,你认为正确吗?________(填“正确”或“不正确”)。如果你认为正确,请说明理由;如果你认为不正确,那么产生这种情况的原因应是什么?________________________________________。
例
(2)该学生认为实验成功的关键有:
①装置气密性良好
②实验开始前要准确确定乙醇的量
③钠足量
④广口瓶内必须充满水
⑤氢气的体积测算方法正确、数据准确
你认为,其中正确的有________(填序号)。
(3)实验后,该学生从乙醇的可能结构分析入手,对乙醇和钠的关系进行讨论,若乙醇的物质的量为n mol,则对钠的物质的量取值要求必须是____________________。
【解析】 (1)理论上,4.60 g乙醇在标准状况下应产生1.12 L氢气。而相同质量的C2H5OH和H2O与Na反应,H2O产生的氢气多,故不正确。分析装置可知,广口瓶与量筒间玻璃导管中水的体积未算在内。(2)由实验过程装置图可知,选①②③⑤。(3)由反应知,理论上n mol C2H5OH应消耗n mol Na,实际中加入的Na有少量被空气中的氧气氧化且要求乙醇全部反应,故Na应适度过量。
【答案】 (1)不正确 广口瓶与量筒间玻璃导管中水柱体积未算在内 (2)①②③⑤ (3)大于n mol
第二单元 食品中的有机化合物
第1课时 乙醇
第1课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、乙醇
1.乙醇的分子结构
分子式 结构式 结构简式 特殊原子团
_______ CH3CH2OH ______羟基
C2H6O
—OH
思考感悟
1.根据乙醇的分子模型,能判断出乙醇分子中有几种氢原子吗?—OH与OH-是相同的吗?
2.乙醇的物理性质
颜色 状态 气味 密度 水溶性
无色 液体 _________ 比水___ _______________
特殊香味
小
与水以任意比互溶
3.乙醇的化学性质
(1)实验探究
实验操作 实验现象
钠沉在试管底部,缓慢反应有气泡产生比钠与水的反应_____
铜丝灼烧时变黑,插入乙醇后_____,反复几次可闻到____________
缓慢
变红
刺激性气味
(2)主要化学反应
2CH3CH2OH+2Na→
2CH3CH2ONa+H2↑
2CH3CHO+2H2O
2.能否用酒精萃取溴水中的溴?直接加热蒸馏的方法能得到无水酒精吗?如果不能应如何操作?
【提示】 不能。因为酒精和水可以以任意比互溶,因此不能用酒精萃取溴水中的溴。水的沸点为100 ℃,酒精的沸点为78.5 ℃,因此不能用直接蒸馏的方法获得无水酒精,应先加生石灰,然后再蒸馏。
思考感悟
二、醛类
1.结构
醛类物质中都含有醛基( 或__________)。
—CHO
2.甲醛
甲醛的水溶液常用于种子____________、标本的______,甲醛是居室污染气体之一。
杀菌消毒
防腐
3.乙醛与O2的反应为
自主体验
思考感悟
1.比较乙烷和乙醇的结构,下列说法中错误的是( )
A.两个碳原子以单键相连
B.分子里都含有6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
答案:B
2.下列选项中能说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种再生能源
④燃烧时放出大量的热
A.①②③ B.①②④
C.①④ D.②③④
答案:D
课堂互动讲练
乙醇和水与金属钠反应的比较
乙醇分子可以看作水分子里的一个氢原子被乙基(—CH2CH3)取代后的产物。由于乙基对羟基的影响,使羟基上的氢原子活泼性减弱,不如水分子中的氢原子活泼,所以乙醇与钠的反应比水与钠的反应缓和得多。在乙醇分子中,羟基上的氢能被钠置换,而其他氢原子不能被钠置换。钠分别与水、乙醇反应的比较如下:
钠与水的反应 钠与乙醇的反应
现象 钠粒熔为闪亮的小球快速浮游于水面,并迅速消失,发出嘶嘶的声音,有无色、无味的气体生成 钠粒未熔化,沉于乙醇液体底部,并慢慢消失,无任何声音,有无色、无味气体生成
实验结论 钠的密度小于水的密度,熔点低。钠与水剧烈反应放出大量的热,生成氢气。2Na+2H2O===2NaOH+H2↑,水分子中氢原子相对较活泼 钠的密度大于乙醇的密度。钠与乙醇缓慢反应生成氢气。2Na+2CH3CH2OH―→H2↑+2CH3CH2ONa,乙醇分子里羟基氢原子相对不活泼
反应实质 水分子中的氢原子被置换的置换反应 乙醇分子羟基上的氢原子被置换的置换反应
特别提醒:(1)除Na外,其他活泼金属如K、Ca、Mg等也能与乙醇反应产生H2。
(2)证明乙醇与Na能反应的实验时,必须使用无水乙醇,可用无水CuSO4检验乙醇中是否有水存在。
实验室利用如图装置,测定乙醇与钠反应生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子数目。
例1
(3)有人设想用该实验装置测定钠的相对原子质量,用一定质量的钠与水反应,测定产生氢气的体积,并由此计算钠的相对原子质量。该实验操作时应特别注意的事项是________________________________________,否则会发生的事故为____________________。
【解析】 (1)排水法收集气体,应短管进气,长管出水。故集气瓶中两导管的长度应互换。
(2)乙醇和水物质的量相同时,与钠反应生成的氢气体积相同。相同质量的乙醇和水,水的物质的量多,故用含有少量水的乙醇代替相同质量的无水乙醇与钠反应时产生的氢气多。
(3)因为钠与水反应,非常剧烈,短时间内产生大量的氢气,并放出大量的热,使烧瓶内压强急剧增大,会使烧瓶爆炸。故操作时应特别注意滴加水的速度。要慢慢地逐滴加入水。
【答案】 (1)集气瓶中进气管太长,出水管太短 (2)偏大 (3)滴加水的速度,要非常缓慢地逐滴加水 会发生烧瓶爆炸
变式训练1 (2011年广东梅州高一质检)(1)乙醇和钠的反应与水和钠的反应在反应现象上的区别是____________________________;这说明____________________。
(2)无水乙醇仍含有少量水。将5 g Mg和0.5 g I2(I2为催化剂)放入一个2 L的烧杯中,注入75 mL无水乙醇,缓缓加热,有小气泡逸出。写出此时可能发生的化学反应方程式
_________________________________________
继续加热回流到镁条全部溶解。再加入900 mL无水乙醇,回流30 min,再直接蒸出乙醇,可得99.95%的酒精。写出有关的化学方程式________________________________________。
乙醇的氧化反应
醇的氧化反应主要包括两方面:(1)燃烧;(2)发生催化氧化。将弯成螺旋状的粗铜丝灼烧后,迅速插入乙醇中,会发生下列反应:
由此可以看出,其实质是脱去连接在羟基碳原子上的氢原子与羟基上的氢原子,Cu在其中作催化剂,反应前后质量不变。
按图所示装置,持续通入X气体,可以看到a处固体变为红色,b处变蓝,c处得到液体,则X气体是(已知NH3具有较强的还原性)( )
例2
A.H2 B.CO和H2
C.NH3 D.CH3CH2OH(气体)
【解析】 A、B、C、D四个选项中的气体均能使a处固体变红,b处变蓝,但c处能得到液体的仅有D,该液体是CH3CHO。
【答案】 D
变式训练2 可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1 mol乙醇燃烧生成3 mol水
B.1 mol乙醇可以生成1 mol乙醛
C.1 mol乙醇跟足量的金属Na作用得0.5 mol H2
D.乙醇可以制酒精饮料
解析:选C。乙醇和金属钠反应的性质就是由乙醇分子中的羟基决定的,由此我们可以推知凡分子中含有羟基的物质,都可以与金属钠反应放出氢气。在学习有机物性质时,要特别注意掌握这些特殊原子团的性质。我们可以根据有机物分子的结构推测它的性质,也可以根据有机物的性质来推测它的结构。
探究整合应用
通过实验确定乙醇的结构式的方法
根据乙醇的分子式(C2H6O)和各元素的化合价,其分子可能有两种结构:
我们可以利用乙醇与钠的反应,做下面的实验,装置图如下:
在烧瓶里放入几小块钠,从漏斗中缓缓滴入一定物质的量的无水乙醇,乙醇与适量钠完全反应放出的H2把中间瓶子里的水压入量筒。通过测量量筒中水的体积(应包括由广口瓶到量筒的导管内的水柱的体积),就可知反应生成H2的体积,即可换算成H2的物质的量。
若0.100 mol C2H6O能产生0.050 mol H2,也就是说在1个C2H6O分子中只有1个H可以被Na所置换,从而可以推断乙醇的结构式应为②式。
实验时注意:(1)金属钠要过量;(2)加入乙醇要缓慢;(3)读数时要冷却至室温,且量筒与广口瓶内的液面调至平齐。
某学生采用上图中的装置及实验方法来测定并推断乙醇的分子结构。
(1)该学生分别称取4.60 g乙醇进行多次实验,结果发现以排到量筒内的水的体积作为生成氢气的体积,换算成标准状况下都小于1.12 L。若忽略量筒本身及读数造成的误差,则该学生认为是由于样品中含有少量水造成的,你认为正确吗?________(填“正确”或“不正确”)。如果你认为正确,请说明理由;如果你认为不正确,那么产生这种情况的原因应是什么?________________________________________。
例
(2)该学生认为实验成功的关键有:
①装置气密性良好
②实验开始前要准确确定乙醇的量
③钠足量
④广口瓶内必须充满水
⑤氢气的体积测算方法正确、数据准确
你认为,其中正确的有________(填序号)。
(3)实验后,该学生从乙醇的可能结构分析入手,对乙醇和钠的关系进行讨论,若乙醇的物质的量为n mol,则对钠的物质的量取值要求必须是____________________。
【解析】 (1)理论上,4.60 g乙醇在标准状况下应产生1.12 L氢气。而相同质量的C2H5OH和H2O与Na反应,H2O产生的氢气多,故不正确。分析装置可知,广口瓶与量筒间玻璃导管中水的体积未算在内。(2)由实验过程装置图可知,选①②③⑤。(3)由反应知,理论上n mol C2H5OH应消耗n mol Na,实际中加入的Na有少量被空气中的氧气氧化且要求乙醇全部反应,故Na应适度过量。
【答案】 (1)不正确 广口瓶与量筒间玻璃导管中水柱体积未算在内 (2)①②③⑤ (3)大于n mol
