2011年高一化学精品课件:4.1 化学是认识和创造物质的科学(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:4.1 化学是认识和创造物质的科学(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 599.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 00:00:00 | ||
图片预览








文档简介
(共45张PPT)
第一单元 化学是认识和创造物质的科学
第一单元
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、化学是打开物质世界的钥匙
1.人类对金属使用的发展过程
(1)金属使用的发展历程
金属铜约在6000年前已大规模利用,铁约在2500年前,而铝的使用仅有200年左右,这与金属的活动性及人类冶炼金属的技术有关。
(2)金属的活动性与金属冶炼的关系
②冶炼依据:金属的__________不同,冶炼方法不同;
③冶炼方法:_________、____________、
__________及__________。
活动性
电解法
热还原法
热分解法
富集法
思考感悟
1.在金属中,铝元素在地壳中的含量居第一位,为什么铝的发现和使用比铜和铁要晚得多?
【提示】 金属的发现和使用与金属的活泼性密切相关,金属越活泼,其相应的金属阳离子得电子的能力越弱,冶炼难度越大。铝是一种非常活泼的金属,用一般的还原剂很难将其还原,工业上采用最强有力的氧化还原手段——电解法进行冶炼,而铜和铁用一般的还原剂就可以达到目的,所以铝的发现和使用比铜和铁要晚得多。
2.化学科学理论的建立与发展
(1)19世纪
①以道尔顿原子论、分子结构论和
__________________为中心内容的经典原子分子论的建立。
②1869年门捷列夫发现了_______________。
③质量作用定律的提出奠定了化学反应的动力学基础。
④_____的人工合成,彻底动摇了“生命力论”。
原子价键理论
元素周期律
尿素
(2)20世纪
①化学家鲍林提出了氢键理论和__________分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础。
②扫描隧道显微镜的发展,实现了对
_____________的操纵。
蛋白质
原子或分子
3.人类对酸碱认识的发展
(1)阿伦尼乌斯电离学说
①酸:电解质电离产生的阳离子全部是________的化合物,如HCl、H2SO4等。
②碱:电解质电离产生的阴离子全部是
______________的化合物,如NaOH等。
(2)酸碱质子理论
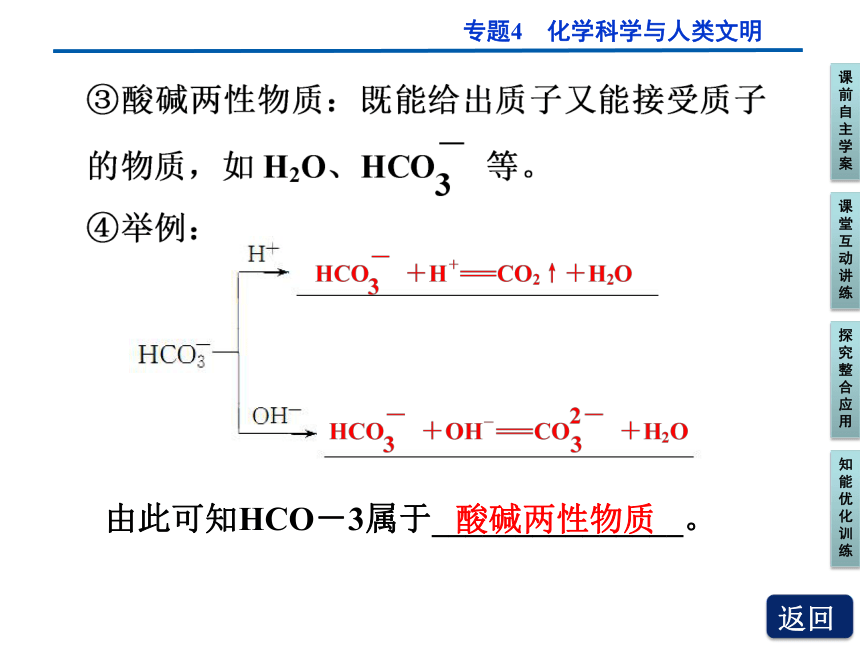
①酸:能给出质子的物质,如HNO3、CH3COOH等。
②碱:能接受质子的物质,如OH-、CH3COO-等。
氢离子
氢氧根离子
由此可知HCO-3属于_______________。
酸碱两性物质
思考感悟
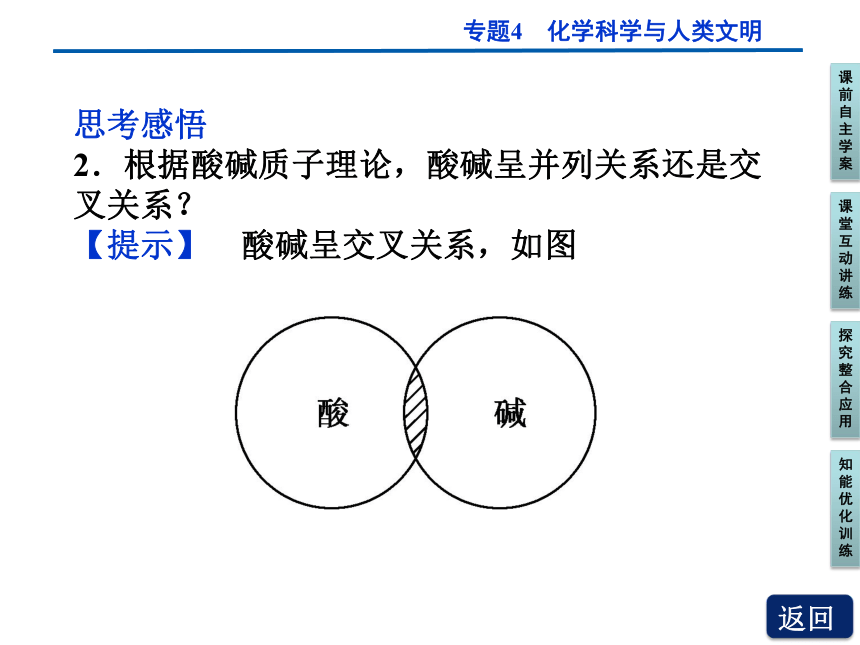
2.根据酸碱质子理论,酸碱呈并列关系还是交叉关系?
【提示】 酸碱呈交叉关系,如图
二、化学是人类创造新物质的工具
通过化学合成技术合成或分离出的物质满足了人类的需要,是化学对人类文明的重大贡献之一。
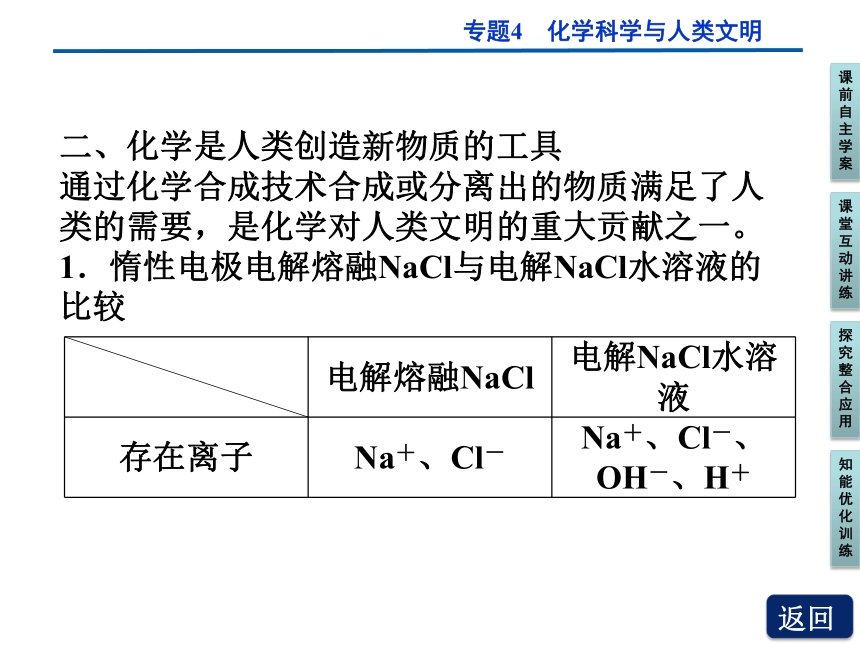
1.惰性电极电解熔融NaCl与电解NaCl水溶液的比较
电解熔融NaCl 电解NaCl水溶液
存在离子 Na+、Cl- Na+、Cl-、OH-、H+
电解熔融NaCl 电解NaCl水溶液
电极反应式 阳极:
____________________
阴极
________________ 阳极:
________________
阴极:
_________________
电解熔融NaCl 电解NaCl水溶液
电解产物 Na、Cl2 H2、Cl2、NaOH
电解方程式 ________________ ______________
______________
___________
2.合成氨
(1)反应原理:__________________________。
(2)合成氨技术对人类的贡献:哈伯等人于20世纪初发明的合成氨技术,使世界粮食产量增长近一倍。
3.合成农药
(1)DDT:残留毒性,对环境危害大。
(2)发展方向:研制高效、低残毒、能够被生物降解的新型农药。
4.合成医药
抗生素和新药物的合成,提高了人类控制和治疗疾病的能力。
1.下列广告用语在科学上没有错误的是( )
A.这种饮料中不含任何化学物质
B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷等微量元素
D.没有水就没有生命
答案:D
自主体验
2.诺贝尔奖曾授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,使整个化学领域经历了一场革命性的变化。下列说法正确的是( )
A.化学不再是纯实验科学
B.化学不再需要实验
C.化学不做实验,就什么都不知道
D.未来化学的方向还是经验化
答案:A
3.关于实验室电解饱和食盐水的下列说法中正确的是( )
A.可以用Fe作阳极
B.阳极产生Cl2
C.阳极发生还原反应
D.酚酞试液在阳极区显红色
答案:B
课堂互动讲练
对金属的认识和冶炼
1.不同的金属元素,将其由化合态还原为游离态的难易程度是不相同的,有的还差别很大。
金属元素的原子失去电子越容易,该金属元素的阳离子(或正价态原子)得电子就越难;相反,金属元素的原子失去电子越难,该金属元素的阳离子(或正价态原子)得电子就越容易。
2.金属冶炼的方法与金属的活动性有关,很不活泼的金属用热分解法,因为其阳离子的氧化性比较强;活泼金属的还原性比较强,很难找到还原剂,通常用电解法;其他金属常用热还原法。参照下表:
金属的活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属原子失电子能力 强→弱
金属离子得电子能力 弱→强
主要冶炼方法 电解法 热还原法 热分解法
例1
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2、CO)法;③活泼金属置换法;④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析中不正确的是( )
A.(Ⅰ),① B.(Ⅱ),②
C.(Ⅲ),③ D.(Ⅳ),④
【解析】 掌握各种冶炼金属方法的原理是解答本题的关键。由于金属的化学活动性不同,金属离子得到电子还原成金属原子的能力也就不同,因此必须采用不同的冶炼方法。
(1)热分解法:适用于冶炼金属活动性较差的金
属,如汞、银;
(2)热还原法:用还原剂(C、CO、H2、Al)还原金属氧化物,适合于金属活动性介于Zn~Cu之间的大多数金属的冶炼;
【答案】 B
【规律方法】 选择金属的冶炼方法与金属在自然界中存在的状态、金属活动性有关,需要在理解的基础上加以记忆,掌握各种活动性不同的金属的冶炼方法。
变式训练1 我国古代炼丹著作《黄白第十六》是世界上最古老的冶金化学著作。这部著作有如下几条记载:
(1)曾青涂铁,铁赤如铜。
(2)铅性白也,而赤之以为丹,丹性赤也,而白之以为铅。
(3)丹砂烧之成水银,积变又成丹砂。
用化学方程式表示上述变化过程。这些最古老的记载说明了中国古代对世界人类进步起了什么重要的作用?
解析:曾青,古代泛指可溶性铜盐溶液,例如,硫酸铜溶液、氯化铜溶液等。丹砂又名朱砂,红色天然矿HgS,因产自湖南辰溪故又名辰砂。HgS有两种晶型:一种为红色,一种为黑色,两者在一定条件下可以发生转化。
酸碱质子理论
根据酸碱质子理论,凡是能给出质子(H+)的物质是酸,能接受质子的物质是碱,能给出多个质子的物质是多元酸,能接受多个质子的物质是多元碱。酸(HA)给出质子后变成它对应的共轭碱(A-),碱(A-)接受质子后便变成它对应的共轭酸。HA和A-相互依存,称之为共轭酸碱对,共轭酸碱对间通过质子转移而相互转化。酸和碱可以是中性分子,也可以是阳离子或阴离子。
例2
根据酸碱质子理论,下列说法不正确的是
( )
A.所有的弱酸根都是碱
B.酸式弱酸根既是酸又是碱
C.不可能一种物质既是酸又是碱
D.氢氧根是碱
【解析】 弱酸根和酸式弱酸根都是弱酸部分电离的产物,弱酸的电离是可逆的,其逆反应就是弱酸根或酸式弱酸根与氢离子结合生成弱酸的反应,因能结合氢离子,所以它们都是碱,A正确。而酸式弱酸根还能电离出氢离子,所以它又是酸,可见B对C错。
【答案】 C
【规律方法】 根据不同的酸碱定义,每种物质的酸碱性可能不一样,主要是因为化学知识在不断地发展,人类对物质的结构、性质和变化的认识逐步深入。
变式训练2 依据酸碱质子理论,下列物质属于碱的是( )
A.硝酸钾 B.小苏打
C.食盐 D.苛性钠
解析:选D。酸碱质子理论认为凡能给出质子(H+)的物质是酸;凡能接受质子(H+)的物质是碱。若某物质既能给出质子又能接受质子,称之为酸碱两性物质。所以小苏打是酸碱两性物质,苛性钠是碱。硝酸钾和食盐既不是酸也不是碱。
详见课前自主学案。
电解熔融NaCl和食盐水比较
如图为阳离子交换膜法电解饱和食盐水原理示意图,下列说法不正确的是( )
例3
【答案】 D
变式训练3 工业上常用电解熔融氯化钠的方法制取金属钠和氯气,试回答下列问题:
(1)金属钠在________极上产生。
(2)写出产生Cl2的电极反应方程式:______________________________________。
(3)该反应________(填“是”或“不是”)离子反应。
解析:熔化状态的氯化钠中只存在Na+、Cl-,通电时Cl-、Na+分别在阳极、阴极上生成Cl2、Na。
答案:(1)阴 (2)2Cl--2e-===Cl2↑ (3)是
探究整合应用
创造新物质
在化学科学的发展过程中,人们已经能够设计并创造出符合某种需要、具有特定性质的新物质。
在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
例
(1)该合成路线对于环境保护的价值在于____________________。
(2)已知1 mol CO2(g)和3 mol H2(g)完全反应生成CH3OH(l)和H2O(l),放出热量为131.9 kJ,写出工业上以CO2、H2合成CH3OH的热化学方程式:____________________________________。
(3)科学家发明了一种基于上图所示原理的廉价光电化学电池装置,写出光照时半导体电极表面发生的电极反应式:_______________________________________。
(4)目前应用最多的半导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可作为新能源的原因可能的是______(填编号)。
a.硅燃烧产物对环境危害小,而且易处理
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全运输、贮存
【解析】 (1)合成路线是将CO2转化为甲醇,可减少CO2的排放。
(3)图中表示利用光能将水电解生成氢气和氧气,即由光能转化为化学能的装置。由图中电子的流向可知,半导体电极为电子流出极,即发生氧化反应极,2H2O-4e-===O2↑+4H+。
(4)新能源的概念关键在于“新”字,另外要符合新能源要求,即来源丰富、热值高、使用后对环境无污染等。
【答案】 (1)有利于防止温室效应
(2)CO2(g)+3H2(g)===CH3OH(l)+H2O(l)
ΔH=-131.9 kJ·mol-1
(3)2H2O-4e-===O2↑+4H+ (4)abcd
第一单元 化学是认识和创造物质的科学
第一单元
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、化学是打开物质世界的钥匙
1.人类对金属使用的发展过程
(1)金属使用的发展历程
金属铜约在6000年前已大规模利用,铁约在2500年前,而铝的使用仅有200年左右,这与金属的活动性及人类冶炼金属的技术有关。
(2)金属的活动性与金属冶炼的关系
②冶炼依据:金属的__________不同,冶炼方法不同;
③冶炼方法:_________、____________、
__________及__________。
活动性
电解法
热还原法
热分解法
富集法
思考感悟
1.在金属中,铝元素在地壳中的含量居第一位,为什么铝的发现和使用比铜和铁要晚得多?
【提示】 金属的发现和使用与金属的活泼性密切相关,金属越活泼,其相应的金属阳离子得电子的能力越弱,冶炼难度越大。铝是一种非常活泼的金属,用一般的还原剂很难将其还原,工业上采用最强有力的氧化还原手段——电解法进行冶炼,而铜和铁用一般的还原剂就可以达到目的,所以铝的发现和使用比铜和铁要晚得多。
2.化学科学理论的建立与发展
(1)19世纪
①以道尔顿原子论、分子结构论和
__________________为中心内容的经典原子分子论的建立。
②1869年门捷列夫发现了_______________。
③质量作用定律的提出奠定了化学反应的动力学基础。
④_____的人工合成,彻底动摇了“生命力论”。
原子价键理论
元素周期律
尿素
(2)20世纪
①化学家鲍林提出了氢键理论和__________分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础。
②扫描隧道显微镜的发展,实现了对
_____________的操纵。
蛋白质
原子或分子
3.人类对酸碱认识的发展
(1)阿伦尼乌斯电离学说
①酸:电解质电离产生的阳离子全部是________的化合物,如HCl、H2SO4等。
②碱:电解质电离产生的阴离子全部是
______________的化合物,如NaOH等。
(2)酸碱质子理论
①酸:能给出质子的物质,如HNO3、CH3COOH等。
②碱:能接受质子的物质,如OH-、CH3COO-等。
氢离子
氢氧根离子
由此可知HCO-3属于_______________。
酸碱两性物质
思考感悟
2.根据酸碱质子理论,酸碱呈并列关系还是交叉关系?
【提示】 酸碱呈交叉关系,如图
二、化学是人类创造新物质的工具
通过化学合成技术合成或分离出的物质满足了人类的需要,是化学对人类文明的重大贡献之一。
1.惰性电极电解熔融NaCl与电解NaCl水溶液的比较
电解熔融NaCl 电解NaCl水溶液
存在离子 Na+、Cl- Na+、Cl-、OH-、H+
电解熔融NaCl 电解NaCl水溶液
电极反应式 阳极:
____________________
阴极
________________ 阳极:
________________
阴极:
_________________
电解熔融NaCl 电解NaCl水溶液
电解产物 Na、Cl2 H2、Cl2、NaOH
电解方程式 ________________ ______________
______________
___________
2.合成氨
(1)反应原理:__________________________。
(2)合成氨技术对人类的贡献:哈伯等人于20世纪初发明的合成氨技术,使世界粮食产量增长近一倍。
3.合成农药
(1)DDT:残留毒性,对环境危害大。
(2)发展方向:研制高效、低残毒、能够被生物降解的新型农药。
4.合成医药
抗生素和新药物的合成,提高了人类控制和治疗疾病的能力。
1.下列广告用语在科学上没有错误的是( )
A.这种饮料中不含任何化学物质
B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷等微量元素
D.没有水就没有生命
答案:D
自主体验
2.诺贝尔奖曾授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,使整个化学领域经历了一场革命性的变化。下列说法正确的是( )
A.化学不再是纯实验科学
B.化学不再需要实验
C.化学不做实验,就什么都不知道
D.未来化学的方向还是经验化
答案:A
3.关于实验室电解饱和食盐水的下列说法中正确的是( )
A.可以用Fe作阳极
B.阳极产生Cl2
C.阳极发生还原反应
D.酚酞试液在阳极区显红色
答案:B
课堂互动讲练
对金属的认识和冶炼
1.不同的金属元素,将其由化合态还原为游离态的难易程度是不相同的,有的还差别很大。
金属元素的原子失去电子越容易,该金属元素的阳离子(或正价态原子)得电子就越难;相反,金属元素的原子失去电子越难,该金属元素的阳离子(或正价态原子)得电子就越容易。
2.金属冶炼的方法与金属的活动性有关,很不活泼的金属用热分解法,因为其阳离子的氧化性比较强;活泼金属的还原性比较强,很难找到还原剂,通常用电解法;其他金属常用热还原法。参照下表:
金属的活动性顺序 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属原子失电子能力 强→弱
金属离子得电子能力 弱→强
主要冶炼方法 电解法 热还原法 热分解法
例1
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2、CO)法;③活泼金属置换法;④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析中不正确的是( )
A.(Ⅰ),① B.(Ⅱ),②
C.(Ⅲ),③ D.(Ⅳ),④
【解析】 掌握各种冶炼金属方法的原理是解答本题的关键。由于金属的化学活动性不同,金属离子得到电子还原成金属原子的能力也就不同,因此必须采用不同的冶炼方法。
(1)热分解法:适用于冶炼金属活动性较差的金
属,如汞、银;
(2)热还原法:用还原剂(C、CO、H2、Al)还原金属氧化物,适合于金属活动性介于Zn~Cu之间的大多数金属的冶炼;
【答案】 B
【规律方法】 选择金属的冶炼方法与金属在自然界中存在的状态、金属活动性有关,需要在理解的基础上加以记忆,掌握各种活动性不同的金属的冶炼方法。
变式训练1 我国古代炼丹著作《黄白第十六》是世界上最古老的冶金化学著作。这部著作有如下几条记载:
(1)曾青涂铁,铁赤如铜。
(2)铅性白也,而赤之以为丹,丹性赤也,而白之以为铅。
(3)丹砂烧之成水银,积变又成丹砂。
用化学方程式表示上述变化过程。这些最古老的记载说明了中国古代对世界人类进步起了什么重要的作用?
解析:曾青,古代泛指可溶性铜盐溶液,例如,硫酸铜溶液、氯化铜溶液等。丹砂又名朱砂,红色天然矿HgS,因产自湖南辰溪故又名辰砂。HgS有两种晶型:一种为红色,一种为黑色,两者在一定条件下可以发生转化。
酸碱质子理论
根据酸碱质子理论,凡是能给出质子(H+)的物质是酸,能接受质子的物质是碱,能给出多个质子的物质是多元酸,能接受多个质子的物质是多元碱。酸(HA)给出质子后变成它对应的共轭碱(A-),碱(A-)接受质子后便变成它对应的共轭酸。HA和A-相互依存,称之为共轭酸碱对,共轭酸碱对间通过质子转移而相互转化。酸和碱可以是中性分子,也可以是阳离子或阴离子。
例2
根据酸碱质子理论,下列说法不正确的是
( )
A.所有的弱酸根都是碱
B.酸式弱酸根既是酸又是碱
C.不可能一种物质既是酸又是碱
D.氢氧根是碱
【解析】 弱酸根和酸式弱酸根都是弱酸部分电离的产物,弱酸的电离是可逆的,其逆反应就是弱酸根或酸式弱酸根与氢离子结合生成弱酸的反应,因能结合氢离子,所以它们都是碱,A正确。而酸式弱酸根还能电离出氢离子,所以它又是酸,可见B对C错。
【答案】 C
【规律方法】 根据不同的酸碱定义,每种物质的酸碱性可能不一样,主要是因为化学知识在不断地发展,人类对物质的结构、性质和变化的认识逐步深入。
变式训练2 依据酸碱质子理论,下列物质属于碱的是( )
A.硝酸钾 B.小苏打
C.食盐 D.苛性钠
解析:选D。酸碱质子理论认为凡能给出质子(H+)的物质是酸;凡能接受质子(H+)的物质是碱。若某物质既能给出质子又能接受质子,称之为酸碱两性物质。所以小苏打是酸碱两性物质,苛性钠是碱。硝酸钾和食盐既不是酸也不是碱。
详见课前自主学案。
电解熔融NaCl和食盐水比较
如图为阳离子交换膜法电解饱和食盐水原理示意图,下列说法不正确的是( )
例3
【答案】 D
变式训练3 工业上常用电解熔融氯化钠的方法制取金属钠和氯气,试回答下列问题:
(1)金属钠在________极上产生。
(2)写出产生Cl2的电极反应方程式:______________________________________。
(3)该反应________(填“是”或“不是”)离子反应。
解析:熔化状态的氯化钠中只存在Na+、Cl-,通电时Cl-、Na+分别在阳极、阴极上生成Cl2、Na。
答案:(1)阴 (2)2Cl--2e-===Cl2↑ (3)是
探究整合应用
创造新物质
在化学科学的发展过程中,人们已经能够设计并创造出符合某种需要、具有特定性质的新物质。
在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
例
(1)该合成路线对于环境保护的价值在于____________________。
(2)已知1 mol CO2(g)和3 mol H2(g)完全反应生成CH3OH(l)和H2O(l),放出热量为131.9 kJ,写出工业上以CO2、H2合成CH3OH的热化学方程式:____________________________________。
(3)科学家发明了一种基于上图所示原理的廉价光电化学电池装置,写出光照时半导体电极表面发生的电极反应式:_______________________________________。
(4)目前应用最多的半导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可作为新能源的原因可能的是______(填编号)。
a.硅燃烧产物对环境危害小,而且易处理
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全运输、贮存
【解析】 (1)合成路线是将CO2转化为甲醇,可减少CO2的排放。
(3)图中表示利用光能将水电解生成氢气和氧气,即由光能转化为化学能的装置。由图中电子的流向可知,半导体电极为电子流出极,即发生氧化反应极,2H2O-4e-===O2↑+4H+。
(4)新能源的概念关键在于“新”字,另外要符合新能源要求,即来源丰富、热值高、使用后对环境无污染等。
【答案】 (1)有利于防止温室效应
(2)CO2(g)+3H2(g)===CH3OH(l)+H2O(l)
ΔH=-131.9 kJ·mol-1
(3)2H2O-4e-===O2↑+4H+ (4)abcd
