2011年高一化学精品课件:1.1.1 原子核外电子的排布(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:1.1.1 原子核外电子的排布(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 389.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 00:00:00 | ||
图片预览




文档简介
(共28张PPT)
第1课时 原子核外电子的排布
第1课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
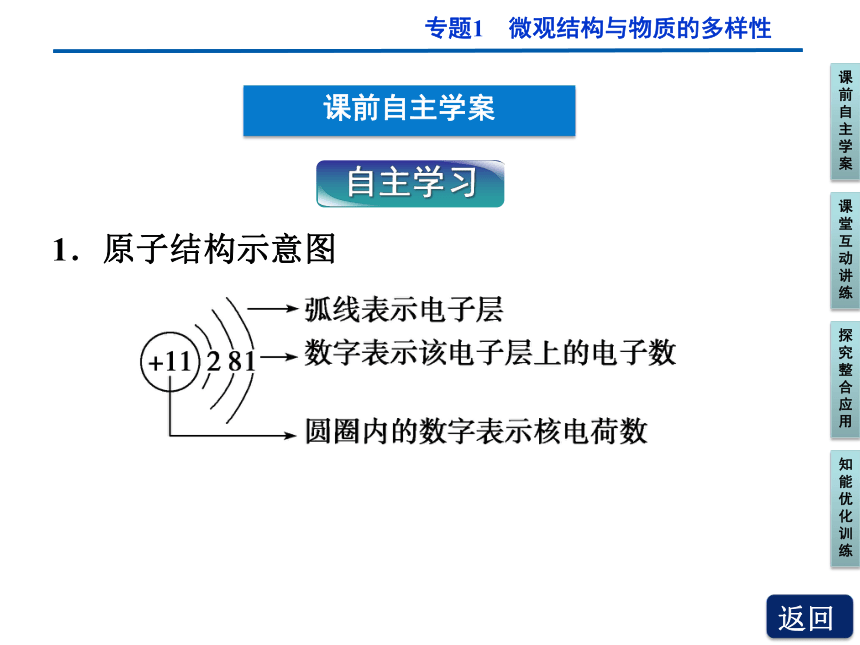
课前自主学案
自主学习
1.原子结构示意图
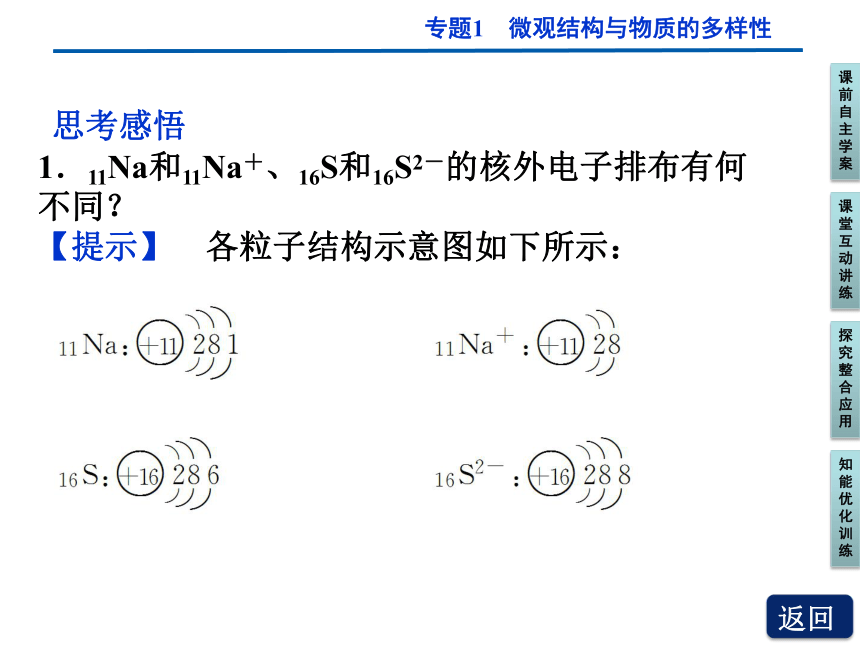
1.11Na和11Na+、16S和16S2-的核外电子排布有何不同?
【提示】 各粒子结构示意图如下所示:
思考感悟
低
高
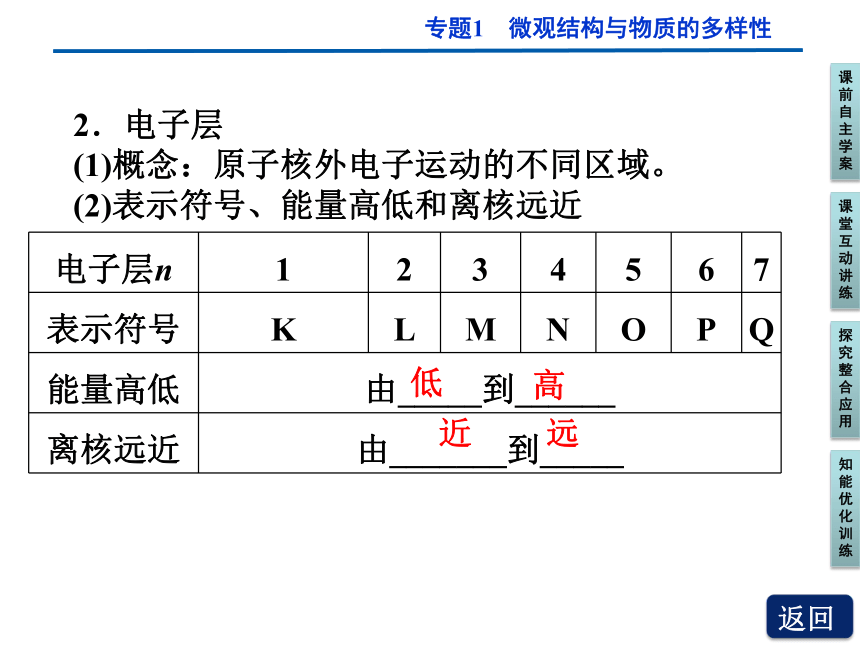
2.电子层
(1)概念:原子核外电子运动的不同区域。
(2)表示符号、能量高低和离核远近
电子层n 1 2 3 4 5 6 7
表示符号 K L M N O P Q
能量高低 由_____到______
离核远近 由_______到_____
近
远
3.原子核外电子的排布规律
(1)电子尽量先排布在能量_______的电子层里。
(2)各电子层最多能容纳_______个电子(n为电子层数)。
(3)最外层电子数不超过_____个(当K层为最外层时不超过____个)。
(4)次外层电子数不超过_____个。
最低
2n2
8
2
18
2.(1)稀有气体元素的原子核外电子层K、L、M、N层最多能容纳的电子数分别为多少?
(2)若假设某元素原子核外有7个电子层,则P电子层最多容纳的电子数为多少?
【提示】 (1)2、8、18、32。 (2)P电子层为第6层,最多可以容纳2×62=72个电子,但是此时P层是次外层,所以P层最多容纳18个电子。
思考感悟
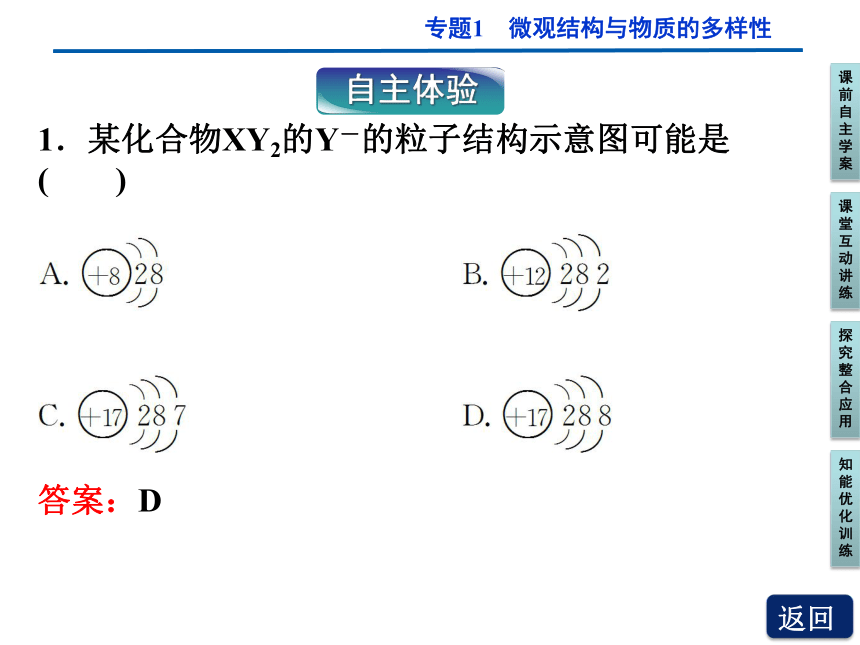
1.某化合物XY2的Y-的粒子结构示意图可能是
( )
答案:D
自主体验
2.下列离子中,电子数大于质子数且质子数大于中子数的是( )
A.D3O+ B.Li+
C.OD- D.OH-
答案:D
答案:B
课堂互动讲练
核外电子排布的规律
1.能量最低原理
原子核外电子总是先排布在能量最低的电子层,然后由里向外,依次排布在能量逐步升高的电子层
(能量最低原理),即排满了K层才排L层,排满了L层才排M层。
2.原子核外各电子层最多容纳2n2个电子。
3.原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
4.次外层最多能容纳的电子数目不超过18个,倒数第三层不超过32个。
特别提醒:(1)核外电子排布的规律是相互联系的,不能孤立地理解,如当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,最多可以排布8个电子。
(2)电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为:
。
例1
【解析】 根据核外电子排布规律,最外层不超过8个电子,而K层最多可容纳2个电子,L层最多可容纳8个电子,M层最多可容纳18个电子。当n层为最外层时,最多可容纳8个电子,而第(n-1)层最多可容纳8个电子应为L层;当n为次外层时,其最多容纳的电子数比(n-1)层多10个,则证明(n-1)层不是K层,而是L层,则n层为M层。
【答案】 C
解析:选B。根据核外电子排布规律可知,A正确;当M为最外层时可能的电子数为1~8,而此时的L层电子数为8个,B不正确;只有一个电子层,即为K层,最多只能容纳2个电子,C正确;1~18号元素只有He、Ne两种元素原子核外电子排布满足此要求,D正确。
具有相同电子层排布的微粒
1.具有相同电子层排布的微粒的含义:电子层数相同,各层电子数也相同的单个原子或离子。
2.与He原子具有相同电子层排布的微粒(2电子微粒):
阴离子 原子 阳离子 电子层排布
H- He Li+ Be2+
3.与Ne原子具有相同电子层排布的微粒(10电子微粒):
阴离子 原子 阳离子 电子层排布
N3- O2- F- Ne Na+ Mg2+
Al3+
4.与Ar原子具有相同电子层排布的微粒(18电子微粒):
阴离子 原子 阳离子 电子层排布
P3- S2- Cl- Ar K+ Ca2+
例2
(2011年浙江杭州高一调研)已知aXm+和bYn-两种离子的电子层结构相同,则a等于( )
A.b+m+n B.b+m-n
C.b-m+n D.b-m-n
【解析】 aX核外有a个电子,aXm+核外有(a-m)个电子;bY核外有b个电子,bYn-核外有(b+n)个电子,所以有a-m=b+n,即a=b+m+n。
【答案】 A
变式训练2 设A、B、C代表三种元素。已知①
A+和B-两种离子具有相同的电子层结构;②C元素原子核内质子数比B元素原子核内质子数少9个;③B和C两种元素可形成4核42个电子的负一价阴离子。据此,请填空:
(1)B元素是________,C元素是________(填元素符号)。
(2)由A、B、C三种元素所形成的含68个电子的盐类化合物的化学式是________。
答案:(1)Cl O (2)KClO4
探究整合应用
短周期元素粒子的特殊性
核电荷数为1~18的元素原子核外电子层结构的特殊性:
(1)原子中无中子的原子:1H。
(2)最外层电子数等于次外层电子数一半的元素:Li、Si。
(3)最外层电子数等于次外层电子数的元素:Be、Ar。
(4)最外层电子数等于次外层电子数2倍的元素:C。
(5)最外层电子数等于次外层电子数3倍的元素:O。
(6)最外层电子数等于次外层电子数4倍的元素:Ne。
(7)最外层有1个电子的元素:H、Li、Na。
(8)最外层有2个电子的元素:He、Be、Mg。
(9)电子层数与最外层电子数相等的元素:H、
Be、Al。
(10)电子总数为最外层电子数2倍的元素:Be。
(11)内层电子总数是最外层电子数2倍的元素:
Li、P。
下列各题中的物质均由核电荷数为1~10的元素组成。请填写化学式:
(1)只有两个原子核和两个电子组成的分子是________。
(2)1个最外层有4个电子的原子和2个最外层有6个电子的原子结合成的分子是________。
(3)1个L层有5个电子的原子和3个只有1个电子的原子结合成的分子是________。
(4)由3个最外层是6个电子的原子结合而成的分子是________。
(5)由10个电子结合成的双核分子是________。由10个电子结合成的有5个原子核的分子是________。
例
【解析】 掌握前10号元素的电子排布情况,由原子结构和形成分子的原子数目推导常见的分子微粒。
【答案】 (1)H2 (2)CO2 (3)NH3 (4)O3
(5)HF CH4
第1课时 原子核外电子的排布
第1课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
1.原子结构示意图
1.11Na和11Na+、16S和16S2-的核外电子排布有何不同?
【提示】 各粒子结构示意图如下所示:
思考感悟
低
高
2.电子层
(1)概念:原子核外电子运动的不同区域。
(2)表示符号、能量高低和离核远近
电子层n 1 2 3 4 5 6 7
表示符号 K L M N O P Q
能量高低 由_____到______
离核远近 由_______到_____
近
远
3.原子核外电子的排布规律
(1)电子尽量先排布在能量_______的电子层里。
(2)各电子层最多能容纳_______个电子(n为电子层数)。
(3)最外层电子数不超过_____个(当K层为最外层时不超过____个)。
(4)次外层电子数不超过_____个。
最低
2n2
8
2
18
2.(1)稀有气体元素的原子核外电子层K、L、M、N层最多能容纳的电子数分别为多少?
(2)若假设某元素原子核外有7个电子层,则P电子层最多容纳的电子数为多少?
【提示】 (1)2、8、18、32。 (2)P电子层为第6层,最多可以容纳2×62=72个电子,但是此时P层是次外层,所以P层最多容纳18个电子。
思考感悟
1.某化合物XY2的Y-的粒子结构示意图可能是
( )
答案:D
自主体验
2.下列离子中,电子数大于质子数且质子数大于中子数的是( )
A.D3O+ B.Li+
C.OD- D.OH-
答案:D
答案:B
课堂互动讲练
核外电子排布的规律
1.能量最低原理
原子核外电子总是先排布在能量最低的电子层,然后由里向外,依次排布在能量逐步升高的电子层
(能量最低原理),即排满了K层才排L层,排满了L层才排M层。
2.原子核外各电子层最多容纳2n2个电子。
3.原子最外层电子数目不超过8个(K层为最外层时不超过2个)。
4.次外层最多能容纳的电子数目不超过18个,倒数第三层不超过32个。
特别提醒:(1)核外电子排布的规律是相互联系的,不能孤立地理解,如当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,最多可以排布8个电子。
(2)电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为:
。
例1
【解析】 根据核外电子排布规律,最外层不超过8个电子,而K层最多可容纳2个电子,L层最多可容纳8个电子,M层最多可容纳18个电子。当n层为最外层时,最多可容纳8个电子,而第(n-1)层最多可容纳8个电子应为L层;当n为次外层时,其最多容纳的电子数比(n-1)层多10个,则证明(n-1)层不是K层,而是L层,则n层为M层。
【答案】 C
解析:选B。根据核外电子排布规律可知,A正确;当M为最外层时可能的电子数为1~8,而此时的L层电子数为8个,B不正确;只有一个电子层,即为K层,最多只能容纳2个电子,C正确;1~18号元素只有He、Ne两种元素原子核外电子排布满足此要求,D正确。
具有相同电子层排布的微粒
1.具有相同电子层排布的微粒的含义:电子层数相同,各层电子数也相同的单个原子或离子。
2.与He原子具有相同电子层排布的微粒(2电子微粒):
阴离子 原子 阳离子 电子层排布
H- He Li+ Be2+
3.与Ne原子具有相同电子层排布的微粒(10电子微粒):
阴离子 原子 阳离子 电子层排布
N3- O2- F- Ne Na+ Mg2+
Al3+
4.与Ar原子具有相同电子层排布的微粒(18电子微粒):
阴离子 原子 阳离子 电子层排布
P3- S2- Cl- Ar K+ Ca2+
例2
(2011年浙江杭州高一调研)已知aXm+和bYn-两种离子的电子层结构相同,则a等于( )
A.b+m+n B.b+m-n
C.b-m+n D.b-m-n
【解析】 aX核外有a个电子,aXm+核外有(a-m)个电子;bY核外有b个电子,bYn-核外有(b+n)个电子,所以有a-m=b+n,即a=b+m+n。
【答案】 A
变式训练2 设A、B、C代表三种元素。已知①
A+和B-两种离子具有相同的电子层结构;②C元素原子核内质子数比B元素原子核内质子数少9个;③B和C两种元素可形成4核42个电子的负一价阴离子。据此,请填空:
(1)B元素是________,C元素是________(填元素符号)。
(2)由A、B、C三种元素所形成的含68个电子的盐类化合物的化学式是________。
答案:(1)Cl O (2)KClO4
探究整合应用
短周期元素粒子的特殊性
核电荷数为1~18的元素原子核外电子层结构的特殊性:
(1)原子中无中子的原子:1H。
(2)最外层电子数等于次外层电子数一半的元素:Li、Si。
(3)最外层电子数等于次外层电子数的元素:Be、Ar。
(4)最外层电子数等于次外层电子数2倍的元素:C。
(5)最外层电子数等于次外层电子数3倍的元素:O。
(6)最外层电子数等于次外层电子数4倍的元素:Ne。
(7)最外层有1个电子的元素:H、Li、Na。
(8)最外层有2个电子的元素:He、Be、Mg。
(9)电子层数与最外层电子数相等的元素:H、
Be、Al。
(10)电子总数为最外层电子数2倍的元素:Be。
(11)内层电子总数是最外层电子数2倍的元素:
Li、P。
下列各题中的物质均由核电荷数为1~10的元素组成。请填写化学式:
(1)只有两个原子核和两个电子组成的分子是________。
(2)1个最外层有4个电子的原子和2个最外层有6个电子的原子结合成的分子是________。
(3)1个L层有5个电子的原子和3个只有1个电子的原子结合成的分子是________。
(4)由3个最外层是6个电子的原子结合而成的分子是________。
(5)由10个电子结合成的双核分子是________。由10个电子结合成的有5个原子核的分子是________。
例
【解析】 掌握前10号元素的电子排布情况,由原子结构和形成分子的原子数目推导常见的分子微粒。
【答案】 (1)H2 (2)CO2 (3)NH3 (4)O3
(5)HF CH4
