2011年高一化学精品课件:1.2.2 共价键 分子间作用力(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:1.2.2 共价键 分子间作用力(苏教版必修2) |  | |
| 格式 | rar | ||
| 文件大小 | 555.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 16:17:42 | ||
图片预览








文档简介
(共38张PPT)
第2课时 共价键 分子间作用力
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、共价键
1.共价键
(1)概念:原子间通过______________所形成的强烈的相互作用。
(2)形成过程:两种_______元素相互化合时,原子间共用_________的电子,形成____________,以达到________的电子层结构,_____________同时受到两个原子核的吸引。
共用电子对
非金属
最外层上
共用电子对
稳定
共用电子对
2.共价化合物
分子中直接相邻的原子间均以___________相结合的化合物。
思考感悟
1.为什么氯气是双原子分子?
【提示】 氯原子最外层有7个电子,只需要结合1个电子即可达到稳定结构,两个氯原子之间恰好形成一对共用电子对使2个氯原子核外电子均达到稳定结构,所以氯气是双原子分子。
共价键
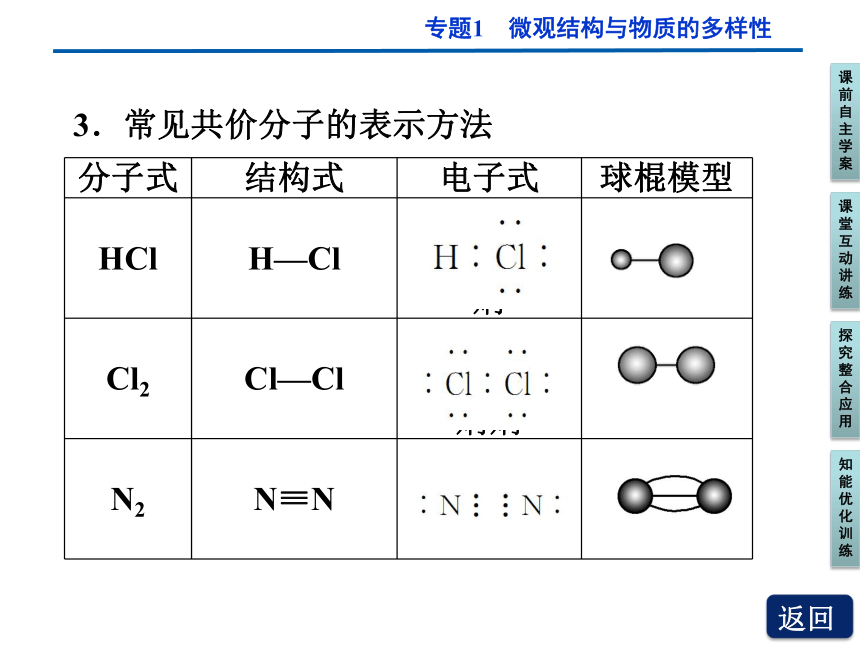
3.常见共价分子的表示方法
分子式 结构式 电子式 球棍模型
HCl H—Cl
?
Cl2 Cl—Cl
??
N2 N≡N
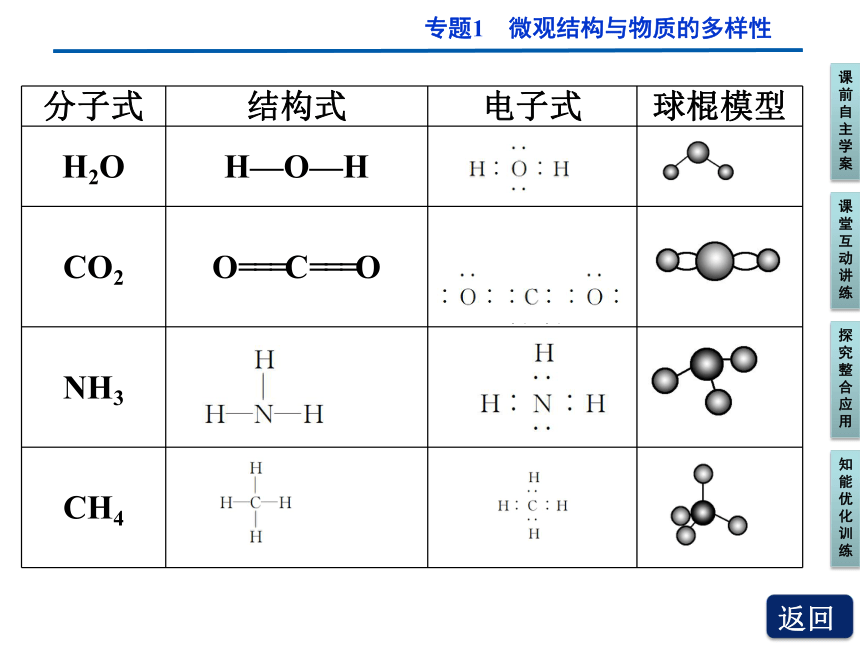
分子式 结构式 电子式 球棍模型
H2O H—O—H
CO2 O===C===O
??
NH3
CH4
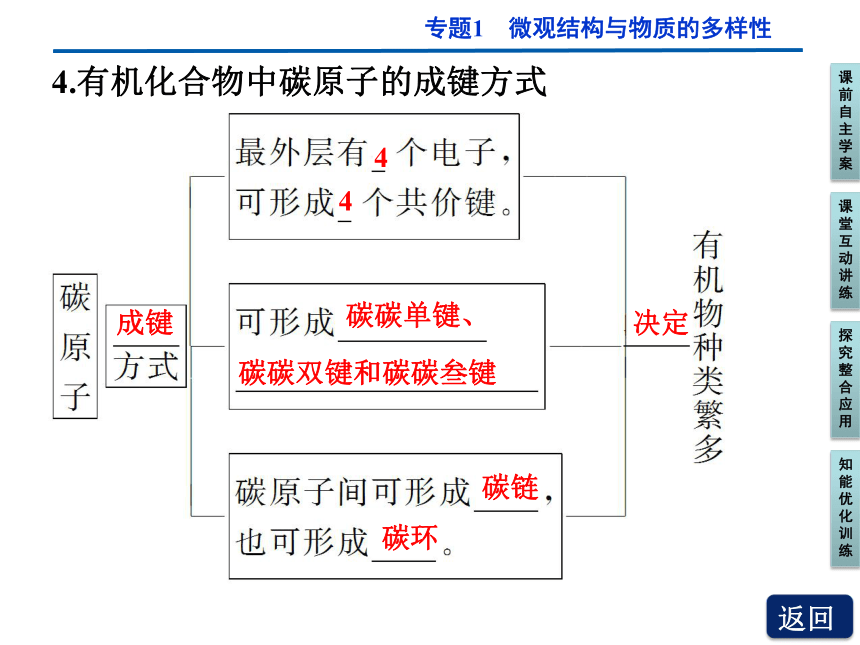
4.有机化合物中碳原子的成键方式
成键
4
4
碳碳单键、
碳碳双键和碳碳叁键
碳链
碳环
决定
二、分子间作用力
1.分子间作用力
(1)概念:将分子______________的作用力。
(2)特点:比化学键____得多。
(3)对物质性质的影响
分子间作用力影响由分子构成物质的__________和___________。
聚集在一起
弱
熔、沸点
溶解性
2.分子间作用力对物质性质有何影响?
【提示】 分子间作用力对物质熔、沸点有很大的影响,一般来说,分子之间的作用力越强,由分子构成的物质的熔、沸点越高,但同时也会受氢键的影响。例如:H2O和H2S,由于H2O分子之间存在着氢键,使H2O的熔、沸点比H2S高;还有NH3、HF,由于其分子之间也存在着氢键,使NH3的熔、沸点比PH3高,HF的熔、沸点比HI、HBr、HCl都高。同时氢键的存在使物质的溶解性增大,例如:NH3极易溶于水。
思考感悟
2.氢键
存在于某些氢化物分子(如H2O)之间的较强的作用。
思考感悟
3.哪些物质含有氢键?
【提示】 含有氢键必须有氢原子与原子半径较小非金属性较强的原子如F、O、N。常见的含有氢键的物质有HF、H2O、NH3等。
1.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.酒精溶于水 D.HCl气体溶于水
答案:D
自主体验
2.下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
答案:B
3.下列物质中,不存在化学键的是( )
A.食盐 B.氯气
C.氦气 D.氨气
答案:C
课堂互动讲练
化学键
1.离子键、共价键的比较
离子键 共价键
概念 阴、阳离子间通过静电作用所形成的化学键 原子间通过共用电子对所形成的化学键
成键微粒 阴、阳离子 原子
成键元素 活泼金属元素和活泼非金属元素(铵盐除外) 大多数为非金属元素
离子键 共价键
成键实质 阴、阳离子间的电性作用 共用电子对两原子核产生的电性作用
影响因素 离子半径、离子电荷 原子半径和共用电子对数
形成过程 NaCl的形成过程如下:
HCl的形成过程如下:
存在范围 活泼金属氧化物、强碱、大多数盐 多数非金属单质、共价化合物及部分离子化合物
实例 CaCl2、Na2O2、NaOH Cl2、CCl4、NaHCO3
2.化学键的存在
(1)构成稀有气体的单质分子,由于原子已形成稳定结构,在这些单原子分子中不存在化学键。
(2)在离子化合物中一定含有离子键,可能含有共价键。如K2O2、NaOH、NH4Cl等离子化合物中既有离子键又有共价键。
(3)在共价化合物中一定不存在离子键。
(4)离子化合物不一定都由金属元素和非金属元素组成。例如NH4Cl、NH4NO3等离子化合物中不含金属元素,只含非金属元素。
例1
【解析】 离子化合物是阴、阳离子通过离子键结合而成的,因此,离子化合物中一定含有离子键,除离子键外,离子化合物中还可能含共价键,如NaOH是由Na+和OH-结合而成的离子化合物,而OH-中含O—H共价键;在共价化合物中各原子均靠共用电子对相结合,不存在离子键,故A项错误,B项错误。稀有气体分子中不存在化学键,C项错误。在离子化合物中除阴、阳离子电荷之间的静电引力外,还存在电子与电子、原子核与原子核之间的排斥力,D项正确。
【答案】 D
【规律方法】 解答本题关键需弄清几组概念:共价键与离子键,共价化合物与离子化合物;同时弄清化学键类型与物质类别的关系。
变式训练1 下列既含有离子键又含有共价键的化合物是( )
A.HCl B.Na2O2
C.C2H2 D.CH4
解析:选B。本题主要考查学生对化学键、共价化合物、离子化合物等概念及其相互关系的理解。Na2O2是含有共价键的离子化合物,而HCl、C2H2、CH4均属于共价化合物,只含共价键。
用电子式表示共价化合物(单质)及其形成过程
1.用电子式表示共价型分子
如H2、N2、NH3、CO2等分子的电子式为:
2.用电子式表示共价化合物的形成过程
H2O分子和CH4分子的形成过程为:
例2
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含的中子数为8
B.NH3的结构式为
C.HCl的电子式为H+
D.热稳定性:H2S>HF
【解析】 A项中1个D有1个中子,1个O有8个中子,所以1个D2O所含中子数为10个。C项中HCl为共价化合物,电子式不标电荷。D中非金属性F>S,稳定性HF>H2S。
【答案】 B
变式训练2 下列电子式书写错误的是________
(填序号)。
解析:本题考查了电子式的书写,书写电子式时一定要注意把电子写全,阴离子及复杂阳离子的电子式不要漏掉方括号及所带电荷(与化合价区分开),且每个离子要单独写,而不能用角码合并在一起表示。
答案:②⑤⑥⑦
化学键、分子间作用力及氢键的区别
化学键 分子间作用力 氢键
范围 相邻的原子或离子间 分子间 某些氢化物分子间(常见的有HF、H2O、NH3等)
作用力 化学键>氢键>分子间作用力
对物质性质的影响 物质的物理性质及化学性质 物质的熔、沸点及溶解性 物质的熔、沸点
特别提醒:(1)分子的稳定性是由化学键的强弱决定的,化学键越强,分子越稳定。
(2)分子间氢键的存在,可以使熔、沸点升高,如图(见下页)中NH3、HF和H2O的沸点与同主族元素氢化物相比反常。
有四种同族的物质,它们的沸点(p=1.01×
105 Pa)如表所示:
例3
① He
-268.8 Ne
-249.5 Ar
-185.7 Kr
-151.7
② F2
-187.0 Cl2
-33.6 (a)
58.7 I2
184.0
③ HF
19.5 HCl
-84.0 HBr
-67.0 HI
-35.3
④ H2O
100 H2S
-60.2 (b)
-42.0 H2Te
-1.8
试根据上表回答下列问题:
(1)常温下,a为________色液体;b的分子式为:________。
(2)写出②系列中物质主要化学性质的递变规律________(任写一种)。
(3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是________________________________________________________________________。
(4)上表中,________和________两种物质的沸点较同系列其他物质反常,反常的主要原因是_______________________________________。
【思路点拨】 解答本题要明确如下三点:
(1)各组物质组成和结构的特点。
(2)各组物质沸点的总体变化趋势及其原因。
(3)沸点变化反常的物质及其原因。
【解析】 表中所给的是四种同族元素的单质和气态氢化物的沸点,同主族非金属元素的性质随着原子序数的递增,单质的氧化性越来越弱,氢化物的稳定性越来越弱,最高价氧化物对应的水化物的酸性越来越弱。同族非金属元素的单质和气态氢化物的组成和结构相似,随着原子序数的递增,相对分子质量逐渐增大,分子间作用力逐渐增大,熔、沸点逐渐升高。但是HF、H2O分子中含有氢键,使沸点反常的高。
【答案】 (1)深红棕 H2Se
(2)单质的氧化性越来越弱或氢化物的稳定性越来越弱(或其他合理答案)
(3)相对分子质量越大,熔、沸点越高
(4)HF H2O 分子间含有氢键,所以熔、沸点较高
变式训练3 判断物质在下列变化过程中克服的微粒之间的作用力:
(1)水的汽化;(2)甲烷在高温下受热分解生成炭黑和氢气;(3)氯化镁熔化;(4)干冰升华。
解析:水受热汽化变成水蒸气,水分子的结构没有遭到破坏,只是分子热运动加剧,分子间距离变大,克服的作用力是分子间作用力;甲烷在高温下受热分解,需要克服CH4中的C—H键才能生成炭黑和氢气,因此破坏的是共价键;氯化镁受热熔化,其构成微粒氯离子和镁离子的热运动加剧,破坏的是离子键;干冰升华变成二氧化碳气体,二氧化碳分子的结构没有遭到破坏,分子热运动加剧,分子间距离变大,克服的作用力是分子间作用力。
答案:(1)分子间作用力 (2)共价键 (3)离子键
(4)分子间作用力
探究整合应用
化学键与分子间作用力的区别与联系
化学键 分子间作用力
概念 直接相邻的原子或离子之间强烈的相互作用 物质的分子间存在的微弱的相互作用
范围 分子内、复杂离子内 分子之间
能量 键能120~800 kJ·mol-1 几至数十几 kJ·mol-1
性质影响 主要影响物质的化学性质 主要影响物质的物理性质
联系 都属于化学作用力
离子键、共价键、分子间作用力都是构成物质微粒间的不同作用力,含有以上所说的两种不同作用力的固体是(双选)( )
A.SiO2 B.NaCl
C.CCl4 D.KOH
【解析】 SiO2中只含有Si—O共价键;NaCl中只含有离子键;CCl4分子内含有C—Cl共价键,CCl4分子间以分子间作用力结合在一起;KOH中含有离子键和共价键。
【答案】 CD
例
第2课时 共价键 分子间作用力
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、共价键
1.共价键
(1)概念:原子间通过______________所形成的强烈的相互作用。
(2)形成过程:两种_______元素相互化合时,原子间共用_________的电子,形成____________,以达到________的电子层结构,_____________同时受到两个原子核的吸引。
共用电子对
非金属
最外层上
共用电子对
稳定
共用电子对
2.共价化合物
分子中直接相邻的原子间均以___________相结合的化合物。
思考感悟
1.为什么氯气是双原子分子?
【提示】 氯原子最外层有7个电子,只需要结合1个电子即可达到稳定结构,两个氯原子之间恰好形成一对共用电子对使2个氯原子核外电子均达到稳定结构,所以氯气是双原子分子。
共价键
3.常见共价分子的表示方法
分子式 结构式 电子式 球棍模型
HCl H—Cl
?
Cl2 Cl—Cl
??
N2 N≡N
分子式 结构式 电子式 球棍模型
H2O H—O—H
CO2 O===C===O
??
NH3
CH4
4.有机化合物中碳原子的成键方式
成键
4
4
碳碳单键、
碳碳双键和碳碳叁键
碳链
碳环
决定
二、分子间作用力
1.分子间作用力
(1)概念:将分子______________的作用力。
(2)特点:比化学键____得多。
(3)对物质性质的影响
分子间作用力影响由分子构成物质的__________和___________。
聚集在一起
弱
熔、沸点
溶解性
2.分子间作用力对物质性质有何影响?
【提示】 分子间作用力对物质熔、沸点有很大的影响,一般来说,分子之间的作用力越强,由分子构成的物质的熔、沸点越高,但同时也会受氢键的影响。例如:H2O和H2S,由于H2O分子之间存在着氢键,使H2O的熔、沸点比H2S高;还有NH3、HF,由于其分子之间也存在着氢键,使NH3的熔、沸点比PH3高,HF的熔、沸点比HI、HBr、HCl都高。同时氢键的存在使物质的溶解性增大,例如:NH3极易溶于水。
思考感悟
2.氢键
存在于某些氢化物分子(如H2O)之间的较强的作用。
思考感悟
3.哪些物质含有氢键?
【提示】 含有氢键必须有氢原子与原子半径较小非金属性较强的原子如F、O、N。常见的含有氢键的物质有HF、H2O、NH3等。
1.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.酒精溶于水 D.HCl气体溶于水
答案:D
自主体验
2.下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
答案:B
3.下列物质中,不存在化学键的是( )
A.食盐 B.氯气
C.氦气 D.氨气
答案:C
课堂互动讲练
化学键
1.离子键、共价键的比较
离子键 共价键
概念 阴、阳离子间通过静电作用所形成的化学键 原子间通过共用电子对所形成的化学键
成键微粒 阴、阳离子 原子
成键元素 活泼金属元素和活泼非金属元素(铵盐除外) 大多数为非金属元素
离子键 共价键
成键实质 阴、阳离子间的电性作用 共用电子对两原子核产生的电性作用
影响因素 离子半径、离子电荷 原子半径和共用电子对数
形成过程 NaCl的形成过程如下:
HCl的形成过程如下:
存在范围 活泼金属氧化物、强碱、大多数盐 多数非金属单质、共价化合物及部分离子化合物
实例 CaCl2、Na2O2、NaOH Cl2、CCl4、NaHCO3
2.化学键的存在
(1)构成稀有气体的单质分子,由于原子已形成稳定结构,在这些单原子分子中不存在化学键。
(2)在离子化合物中一定含有离子键,可能含有共价键。如K2O2、NaOH、NH4Cl等离子化合物中既有离子键又有共价键。
(3)在共价化合物中一定不存在离子键。
(4)离子化合物不一定都由金属元素和非金属元素组成。例如NH4Cl、NH4NO3等离子化合物中不含金属元素,只含非金属元素。
例1
【解析】 离子化合物是阴、阳离子通过离子键结合而成的,因此,离子化合物中一定含有离子键,除离子键外,离子化合物中还可能含共价键,如NaOH是由Na+和OH-结合而成的离子化合物,而OH-中含O—H共价键;在共价化合物中各原子均靠共用电子对相结合,不存在离子键,故A项错误,B项错误。稀有气体分子中不存在化学键,C项错误。在离子化合物中除阴、阳离子电荷之间的静电引力外,还存在电子与电子、原子核与原子核之间的排斥力,D项正确。
【答案】 D
【规律方法】 解答本题关键需弄清几组概念:共价键与离子键,共价化合物与离子化合物;同时弄清化学键类型与物质类别的关系。
变式训练1 下列既含有离子键又含有共价键的化合物是( )
A.HCl B.Na2O2
C.C2H2 D.CH4
解析:选B。本题主要考查学生对化学键、共价化合物、离子化合物等概念及其相互关系的理解。Na2O2是含有共价键的离子化合物,而HCl、C2H2、CH4均属于共价化合物,只含共价键。
用电子式表示共价化合物(单质)及其形成过程
1.用电子式表示共价型分子
如H2、N2、NH3、CO2等分子的电子式为:
2.用电子式表示共价化合物的形成过程
H2O分子和CH4分子的形成过程为:
例2
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含的中子数为8
B.NH3的结构式为
C.HCl的电子式为H+
D.热稳定性:H2S>HF
【解析】 A项中1个D有1个中子,1个O有8个中子,所以1个D2O所含中子数为10个。C项中HCl为共价化合物,电子式不标电荷。D中非金属性F>S,稳定性HF>H2S。
【答案】 B
变式训练2 下列电子式书写错误的是________
(填序号)。
解析:本题考查了电子式的书写,书写电子式时一定要注意把电子写全,阴离子及复杂阳离子的电子式不要漏掉方括号及所带电荷(与化合价区分开),且每个离子要单独写,而不能用角码合并在一起表示。
答案:②⑤⑥⑦
化学键、分子间作用力及氢键的区别
化学键 分子间作用力 氢键
范围 相邻的原子或离子间 分子间 某些氢化物分子间(常见的有HF、H2O、NH3等)
作用力 化学键>氢键>分子间作用力
对物质性质的影响 物质的物理性质及化学性质 物质的熔、沸点及溶解性 物质的熔、沸点
特别提醒:(1)分子的稳定性是由化学键的强弱决定的,化学键越强,分子越稳定。
(2)分子间氢键的存在,可以使熔、沸点升高,如图(见下页)中NH3、HF和H2O的沸点与同主族元素氢化物相比反常。
有四种同族的物质,它们的沸点(p=1.01×
105 Pa)如表所示:
例3
① He
-268.8 Ne
-249.5 Ar
-185.7 Kr
-151.7
② F2
-187.0 Cl2
-33.6 (a)
58.7 I2
184.0
③ HF
19.5 HCl
-84.0 HBr
-67.0 HI
-35.3
④ H2O
100 H2S
-60.2 (b)
-42.0 H2Te
-1.8
试根据上表回答下列问题:
(1)常温下,a为________色液体;b的分子式为:________。
(2)写出②系列中物质主要化学性质的递变规律________(任写一种)。
(3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是________________________________________________________________________。
(4)上表中,________和________两种物质的沸点较同系列其他物质反常,反常的主要原因是_______________________________________。
【思路点拨】 解答本题要明确如下三点:
(1)各组物质组成和结构的特点。
(2)各组物质沸点的总体变化趋势及其原因。
(3)沸点变化反常的物质及其原因。
【解析】 表中所给的是四种同族元素的单质和气态氢化物的沸点,同主族非金属元素的性质随着原子序数的递增,单质的氧化性越来越弱,氢化物的稳定性越来越弱,最高价氧化物对应的水化物的酸性越来越弱。同族非金属元素的单质和气态氢化物的组成和结构相似,随着原子序数的递增,相对分子质量逐渐增大,分子间作用力逐渐增大,熔、沸点逐渐升高。但是HF、H2O分子中含有氢键,使沸点反常的高。
【答案】 (1)深红棕 H2Se
(2)单质的氧化性越来越弱或氢化物的稳定性越来越弱(或其他合理答案)
(3)相对分子质量越大,熔、沸点越高
(4)HF H2O 分子间含有氢键,所以熔、沸点较高
变式训练3 判断物质在下列变化过程中克服的微粒之间的作用力:
(1)水的汽化;(2)甲烷在高温下受热分解生成炭黑和氢气;(3)氯化镁熔化;(4)干冰升华。
解析:水受热汽化变成水蒸气,水分子的结构没有遭到破坏,只是分子热运动加剧,分子间距离变大,克服的作用力是分子间作用力;甲烷在高温下受热分解,需要克服CH4中的C—H键才能生成炭黑和氢气,因此破坏的是共价键;氯化镁受热熔化,其构成微粒氯离子和镁离子的热运动加剧,破坏的是离子键;干冰升华变成二氧化碳气体,二氧化碳分子的结构没有遭到破坏,分子热运动加剧,分子间距离变大,克服的作用力是分子间作用力。
答案:(1)分子间作用力 (2)共价键 (3)离子键
(4)分子间作用力
探究整合应用
化学键与分子间作用力的区别与联系
化学键 分子间作用力
概念 直接相邻的原子或离子之间强烈的相互作用 物质的分子间存在的微弱的相互作用
范围 分子内、复杂离子内 分子之间
能量 键能120~800 kJ·mol-1 几至数十几 kJ·mol-1
性质影响 主要影响物质的化学性质 主要影响物质的物理性质
联系 都属于化学作用力
离子键、共价键、分子间作用力都是构成物质微粒间的不同作用力,含有以上所说的两种不同作用力的固体是(双选)( )
A.SiO2 B.NaCl
C.CCl4 D.KOH
【解析】 SiO2中只含有Si—O共价键;NaCl中只含有离子键;CCl4分子内含有C—Cl共价键,CCl4分子间以分子间作用力结合在一起;KOH中含有离子键和共价键。
【答案】 CD
例
