2011年高一化学精品课件:1.3.2 不同类型的晶体(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:1.3.2 不同类型的晶体(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 276.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 00:00:00 | ||
图片预览










文档简介
(共30张PPT)
第2课时 不同类型的晶体
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、晶体
1.晶体的特点
(1)具有______________的固态物质。
(2)在晶体内部,构成晶体的微粒在空间呈_______
_____________排列。
(3)具有_________的熔、沸点。
2.晶体的构成微粒:离子、分子和原子。
规则几何外形
有规
则的重复
固定
3.晶体的分类:离子晶体、分子晶体、原子晶体和________晶体。
4.晶体与非晶体的区别
金属
特点 晶体 非晶体
外形 规则的几何外形 不规则
熔点 有固定熔点 没有固定熔点
二、离子晶体
1.概念:离子化合物中的____________按照一定的方式__________地排列形成的晶体。
2.性质:
(1)熔点________、硬度________。
(2)固态时不导电,在___________下或水溶液中能够导电。
三、分子晶体
1.概念:由分子以分子间作用力相结合并按一定的方式有规则排列所形成的晶体。
2.性质:熔、沸点______、硬度_____,______导电。
阴、阳离子
有规则
较高
较大
熔融状态
较低
较小
不能
四、原子晶体
1.概念:原子间以共价键结合并以一定的方式有规则排列成空间_____________的晶体。
2.石英晶体结构
石英晶体中,每个硅原子与周围的__个氧原子以共价键结合,每个氧原子与周围____个硅原子以共价键结合,向空间伸展,形成彼此连接的___________结构。故在石英晶体中不存在单个的SiO2分子。
3.性质:熔点____、硬度______,_______导电。
网状结构
4
2
空间网状
高
大
不能
五、金属晶体
1.概念:金属阳离子和_____________通过强烈的作用结合形成的晶体。
2.性质:有_______光泽、能______、______,具有____________等。
自由电子
金属
导电
传热
延展性
在晶体中有阴离子一定有阳离子吗?有阳离子一定有阴离子吗?
【提示】 因为晶体都是电中性的,带有正电荷的微粒只有阳离子,而带有负电荷的微粒除了阴离子外,还有电子。所以在晶体中有阴离子一定有阳离子,但是有阳离子不一定有阴离子,如金属晶体是由金属阳离子和自由电子结合成的,其中没有阴离子。
思考感悟
答案:D
自主体验
2.下列叙述正确的是( )
A.分子晶体中一定存在共价键
B.离子晶体中一定含有金属元素
C.原子晶体中一定不存在分子
D.晶体中有阳离子必有阴离子
答案:C
3.某物质熔融状态可以导电,固态也可以导电,将其投入水中后所得的溶液也可以导电,则该物质可能是( )
A.金属单质 B.非金属单质
C.离子晶体 D.分子晶体
答案:A
课堂互动讲练
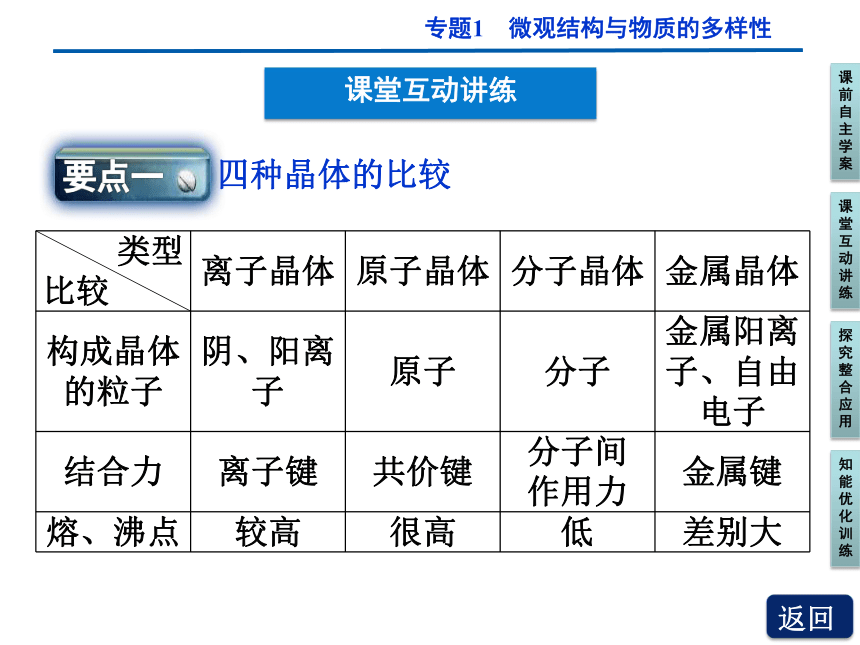
四种晶体的比较
类型
比较 离子晶体 原子晶体 分子晶体 金属晶体
构成晶体
的粒子 阴、阳离子 原子 分子 金属阳离
子、自由
电子
结合力 离子键 共价键 分子间
作用力 金属键
熔、沸点 较高 很高 低 差别大
类型
比较 离子晶体 原子晶体 分子晶体 金属晶体
硬度 硬而脆 大 小 差别大
导电性 不良(熔融
态或水溶
液导电) 绝缘体
(晶体硅为
半导体) 不良 导电
传热性 不良 不良 不良 良
延展性 不良 不良 不良 良
实例 NaCl 单质:金刚石、晶体硅化合物:二氧化硅、碳化硅 H2、Ne、
冰、干冰 Fe、Na
例1
现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550 Li:181 HF:-83 NaCl:801
晶体硅:1410 Na:98 HCl:-115 KCl:776
晶体硼:2300 K:64 HBr:-89 RbCl:718
二氧化硅:1723 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。
(2)B组晶体共同的物理性质是________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于________________________________________________________________________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电
③固体能导电 ④熔融状态能导电
【解析】 通过读取表格中数据先判断出晶体的类型及晶体的性质,应用氢键解释HF的熔点反常。
【答案】 (1)原子 共价键 (2)①②③④
(3)HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可)
(4)②④
变式训练1 下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A.SO2和SiO2 B.CO2和H2
C.NaCl和HCl D.CCl4和KCl
解析:选B。首先根据化学键、晶体结构等判断出各自晶体类型。A都是共价键,但晶体类型不同;B均是含共价键的分子晶体,符合题意;C中NaCl为离子晶体,HCl为分子晶体;D中CCl4含共价键,KCl含离子键,晶体类型也不同。
物质熔、沸点高低的比较
1.对于晶体类型不同的物质,一般来讲:原子晶体>离子晶体>分子晶体,而金属晶体的熔点范围很广。
2.原子晶体:原子晶体原子间键长越短、键的强度越大,共价键越稳定,物质熔、沸点越高,反之越低。如:金刚石(C—C)>碳化硅(Si—C)>晶体(Si—Si)。
3.离子晶体:离子晶体中阴、阳离子半径越小,电荷数越多,则离子键越强,熔、沸点越高,反之越低。如KF>KCl>KBr>KI。
4.金属晶体:金属晶体中金属原子的价电子数越
多,原子半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔、沸点越高,反之越低。如:Na合金的熔、沸点一般来说比它各成分纯金属的熔、沸点低。如铝硅合金<纯铝(或纯硅)。
5.分子晶体:分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低。(具有氢键的分子晶体,熔、沸点反常地高)如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3OCH3。
组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。如:CH4例2
下列各组物质中,按熔点由低到高顺序排列正确的是
A.O2、I2、Hg B.CO、KCl、SiO2
C.H2O、H2S、H2Se D.SiC、NaCl、SO2
【解析】 A中的O2是气体、I2是固体、Hg是液体,所以熔点:I2>Hg>O2;B中的CO固态时为分子晶体,KCl是离子晶体、SiO2 是原子晶体,所以熔点:CO【答案】 B
【规律方法】 比较物质熔、沸点的高低,应首先看物质的状态,熔点:固体>液体>气体。同种状态时再看晶体类型,对于不同的晶体,其熔、沸点高低顺序一般为:原子晶体>离子晶体>分子晶体。对于相同类型的晶体,要分清影响熔、沸点的作用力及影响作用力大小的因素,即可顺利作答。
变式训练2 下列物质性质的变化规律,与共价键的强弱有关的是(双选)( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
解析:选BC。F2、Cl2、Br2、I2形成的晶体属
于分子晶体,它们的熔、沸点高低决定于分子间的作用力,与共价键的强弱无关,A错;HF、HCl、HBr、HI的分子内存在共价键,它们的热稳定性与它们内部存在的共价键的强弱有关,B正确;金刚石和晶体硅都是原子间通过共价键结合而成的原子晶体,其熔、沸点高低,决定于共价键的强弱,C正确;NaF、NaCl、NaBr、NaI都是由离子键形成的离子晶体,其内无共价键,D错。
探究整合应用
四种晶体类型的判断方法
1.依据晶体的组成微粒和微粒间的相互作用判断
(1)阴、阳离子~离子键―→离子晶体
(2)原子~共价键―→原子晶体
(3)分子~分子间作用力―→分子晶体
(4)金属阳离子、自由电子~金属键―→金属晶体
注意:应用上述概念时要注意分析组成微粒与
微粒间的相互作用,不要依据周期表去推断,如干冰(CO2)是分子晶体,而石英(SiO2)则是原子晶体;稀有气体虽由单原子(实质上可认为单原子分子)组成,但使其聚集在一起的相互作用不是共价键,而是分子间作用力,因此仍为分子晶体。
2.依据物质的类别判断
(1)金属氧化物、强碱、绝大多数的盐类是离子晶体。
(2)大多数非金属单质、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)金刚石、晶体硅、碳化硅(SiC)、二氧化硅等是原子晶体。
(4)金属单质与合金是金属晶体。
3.依据晶体的熔点判断
(1)离子晶体的熔点较高,常在几百至1000多摄氏度。
(2)原子晶体熔点高,常在1000度至几千摄氏度。
(3)分子晶体熔点低,常在几百度以下至很低温度。
(4)金属晶体多数熔点高,部分较低,如汞常温下为液态。
4.依据导电性判断
(1)离子晶体溶于水及熔融状态时能导电
(2)原子晶体一般不导电。
(3)分子晶体不导电。
(4)金属晶体是电的良导体。
注意:导电性实验是判断晶体类型比较简单的方法。离子晶体固态时不导电,但熔化状态下能够导电,在水中溶解度较大的离子晶体,其水溶液也能导电;分子晶体固态或熔化状态下均不能导电,但有的电解质分子晶体的水溶液也能导电(如HCl);原子晶体难溶于水,通常情况下其固态不能导电(石墨有人称是原子晶体、分子晶体和金属晶体之间的一种过渡型,能传热导电);金属晶体固态或熔化状态下均能导电。
故晶体在固态以及熔化状态下能否导电,较容易区别离子晶体、分子晶体、金属晶体。若晶体的水溶液能够导电,该晶体不一定是离子晶体。原子晶体中,硅、碳化硅具有半导体的性质,可以有条件地导电。
5.依据硬度和机械性能判断
(1)离子晶体硬度较大或略硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小且较脆。
(4)金属晶体多数硬度大,且具有延展性。
下列数据是对应物质的熔点
据此做出的下列判断中错误的是( )
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
例
物质 Na2O NaCl AlF3 AlCl3 BCl3 Al2O3 CO2 SiO2
熔点/℃ 920 801 1291 190 -107 2073 -57 1723
【解析】 从表中物质的熔点推测Na2O、NaCl、AlF3是离子晶体,AlCl3、BCl3、CO2是分子晶体。
【答案】 B
第2课时 不同类型的晶体
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、晶体
1.晶体的特点
(1)具有______________的固态物质。
(2)在晶体内部,构成晶体的微粒在空间呈_______
_____________排列。
(3)具有_________的熔、沸点。
2.晶体的构成微粒:离子、分子和原子。
规则几何外形
有规
则的重复
固定
3.晶体的分类:离子晶体、分子晶体、原子晶体和________晶体。
4.晶体与非晶体的区别
金属
特点 晶体 非晶体
外形 规则的几何外形 不规则
熔点 有固定熔点 没有固定熔点
二、离子晶体
1.概念:离子化合物中的____________按照一定的方式__________地排列形成的晶体。
2.性质:
(1)熔点________、硬度________。
(2)固态时不导电,在___________下或水溶液中能够导电。
三、分子晶体
1.概念:由分子以分子间作用力相结合并按一定的方式有规则排列所形成的晶体。
2.性质:熔、沸点______、硬度_____,______导电。
阴、阳离子
有规则
较高
较大
熔融状态
较低
较小
不能
四、原子晶体
1.概念:原子间以共价键结合并以一定的方式有规则排列成空间_____________的晶体。
2.石英晶体结构
石英晶体中,每个硅原子与周围的__个氧原子以共价键结合,每个氧原子与周围____个硅原子以共价键结合,向空间伸展,形成彼此连接的___________结构。故在石英晶体中不存在单个的SiO2分子。
3.性质:熔点____、硬度______,_______导电。
网状结构
4
2
空间网状
高
大
不能
五、金属晶体
1.概念:金属阳离子和_____________通过强烈的作用结合形成的晶体。
2.性质:有_______光泽、能______、______,具有____________等。
自由电子
金属
导电
传热
延展性
在晶体中有阴离子一定有阳离子吗?有阳离子一定有阴离子吗?
【提示】 因为晶体都是电中性的,带有正电荷的微粒只有阳离子,而带有负电荷的微粒除了阴离子外,还有电子。所以在晶体中有阴离子一定有阳离子,但是有阳离子不一定有阴离子,如金属晶体是由金属阳离子和自由电子结合成的,其中没有阴离子。
思考感悟
答案:D
自主体验
2.下列叙述正确的是( )
A.分子晶体中一定存在共价键
B.离子晶体中一定含有金属元素
C.原子晶体中一定不存在分子
D.晶体中有阳离子必有阴离子
答案:C
3.某物质熔融状态可以导电,固态也可以导电,将其投入水中后所得的溶液也可以导电,则该物质可能是( )
A.金属单质 B.非金属单质
C.离子晶体 D.分子晶体
答案:A
课堂互动讲练
四种晶体的比较
类型
比较 离子晶体 原子晶体 分子晶体 金属晶体
构成晶体
的粒子 阴、阳离子 原子 分子 金属阳离
子、自由
电子
结合力 离子键 共价键 分子间
作用力 金属键
熔、沸点 较高 很高 低 差别大
类型
比较 离子晶体 原子晶体 分子晶体 金属晶体
硬度 硬而脆 大 小 差别大
导电性 不良(熔融
态或水溶
液导电) 绝缘体
(晶体硅为
半导体) 不良 导电
传热性 不良 不良 不良 良
延展性 不良 不良 不良 良
实例 NaCl 单质:金刚石、晶体硅化合物:二氧化硅、碳化硅 H2、Ne、
冰、干冰 Fe、Na
例1
现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3550 Li:181 HF:-83 NaCl:801
晶体硅:1410 Na:98 HCl:-115 KCl:776
晶体硼:2300 K:64 HBr:-89 RbCl:718
二氧化硅:1723 Rb:39 HI:-51 CsCl:645
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。
(2)B组晶体共同的物理性质是________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于________________________________________________________________________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电
③固体能导电 ④熔融状态能导电
【解析】 通过读取表格中数据先判断出晶体的类型及晶体的性质,应用氢键解释HF的熔点反常。
【答案】 (1)原子 共价键 (2)①②③④
(3)HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可)
(4)②④
变式训练1 下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A.SO2和SiO2 B.CO2和H2
C.NaCl和HCl D.CCl4和KCl
解析:选B。首先根据化学键、晶体结构等判断出各自晶体类型。A都是共价键,但晶体类型不同;B均是含共价键的分子晶体,符合题意;C中NaCl为离子晶体,HCl为分子晶体;D中CCl4含共价键,KCl含离子键,晶体类型也不同。
物质熔、沸点高低的比较
1.对于晶体类型不同的物质,一般来讲:原子晶体>离子晶体>分子晶体,而金属晶体的熔点范围很广。
2.原子晶体:原子晶体原子间键长越短、键的强度越大,共价键越稳定,物质熔、沸点越高,反之越低。如:金刚石(C—C)>碳化硅(Si—C)>晶体(Si—Si)。
3.离子晶体:离子晶体中阴、阳离子半径越小,电荷数越多,则离子键越强,熔、沸点越高,反之越低。如KF>KCl>KBr>KI。
4.金属晶体:金属晶体中金属原子的价电子数越
多,原子半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔、沸点越高,反之越低。如:Na
5.分子晶体:分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低。(具有氢键的分子晶体,熔、沸点反常地高)如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3OCH3。
组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。如:CH4
下列各组物质中,按熔点由低到高顺序排列正确的是
A.O2、I2、Hg B.CO、KCl、SiO2
C.H2O、H2S、H2Se D.SiC、NaCl、SO2
【解析】 A中的O2是气体、I2是固体、Hg是液体,所以熔点:I2>Hg>O2;B中的CO固态时为分子晶体,KCl是离子晶体、SiO2 是原子晶体,所以熔点:CO
【规律方法】 比较物质熔、沸点的高低,应首先看物质的状态,熔点:固体>液体>气体。同种状态时再看晶体类型,对于不同的晶体,其熔、沸点高低顺序一般为:原子晶体>离子晶体>分子晶体。对于相同类型的晶体,要分清影响熔、沸点的作用力及影响作用力大小的因素,即可顺利作答。
变式训练2 下列物质性质的变化规律,与共价键的强弱有关的是(双选)( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
解析:选BC。F2、Cl2、Br2、I2形成的晶体属
于分子晶体,它们的熔、沸点高低决定于分子间的作用力,与共价键的强弱无关,A错;HF、HCl、HBr、HI的分子内存在共价键,它们的热稳定性与它们内部存在的共价键的强弱有关,B正确;金刚石和晶体硅都是原子间通过共价键结合而成的原子晶体,其熔、沸点高低,决定于共价键的强弱,C正确;NaF、NaCl、NaBr、NaI都是由离子键形成的离子晶体,其内无共价键,D错。
探究整合应用
四种晶体类型的判断方法
1.依据晶体的组成微粒和微粒间的相互作用判断
(1)阴、阳离子~离子键―→离子晶体
(2)原子~共价键―→原子晶体
(3)分子~分子间作用力―→分子晶体
(4)金属阳离子、自由电子~金属键―→金属晶体
注意:应用上述概念时要注意分析组成微粒与
微粒间的相互作用,不要依据周期表去推断,如干冰(CO2)是分子晶体,而石英(SiO2)则是原子晶体;稀有气体虽由单原子(实质上可认为单原子分子)组成,但使其聚集在一起的相互作用不是共价键,而是分子间作用力,因此仍为分子晶体。
2.依据物质的类别判断
(1)金属氧化物、强碱、绝大多数的盐类是离子晶体。
(2)大多数非金属单质、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)金刚石、晶体硅、碳化硅(SiC)、二氧化硅等是原子晶体。
(4)金属单质与合金是金属晶体。
3.依据晶体的熔点判断
(1)离子晶体的熔点较高,常在几百至1000多摄氏度。
(2)原子晶体熔点高,常在1000度至几千摄氏度。
(3)分子晶体熔点低,常在几百度以下至很低温度。
(4)金属晶体多数熔点高,部分较低,如汞常温下为液态。
4.依据导电性判断
(1)离子晶体溶于水及熔融状态时能导电
(2)原子晶体一般不导电。
(3)分子晶体不导电。
(4)金属晶体是电的良导体。
注意:导电性实验是判断晶体类型比较简单的方法。离子晶体固态时不导电,但熔化状态下能够导电,在水中溶解度较大的离子晶体,其水溶液也能导电;分子晶体固态或熔化状态下均不能导电,但有的电解质分子晶体的水溶液也能导电(如HCl);原子晶体难溶于水,通常情况下其固态不能导电(石墨有人称是原子晶体、分子晶体和金属晶体之间的一种过渡型,能传热导电);金属晶体固态或熔化状态下均能导电。
故晶体在固态以及熔化状态下能否导电,较容易区别离子晶体、分子晶体、金属晶体。若晶体的水溶液能够导电,该晶体不一定是离子晶体。原子晶体中,硅、碳化硅具有半导体的性质,可以有条件地导电。
5.依据硬度和机械性能判断
(1)离子晶体硬度较大或略硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小且较脆。
(4)金属晶体多数硬度大,且具有延展性。
下列数据是对应物质的熔点
据此做出的下列判断中错误的是( )
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
例
物质 Na2O NaCl AlF3 AlCl3 BCl3 Al2O3 CO2 SiO2
熔点/℃ 920 801 1291 190 -107 2073 -57 1723
【解析】 从表中物质的熔点推测Na2O、NaCl、AlF3是离子晶体,AlCl3、BCl3、CO2是分子晶体。
【答案】 B
