2011年高一化学精品课件:2.2.2 燃料燃烧释放的热量(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:2.2.2 燃料燃烧释放的热量(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 385.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 16:17:42 | ||
图片预览







文档简介
(共28张PPT)
第2课时 燃料燃烧释放的热量
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、当今社会的主要能源
__________________等化石燃料,是当今社会的主要能源。相比较来说,天然气是一种较为洁净的燃料。
二、燃料燃烧过程放出能量的大小
1.定性判断:燃料燃烧过程放出能量的大小,取决于________________和_______________
的相对大小。
煤、石油、天然气
反应物的总能量
生成物的总能量
2.定量计算:一定物质的量的燃料燃烧释放出的热量,等于一定物质的量的生成物化学键形成时所释放的总能量减去一定物质的量的反应物(可燃物与氧气或其他助燃剂)化学键断裂时所消耗的总能量,反应物化学键断裂时所消耗的总能量越少,生成物化学键形成时所释放的总能量越多,燃料放出的热量越多。
三、热值
1.热值指在一定条件下________的物质________所放出的热量。
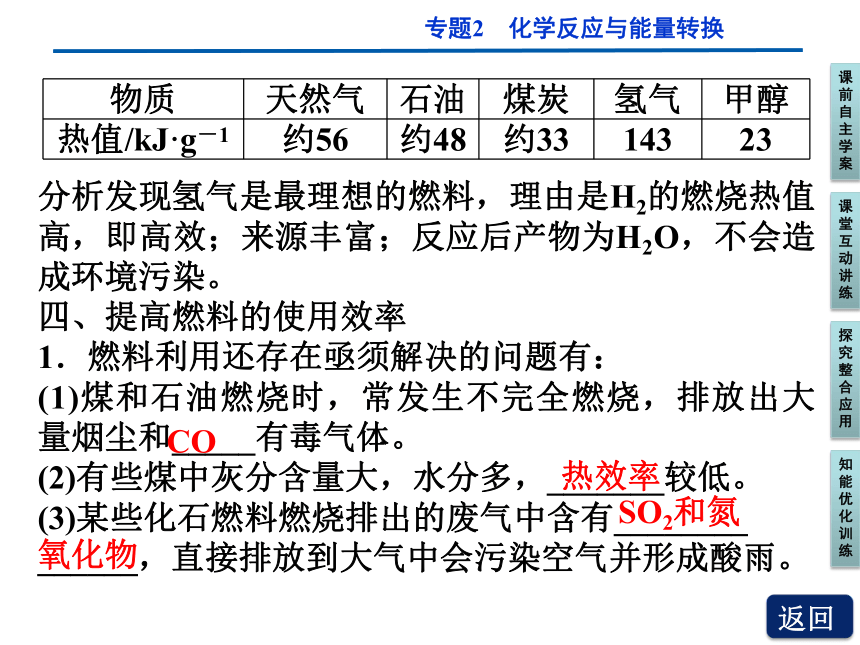
2.不同的燃料其组成和结构也不同,燃烧后放出的能量也不同。比较几种不同燃料的热值(见表):
单位质量
完全燃烧
分析发现氢气是最理想的燃料,理由是H2的燃烧热值高,即高效;来源丰富;反应后产物为H2O,不会造成环境污染。
四、提高燃料的使用效率
1.燃料利用还存在亟须解决的问题有:
(1)煤和石油燃烧时,常发生不完全燃烧,排放出大量烟尘和_____有毒气体。
(2)有些煤中灰分含量大,水分多,_______较低。
(3)某些化石燃料燃烧排出的废气中含有________
______,直接排放到大气中会污染空气并形成酸雨。
CO
热效率
物质 天然气 石油 煤炭 氢气 甲醇
热值/kJ·g-1 约56 约48 约33 143 23
SO2和氮
氧化物
2.为解决燃料燃烧存在的问题需要研究涉及的问题有:
(1)化石燃料完全燃烧的_____,减少燃料燃烧产生的热量损耗的技术,提高燃料利用率的措施。
(2)防止燃料燃烧造成环境污染的方法。
(3)通过化学方法把化石燃料转化成洁净燃料。
(4)开发___________________等洁净、高效的新能源。
条件
氢能、核能、太阳能
自主体验
1.已知反应:X+Y===M+N为放热反应,对该反应的下列说法正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热反应就可发生
答案:C
答案:C
3.下列热化学方程式书写正确的是( )
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
答案:B
课堂互动讲练
反应热与键能的关系
1.化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。
2.当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应。
3.当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。
利用化学键的键能可粗略计算化学反应过程中的能量变化,即反应热。
特别提醒:有些物质的变化过程虽然也有热量变化,但不一定是吸热反应或放热反应。如:NaOH溶于水,虽然放出热量,但不是放热反应,NH4NO3溶于水吸收热量,但不是吸热反应。因为该过程只有旧化学键断裂,没有新化学键生成,不是化学反应。
例1
(2011年无锡高一检测)下表中的数据是破坏1 mol物质中的化学键所消耗的能量:
物质 Cl2 Br2 I2 HCl HBr HI H2
能量(kJ) 243 193 151 432 366 298 436
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是________(填字母代号)。
A.H2
B.Cl2
C.Br2
D.I2
(2)下列氢化物中最稳定的是________(填字母代号)。
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?________。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
【思路点拨】 解决此题的关键有以下两点:
(1)键能越大,物质越稳定。
(2)化学反应所吸收或放出的能量即为反应热。
【解析】 (1)、(2)破坏1 mol物质中的化学键所消耗的能量越大,则物质越稳定,所具有的能量越低。(3)、(4)以氯元素为例计算断开1 mol Cl—Cl键和H—H键需吸收能量:243 kJ+436 kJ=679 kJ,而形成2 mol HCl放出的能量为2×432 kJ=864 kJ,所以在Cl2+H2===2HCl反应中放出864 kJ-679 kJ=185 kJ的热量,同理可计算在Br2+H2===2HBr、I2+H2 2HI反应中分别放出103 kJ、9 kJ的热量。
【答案】 (1)A (2)A (3)放热反应 (4)Cl2
变式训练1 断开1 mol H—H键,1 mol N—H
键、1 mol N≡N键分别需要吸收的能量为436 kJ、391 kJ、946 kJ,求:
(1)1 mol N2生成NH3需________(填“吸收”或
“放出”)能量________kJ。
(2)1 mol H2生成NH3需________(填“吸收”或
“放出”)能量________kJ(不考虑可逆反应)。
解析:本题可从断键吸收的能量数值与成键放出的能量数值的相对大小来判断,若E(断键)>E(成键),则为吸热反应;E(断键)<E(成键),则为放热反应。
答案:(1)放出 92 (2)放出 30.67
燃烧热的含义及应用
1.燃烧热的含义
在101 kPa时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
特别提醒:这里的“稳定的氧化物”,是指氢元素转化为液态水、碳元素转化为二氧化碳气体等。
2.燃烧热的应用
燃烧热可用于比较燃料燃烧放出热量的大小。
例2
一些烷烃的燃烧热如表。下列表述正确的是(双选)( )
化合物 燃烧热/kJ·mol-1 化合物 燃烧热/kJ·mol-1
甲烷 891.0 正丁烷 2878.0
乙烷 1560.8 异丁烷 2869.6
丙烷 2221.5 2 甲基丁烷 3531.3
A.正戊烷的燃烧热大约在3540 kJ·mol-1左右
B.热稳定性:正丁烷<异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-1560.8 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
【解析】 同分异构体燃烧时放出的热量越多,说明该物质处于能量的高位,该物质就越不稳定,由正丁烷和异丁烷的燃烧热数据看,正丁烷比异丁烷燃烧热的数值略大些,说明热稳定性:正丁烷<异丁烷,由以上信息可推出正戊烷比2 甲基丁烷的燃烧热略大些,A正确。正丁烷和异丁烷燃烧生成等量的而且相同的物质,即形成新化学键时所放出的热量相等,1 mol正丁烷完全燃烧放出的热量比1 mol异丁烷完全燃烧放出的热量多,即1 mol正丁烷与O2反应时断裂化学键所吸收的能量比1 mol异丁烷与O2反应时断裂化学键所吸收的能量少,从而说明正丁烷的热稳定性小于异丁烷,以此类推正戊
烷的热稳定性也应小于2 甲基丁烷。C项中的ΔH=-2×1560.8 kJ·mol-1。D项中1 g CH4燃烧放出55.69 kJ的热量,1 g C2H6燃烧放出52.03 kJ的热量,而CH4的含碳量小于C2H6的含碳量,故D项错误。
【答案】 AB
变式训练2
解析:选A。本题考查了燃烧热的定义,燃烧热是指101 kPa下,1 mol可燃物完全燃烧生成稳定的氧化物时放出的热量,只有①符合,故选A。
探究整合应用
煤炭的综合利用
煤是由有机物和无机物所组成的复杂的混合物,在国民经济中占有很重要的地位。煤直接燃烧,会产生严重的污染。因此,发展洁净煤技术、减少污染物的排放、提高煤炭利用率,目前而言是非常重要的,其中煤的气化和液化是高效、清洁地利用煤炭的重要途径。
1.制取水煤气(煤的气化)
例
试回答下列问题:
(1)判断途径一放出的总热量________(填“大于”、“等于”或“小于”)途径二放出的总热量。
(2)在制水煤气的反应里,反应物所具有的总能量________生成物所具有的总能量,因此在反应时,反应物就需要________能量才能转化为生成物,其反应的条件为________。
(3)简述煤通过途径二作为燃料的意义。
【解析】 物质燃烧时放出的热量仅与反应物最初的状态及生成物的最终状态有关,而与其中间变化过程无关,所以,煤变为水煤气以及水煤气燃烧又变为CO2,其实质就相当于煤燃烧生成CO2的一步反应,故放出热量相同。
【答案】 (1)等于 (2)小于 吸收 高温 (3)固体煤经处理变为气体燃料后,不仅在燃烧时减少了SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于管道输送。
第2课时 燃料燃烧释放的热量
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、当今社会的主要能源
__________________等化石燃料,是当今社会的主要能源。相比较来说,天然气是一种较为洁净的燃料。
二、燃料燃烧过程放出能量的大小
1.定性判断:燃料燃烧过程放出能量的大小,取决于________________和_______________
的相对大小。
煤、石油、天然气
反应物的总能量
生成物的总能量
2.定量计算:一定物质的量的燃料燃烧释放出的热量,等于一定物质的量的生成物化学键形成时所释放的总能量减去一定物质的量的反应物(可燃物与氧气或其他助燃剂)化学键断裂时所消耗的总能量,反应物化学键断裂时所消耗的总能量越少,生成物化学键形成时所释放的总能量越多,燃料放出的热量越多。
三、热值
1.热值指在一定条件下________的物质________所放出的热量。
2.不同的燃料其组成和结构也不同,燃烧后放出的能量也不同。比较几种不同燃料的热值(见表):
单位质量
完全燃烧
分析发现氢气是最理想的燃料,理由是H2的燃烧热值高,即高效;来源丰富;反应后产物为H2O,不会造成环境污染。
四、提高燃料的使用效率
1.燃料利用还存在亟须解决的问题有:
(1)煤和石油燃烧时,常发生不完全燃烧,排放出大量烟尘和_____有毒气体。
(2)有些煤中灰分含量大,水分多,_______较低。
(3)某些化石燃料燃烧排出的废气中含有________
______,直接排放到大气中会污染空气并形成酸雨。
CO
热效率
物质 天然气 石油 煤炭 氢气 甲醇
热值/kJ·g-1 约56 约48 约33 143 23
SO2和氮
氧化物
2.为解决燃料燃烧存在的问题需要研究涉及的问题有:
(1)化石燃料完全燃烧的_____,减少燃料燃烧产生的热量损耗的技术,提高燃料利用率的措施。
(2)防止燃料燃烧造成环境污染的方法。
(3)通过化学方法把化石燃料转化成洁净燃料。
(4)开发___________________等洁净、高效的新能源。
条件
氢能、核能、太阳能
自主体验
1.已知反应:X+Y===M+N为放热反应,对该反应的下列说法正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热反应就可发生
答案:C
答案:C
3.下列热化学方程式书写正确的是( )
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
答案:B
课堂互动讲练
反应热与键能的关系
1.化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。
2.当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应。
3.当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。
利用化学键的键能可粗略计算化学反应过程中的能量变化,即反应热。
特别提醒:有些物质的变化过程虽然也有热量变化,但不一定是吸热反应或放热反应。如:NaOH溶于水,虽然放出热量,但不是放热反应,NH4NO3溶于水吸收热量,但不是吸热反应。因为该过程只有旧化学键断裂,没有新化学键生成,不是化学反应。
例1
(2011年无锡高一检测)下表中的数据是破坏1 mol物质中的化学键所消耗的能量:
物质 Cl2 Br2 I2 HCl HBr HI H2
能量(kJ) 243 193 151 432 366 298 436
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是________(填字母代号)。
A.H2
B.Cl2
C.Br2
D.I2
(2)下列氢化物中最稳定的是________(填字母代号)。
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?________。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
【思路点拨】 解决此题的关键有以下两点:
(1)键能越大,物质越稳定。
(2)化学反应所吸收或放出的能量即为反应热。
【解析】 (1)、(2)破坏1 mol物质中的化学键所消耗的能量越大,则物质越稳定,所具有的能量越低。(3)、(4)以氯元素为例计算断开1 mol Cl—Cl键和H—H键需吸收能量:243 kJ+436 kJ=679 kJ,而形成2 mol HCl放出的能量为2×432 kJ=864 kJ,所以在Cl2+H2===2HCl反应中放出864 kJ-679 kJ=185 kJ的热量,同理可计算在Br2+H2===2HBr、I2+H2 2HI反应中分别放出103 kJ、9 kJ的热量。
【答案】 (1)A (2)A (3)放热反应 (4)Cl2
变式训练1 断开1 mol H—H键,1 mol N—H
键、1 mol N≡N键分别需要吸收的能量为436 kJ、391 kJ、946 kJ,求:
(1)1 mol N2生成NH3需________(填“吸收”或
“放出”)能量________kJ。
(2)1 mol H2生成NH3需________(填“吸收”或
“放出”)能量________kJ(不考虑可逆反应)。
解析:本题可从断键吸收的能量数值与成键放出的能量数值的相对大小来判断,若E(断键)>E(成键),则为吸热反应;E(断键)<E(成键),则为放热反应。
答案:(1)放出 92 (2)放出 30.67
燃烧热的含义及应用
1.燃烧热的含义
在101 kPa时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量。
特别提醒:这里的“稳定的氧化物”,是指氢元素转化为液态水、碳元素转化为二氧化碳气体等。
2.燃烧热的应用
燃烧热可用于比较燃料燃烧放出热量的大小。
例2
一些烷烃的燃烧热如表。下列表述正确的是(双选)( )
化合物 燃烧热/kJ·mol-1 化合物 燃烧热/kJ·mol-1
甲烷 891.0 正丁烷 2878.0
乙烷 1560.8 异丁烷 2869.6
丙烷 2221.5 2 甲基丁烷 3531.3
A.正戊烷的燃烧热大约在3540 kJ·mol-1左右
B.热稳定性:正丁烷<异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-1560.8 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
【解析】 同分异构体燃烧时放出的热量越多,说明该物质处于能量的高位,该物质就越不稳定,由正丁烷和异丁烷的燃烧热数据看,正丁烷比异丁烷燃烧热的数值略大些,说明热稳定性:正丁烷<异丁烷,由以上信息可推出正戊烷比2 甲基丁烷的燃烧热略大些,A正确。正丁烷和异丁烷燃烧生成等量的而且相同的物质,即形成新化学键时所放出的热量相等,1 mol正丁烷完全燃烧放出的热量比1 mol异丁烷完全燃烧放出的热量多,即1 mol正丁烷与O2反应时断裂化学键所吸收的能量比1 mol异丁烷与O2反应时断裂化学键所吸收的能量少,从而说明正丁烷的热稳定性小于异丁烷,以此类推正戊
烷的热稳定性也应小于2 甲基丁烷。C项中的ΔH=-2×1560.8 kJ·mol-1。D项中1 g CH4燃烧放出55.69 kJ的热量,1 g C2H6燃烧放出52.03 kJ的热量,而CH4的含碳量小于C2H6的含碳量,故D项错误。
【答案】 AB
变式训练2
解析:选A。本题考查了燃烧热的定义,燃烧热是指101 kPa下,1 mol可燃物完全燃烧生成稳定的氧化物时放出的热量,只有①符合,故选A。
探究整合应用
煤炭的综合利用
煤是由有机物和无机物所组成的复杂的混合物,在国民经济中占有很重要的地位。煤直接燃烧,会产生严重的污染。因此,发展洁净煤技术、减少污染物的排放、提高煤炭利用率,目前而言是非常重要的,其中煤的气化和液化是高效、清洁地利用煤炭的重要途径。
1.制取水煤气(煤的气化)
例
试回答下列问题:
(1)判断途径一放出的总热量________(填“大于”、“等于”或“小于”)途径二放出的总热量。
(2)在制水煤气的反应里,反应物所具有的总能量________生成物所具有的总能量,因此在反应时,反应物就需要________能量才能转化为生成物,其反应的条件为________。
(3)简述煤通过途径二作为燃料的意义。
【解析】 物质燃烧时放出的热量仅与反应物最初的状态及生成物的最终状态有关,而与其中间变化过程无关,所以,煤变为水煤气以及水煤气燃烧又变为CO2,其实质就相当于煤燃烧生成CO2的一步反应,故放出热量相同。
【答案】 (1)等于 (2)小于 吸收 高温 (3)固体煤经处理变为气体燃料后,不仅在燃烧时减少了SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于管道输送。
