2011年高一化学精品课件:2.3.2 化学电源(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:2.3.2 化学电源(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 719.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 00:00:00 | ||
图片预览









文档简介
(共36张PPT)
第2课时 化学电源
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、化学电源
人们根据原电池的反应原理,发明并制造了多种多样的化学电源。在日常生活、高科技领域、航天技术中化学电源是不可缺少的。化学电源具有能量转化率高、使用方便、用途广泛等优点。
二、化学电源的分类
化学电源可分为两类:_________、________。
一次电池
二次电池
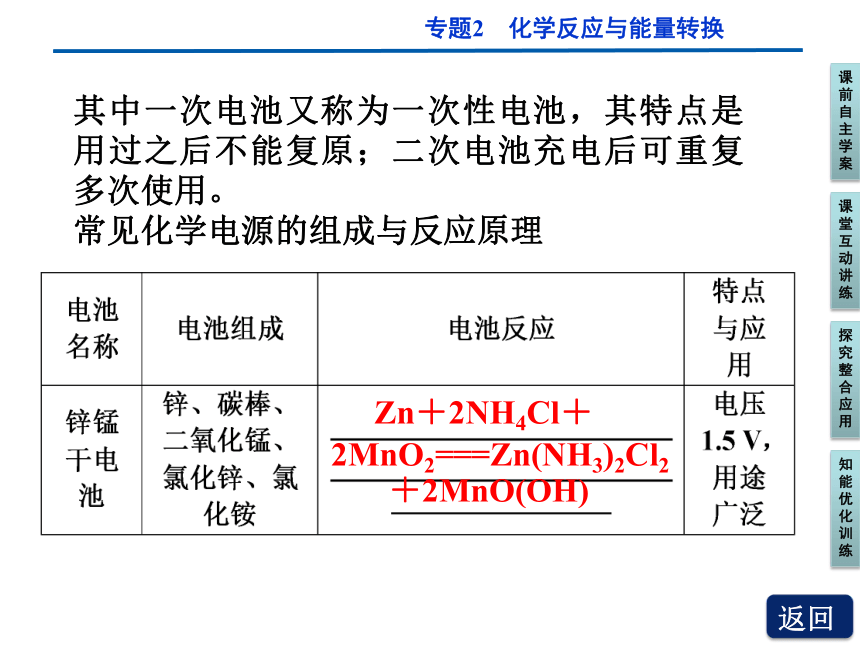
其中一次电池又称为一次性电池,其特点是用过之后不能复原;二次电池充电后可重复多次使用。
常见化学电源的组成与反应原理
Zn+2NH4Cl+
2MnO2===Zn(NH3)2Cl2
+2MnO(OH)
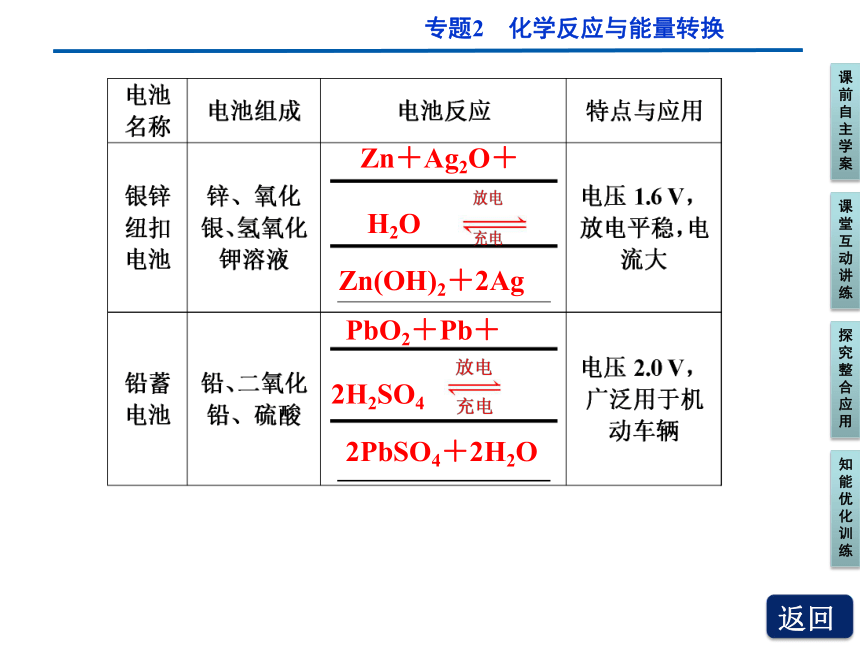
Zn+Ag2O+
H2O
Zn(OH)2+2Ag
PbO2+Pb+
2PbSO4+2H2O
2H2SO4
2CH3OH+3O2+
6H2O
自主体验
1.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化成氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为( )
A.H2+2OH--2e-===2H2O
B.O2+4H++4e-===2H2O
C.H2-2e-===2H+
D.O2+2H2O+4e-===4OH-
答案:C
答案:A
3.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e-===H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-===2H2O(l)
C.CH3OH(g)+H2O(l)-6e-===CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-===4OH-
答案:C
课堂互动讲练
化学电源
化学电源可分为一次电池和二次电池。二次电池放电时是原电池,遵循原电池原理。
例1
【解析】 该电池能充电,为二次电池,A不正确;根据Li只有+1价可推知,LiFePO4中的Fe为+2价,B正确;放电时负极被消耗,化学能转化为电能,C正确;放电时,为原电池,电解质溶液中的阳离子应向正极移动,D正确。
【答案】 A
变式训练1 下列说法正确的是( )
A.镍镉电池、锂电池和锌锰电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应原理是氧化还原反应
D.铅蓄电池放电时正极是Pb,负极是PbO2
解析:选C。锌锰电池是一次电池,A不正确;燃料电池是一种高效不会污染环境的新型电池,B不正确;铅蓄电池放电时正极是PbO2,负极是Pb,D不正确。
电极反应式、原电池反应式的书写
1.电极反应式的书写
(1)负极反应式的书写
①活泼金属作负极时,本身被氧化:
若生成的阳离子不与电解质溶液反应,可直接写成产物为金属阳离子,如:Zn-2e-===Zn2+,Cu-2e-===Cu2+。
若生成的金属阳离子与电解质溶液反应,应写成“金属失电子的反应式”与“阳离子与电解质溶
如:H2-O2(H2SO4)原电池,正极反应式为:
O2+4e-+4H+===2H2O;
H2-O2(KOH)原电池,正极反应式为:
O2+4e-+2H2O===4OH-。
2.原电池反应式的书写
两电极反应式,得失电子数相等时,将两电极反应式相加即得原电池反应式。
特别提醒:在正极上,若是电解质溶液中的某种离子被还原,无论该离子是强电解质提供的,还是弱电解质提供的,一律写离子符号;而在原电池反应中,要遵循离子方程式的书写规则,只有易溶的强电解质用离子符号表示。
例2
写出下列原电池的电极反应式和总反应的化学方程式。
正 、负极
电解质
组别 负极 正极 电解质溶液
(1) 铁 铜 稀硫酸
(2) 铜 银 硝酸银溶液
(3) 铁 石墨 氯化钠溶液
(1)负极:______________;正极:________________________________________________________________________;
总反应式:________________________________________________________________________。
(2)负极:______________;正极:________________________________________________________________________;
总反应式:________________________________________________________________________。
(3)负极:______________;正极:________________________________________________________________________;
总反应式:________________________________________________________________________。
【解析】 (1)铁作负极失2e-变成Fe2+,H+得e-变成H2;(2)Cu失2e-变成Cu2+,Ag+得e-变成Ag;(3)Fe失2e-变成Fe2+,得电子的是空气中的O2,因为NaCl溶液为中性溶液,所以O2得电子后变为O2-,立即结合H2O分子生成OH-。
【答案】 (1)Fe-2e-===Fe2+ 2H++2e-===H2↑
Fe+H2SO4===FeSO4+H2↑
(2)Cu-2e-===Cu2+ Ag++e-===Ag
Cu+2AgNO3===2Ag+Cu(NO3)2
(3)Fe-2e-===Fe2+ 2H2O+O2+4e-===4OH-
2Fe+2H2O+O2===2Fe(OH)2
变式训练2
燃料电池
燃料电池中通燃料的一极作负极,通O2的一极作正极,常见的有CH4、CH3OH、C2H6、H2等燃料电池。
例3
(2011年莆田高一检测)如图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为H2SO4溶液时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
氢氧燃料电池示意图
(1)酸式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
【解析】 燃料电池所用的介质不同,相应的电极反应就不同;但无论如何书写,两电极反应相叠加始终等于燃料的燃烧反应。这也是验证电极反应是否正确的一种方法。
(1)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合生成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2在O2中燃烧的反应,由于有水生成,溶液将逐渐变稀,故pH增大。
(2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O分子结合生成OH-;负极上,H2失去电子变为H+,碱性条件下H+不能大量存在,与OH-结合生成水。电池。
总反应也是H2在O2中的燃烧反应。同样,由于有水生成,c(OH-)变小,pH变小
【答案】 (1)2H2-4e-===4H+ O2+4e-+4H+===2H2O 2H2+O2===2H2O 变大
(2)2H2-4e-+4OH-===4H2O O2+4e-+2H2O===4OH- 2H2+O2===2H2O 变小
变式训练3
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
探究整合应用
废旧电池的回收利用
一节电池烂在地里,能够使一平米的土地失去利用价值。对自然环境威胁最大的5种物质中,电池里就含了3种。废电池一般都运往专门的有毒、有害垃圾填埋场,但这种做法不仅花费太大而且还造成浪费,因为其中尚有不少可作原料的有用物质。回收利用废旧电池,不仅能减少环境污染,而且还能减少资源的浪费。
例
某学校设计了一节实验活动课,让学生从废旧电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下。回答有关问题。
(1)干电池的基本构造和工作原理
如图为干电池的基本构造图。干电池工作时负极上的电极反应是__________________________,MnO2的作用是除去正极上的产物H2,该反应方程式为2MnO2+H2===Mn2O3+H2O。
(2)锌皮和碳棒的回收
用钳子和剪子剪开待回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②设计简单的实验证明所得晶体中含有NH。
实验步骤________________________________________________________________________
________________________________________________________________________;
实验现象________________________________________________________________________;
有关的离子方程式________________________________________________________________________。
③用________的方法可将NH4Cl和ZnCl2的晶体混合物分离开。
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中要用到的主要仪器有________________________________________________________________________。
【解析】 以干电池为情景综合考查物质的提取、检验和分离。
第2课时 化学电源
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、化学电源
人们根据原电池的反应原理,发明并制造了多种多样的化学电源。在日常生活、高科技领域、航天技术中化学电源是不可缺少的。化学电源具有能量转化率高、使用方便、用途广泛等优点。
二、化学电源的分类
化学电源可分为两类:_________、________。
一次电池
二次电池
其中一次电池又称为一次性电池,其特点是用过之后不能复原;二次电池充电后可重复多次使用。
常见化学电源的组成与反应原理
Zn+2NH4Cl+
2MnO2===Zn(NH3)2Cl2
+2MnO(OH)
Zn+Ag2O+
H2O
Zn(OH)2+2Ag
PbO2+Pb+
2PbSO4+2H2O
2H2SO4
2CH3OH+3O2+
6H2O
自主体验
1.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化成氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为( )
A.H2+2OH--2e-===2H2O
B.O2+4H++4e-===2H2O
C.H2-2e-===2H+
D.O2+2H2O+4e-===4OH-
答案:C
答案:A
3.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e-===H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-===2H2O(l)
C.CH3OH(g)+H2O(l)-6e-===CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-===4OH-
答案:C
课堂互动讲练
化学电源
化学电源可分为一次电池和二次电池。二次电池放电时是原电池,遵循原电池原理。
例1
【解析】 该电池能充电,为二次电池,A不正确;根据Li只有+1价可推知,LiFePO4中的Fe为+2价,B正确;放电时负极被消耗,化学能转化为电能,C正确;放电时,为原电池,电解质溶液中的阳离子应向正极移动,D正确。
【答案】 A
变式训练1 下列说法正确的是( )
A.镍镉电池、锂电池和锌锰电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应原理是氧化还原反应
D.铅蓄电池放电时正极是Pb,负极是PbO2
解析:选C。锌锰电池是一次电池,A不正确;燃料电池是一种高效不会污染环境的新型电池,B不正确;铅蓄电池放电时正极是PbO2,负极是Pb,D不正确。
电极反应式、原电池反应式的书写
1.电极反应式的书写
(1)负极反应式的书写
①活泼金属作负极时,本身被氧化:
若生成的阳离子不与电解质溶液反应,可直接写成产物为金属阳离子,如:Zn-2e-===Zn2+,Cu-2e-===Cu2+。
若生成的金属阳离子与电解质溶液反应,应写成“金属失电子的反应式”与“阳离子与电解质溶
如:H2-O2(H2SO4)原电池,正极反应式为:
O2+4e-+4H+===2H2O;
H2-O2(KOH)原电池,正极反应式为:
O2+4e-+2H2O===4OH-。
2.原电池反应式的书写
两电极反应式,得失电子数相等时,将两电极反应式相加即得原电池反应式。
特别提醒:在正极上,若是电解质溶液中的某种离子被还原,无论该离子是强电解质提供的,还是弱电解质提供的,一律写离子符号;而在原电池反应中,要遵循离子方程式的书写规则,只有易溶的强电解质用离子符号表示。
例2
写出下列原电池的电极反应式和总反应的化学方程式。
正 、负极
电解质
组别 负极 正极 电解质溶液
(1) 铁 铜 稀硫酸
(2) 铜 银 硝酸银溶液
(3) 铁 石墨 氯化钠溶液
(1)负极:______________;正极:________________________________________________________________________;
总反应式:________________________________________________________________________。
(2)负极:______________;正极:________________________________________________________________________;
总反应式:________________________________________________________________________。
(3)负极:______________;正极:________________________________________________________________________;
总反应式:________________________________________________________________________。
【解析】 (1)铁作负极失2e-变成Fe2+,H+得e-变成H2;(2)Cu失2e-变成Cu2+,Ag+得e-变成Ag;(3)Fe失2e-变成Fe2+,得电子的是空气中的O2,因为NaCl溶液为中性溶液,所以O2得电子后变为O2-,立即结合H2O分子生成OH-。
【答案】 (1)Fe-2e-===Fe2+ 2H++2e-===H2↑
Fe+H2SO4===FeSO4+H2↑
(2)Cu-2e-===Cu2+ Ag++e-===Ag
Cu+2AgNO3===2Ag+Cu(NO3)2
(3)Fe-2e-===Fe2+ 2H2O+O2+4e-===4OH-
2Fe+2H2O+O2===2Fe(OH)2
变式训练2
燃料电池
燃料电池中通燃料的一极作负极,通O2的一极作正极,常见的有CH4、CH3OH、C2H6、H2等燃料电池。
例3
(2011年莆田高一检测)如图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为H2SO4溶液时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
氢氧燃料电池示意图
(1)酸式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
【解析】 燃料电池所用的介质不同,相应的电极反应就不同;但无论如何书写,两电极反应相叠加始终等于燃料的燃烧反应。这也是验证电极反应是否正确的一种方法。
(1)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合生成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2在O2中燃烧的反应,由于有水生成,溶液将逐渐变稀,故pH增大。
(2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O分子结合生成OH-;负极上,H2失去电子变为H+,碱性条件下H+不能大量存在,与OH-结合生成水。电池。
总反应也是H2在O2中的燃烧反应。同样,由于有水生成,c(OH-)变小,pH变小
【答案】 (1)2H2-4e-===4H+ O2+4e-+4H+===2H2O 2H2+O2===2H2O 变大
(2)2H2-4e-+4OH-===4H2O O2+4e-+2H2O===4OH- 2H2+O2===2H2O 变小
变式训练3
(3)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
探究整合应用
废旧电池的回收利用
一节电池烂在地里,能够使一平米的土地失去利用价值。对自然环境威胁最大的5种物质中,电池里就含了3种。废电池一般都运往专门的有毒、有害垃圾填埋场,但这种做法不仅花费太大而且还造成浪费,因为其中尚有不少可作原料的有用物质。回收利用废旧电池,不仅能减少环境污染,而且还能减少资源的浪费。
例
某学校设计了一节实验活动课,让学生从废旧电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下。回答有关问题。
(1)干电池的基本构造和工作原理
如图为干电池的基本构造图。干电池工作时负极上的电极反应是__________________________,MnO2的作用是除去正极上的产物H2,该反应方程式为2MnO2+H2===Mn2O3+H2O。
(2)锌皮和碳棒的回收
用钳子和剪子剪开待回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②设计简单的实验证明所得晶体中含有NH。
实验步骤________________________________________________________________________
________________________________________________________________________;
实验现象________________________________________________________________________;
有关的离子方程式________________________________________________________________________。
③用________的方法可将NH4Cl和ZnCl2的晶体混合物分离开。
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中要用到的主要仪器有________________________________________________________________________。
【解析】 以干电池为情景综合考查物质的提取、检验和分离。
