2011年高一化学精品课件:3.1.3 煤的综合利用 苯(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:3.1.3 煤的综合利用 苯(苏教版必修2) |  | |
| 格式 | rar | ||
| 文件大小 | 429.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 16:17:42 | ||
图片预览







文档简介
(共30张PPT)
第3课时 煤的综合利用 苯
第3课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
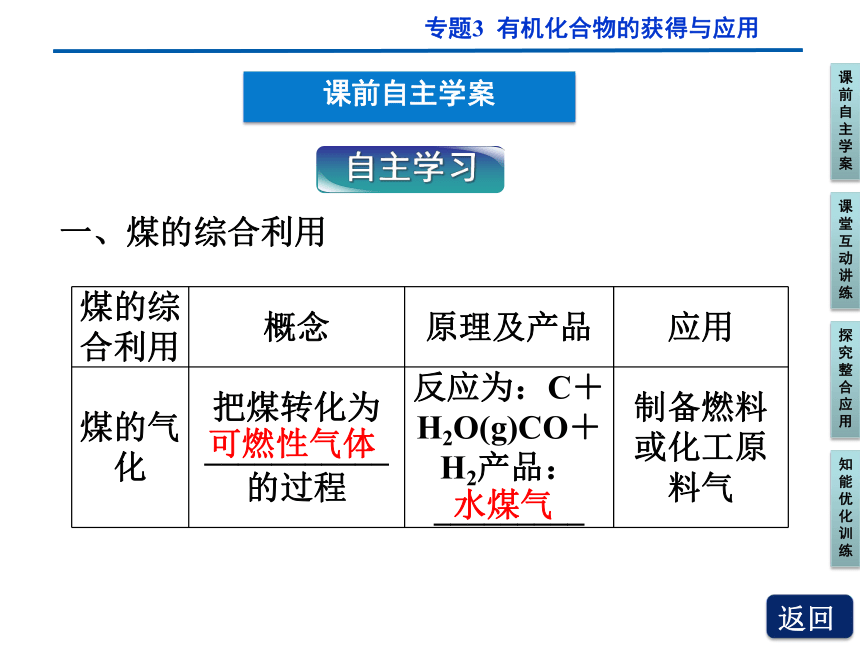
一、煤的综合利用
煤的综合利用 概念 原理及产品 应用
煤的气化 把煤转化为___________的过程 反应为:C+H2O(g)CO+H2产品:_________ 制备燃料或化工原料气
可燃性气体
水煤气
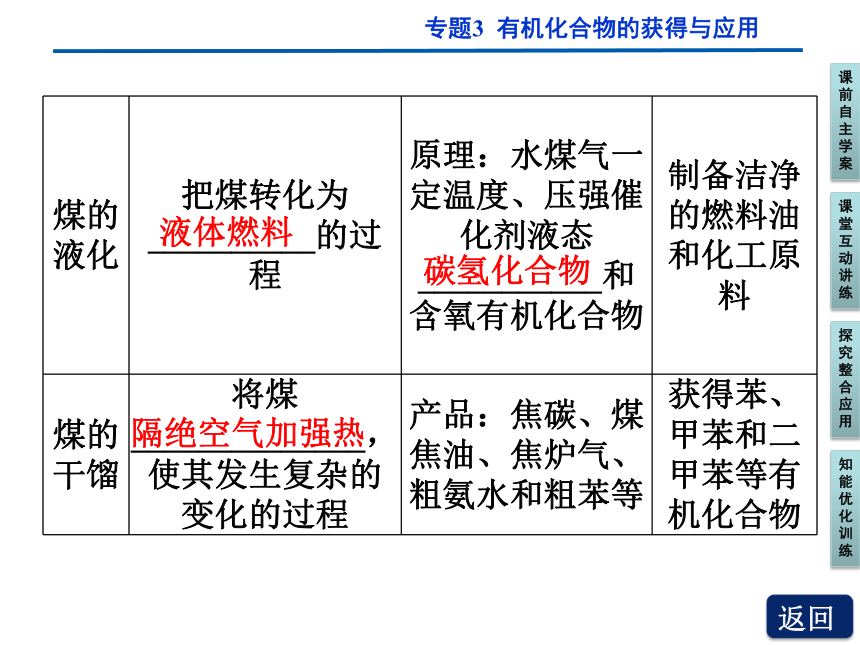
煤的液化 把煤转化为__________的过程 原理:水煤气一定温度、压强催化剂液态___________和含氧有机化合物 制备洁净的燃料油和化工原料
煤的干馏 将煤 ______________,使其发生复杂的变化的过程 产品:焦碳、煤焦油、焦炉气、粗氨水和粗苯等 获得苯、甲苯和二甲苯等有机化合物
液体燃料
碳氢化合物
隔绝空气加强热
思考感悟
1.煤的干馏和石油的分馏有什么本质区别?
【提示】 煤的干馏是复杂的化学变化;而石油的分馏是指通过加热和冷凝,把石油分成不同沸点范围的产物,属于物理变化。
二、苯
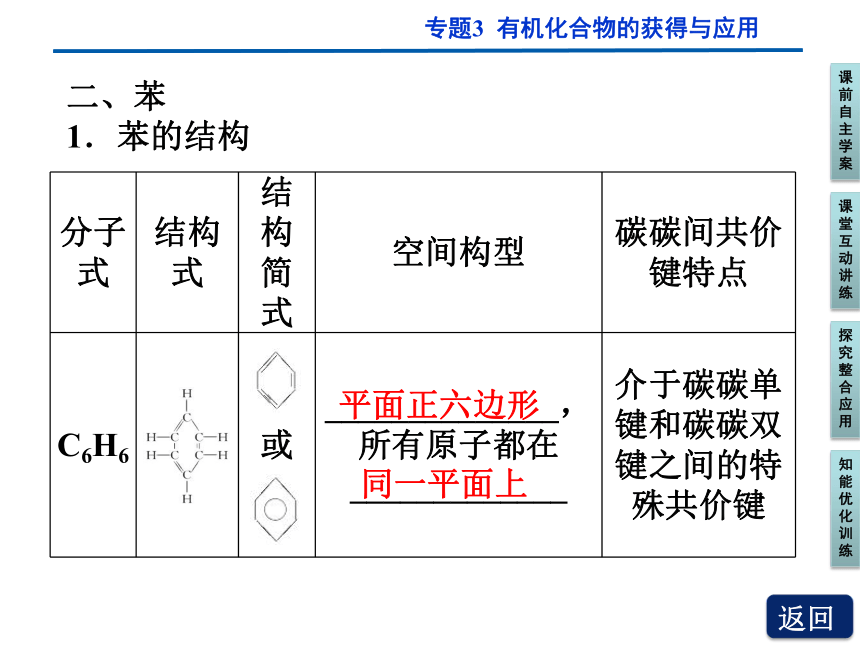
1.苯的结构
分子式 结构式 结构简式 空间构型 碳碳间共价键特点
C6H6 或 ______________,所有原子都在_____________ 介于碳碳单键和碳碳双键之间的特殊共价键
平面正六边形
同一平面上
思考感悟
2.如何通过实验证明苯分子中没有碳碳双键?
【提示】 向盛有苯的试管中滴加酸性高锰酸钾溶液或溴的四氯化碳溶液并振荡,观察是否褪色。若不褪色说明苯分子中不存在碳碳双键。
2.苯的性质
(1)物理性质
颜色 状态 气味 密度 毒性 溶解性 挥发性
无色 液体 有特殊气味 比水小 ——— _________ 易挥发
有毒
难溶于水
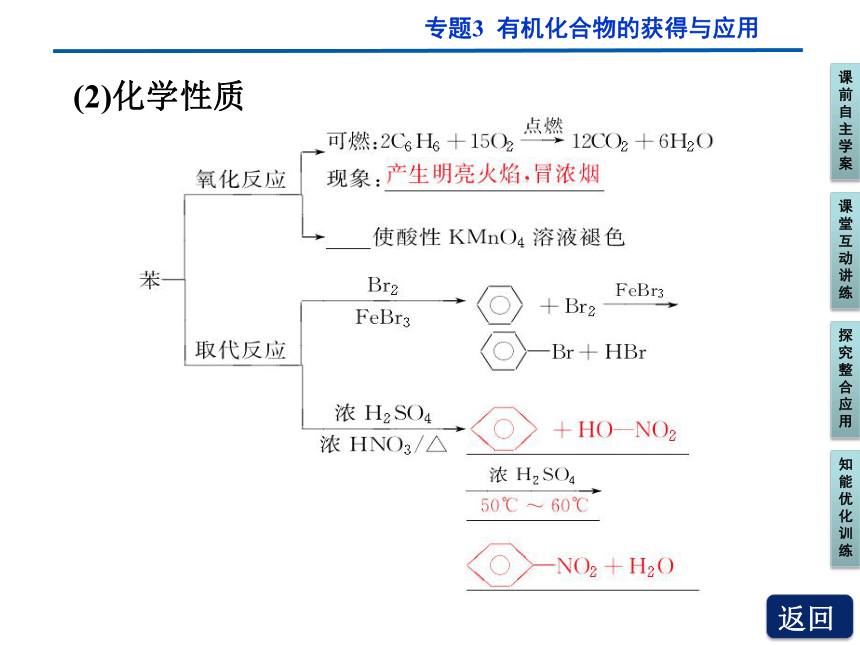
(2)化学性质
思考感悟
3.在标准状况下,11.2 L苯分子中碳原子数为3NA(NA代表阿伏加德罗常数),正确吗?
【提示】 不正确。因为在标准状况下,苯非气体,故11.2 L苯的物质的量不是0.5 mol,所以碳原子数不是3NA。
自主体验
思考感悟
1.下列说法中正确的是( )
A.利用煤的加工手段,不可能从煤中获得燃料油
B.煤的干馏属于化学变化
C.煤高温干馏所得的焦炉气中含有一定量的芳香烃
D.煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来
答案:B
2.下列有关苯、乙烯的比较中正确的是( )
A.分子中所有原子都在同一平面上
B.等质量燃烧时,苯耗氧气多
C.都能与溴水反应
D.都能被酸性KMnO4溶液氧化
答案:A
3.下列关于苯的性质的叙述中,不正确的是( )
A.苯是无色带有特殊气味的液体
B.常温下苯是一种不溶于水且密度小于水的液体
C.苯在一定条件下能与硝酸发生取代反应
D.苯不具有典型的双键所应具有的加成反应的性质,故不可能发生加成反应
答案:D
课堂互动讲练
苯的结构的特殊性
苯分子是一种平面正六边形结构的分子,六个碳原子和六个氢原子位于同一平面内。
分子中不存在碳碳单键,也不存在碳碳双键,而是一种介于单键和双键之间的独特的共价键。
?特别提醒:因苯的凯库勒式为,往往被误认为苯分子是单、双键交替的结构,其实苯分子中6个碳碳键完全相同,只是一种习惯用法。
苯分子实际上不具有碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实有( )
①苯的间位二元取代物只有一种;
②苯的邻位二元取代物只有一种;
③苯不能使酸性KMnO4溶液褪色;
④苯能在一定条件下与氢气反应生成环己烷;
⑤苯在FeBr3存在的条件下同液溴发生取代反应。
A.①③④ B.③④⑤
C.②③⑤ D.①③⑤
例1
【解析】 抓住苯分子的独特结构与性质的关系,发挥空间想象能力,认真分析苯的不同结构对二元取代物的影响和不同的结构特点对物质化学性质的影响。
苯分子若是单、双键交替结构,则:间位二元取代物RR和RR是相同的;邻位二元取代物RR和RR是不同的;存在典型的碳碳双键必然能使酸性KMnO4溶液褪色,能与H2发生加成反应,也容易与溴发生加成反应而不是取代反应。因此②③⑤说明苯分子中不存在碳碳双键。
【答案】 C
变式训练1 能够说明苯分子中不存在单、双键,而是所有碳碳键完全相同的事实是(双选)( )
A.甲苯无同分异构体
B.苯分子中各原子均在一个平面内,各键键角均为120°
C.邻二甲苯只有一种
D.1 mol苯最多只能与3 mol H2加成
解析:选BC。苯分子中各原子均在一个平面内,各键键角均为120°,说明苯分子中六元环上的碳碳键键长相等,若由单、双键构成,其键长不可能相等,单键键长一定大于双键的键长,故B正确;若苯分子中存在单、双键,则邻二甲苯有以下两种CH3CH3、H3CH3C,但事实上邻二甲苯只有一种,则说明所有的碳碳键完全相同。
苯的化学性质
1.苯不能使酸性KMnO4溶液和溴水褪色,由此可知苯在化学性质上与烯烃有很大差别。
2.苯在催化剂(Fe或FeBr3)作用下与液溴发生取代反应,说明苯具有类似烷烃的性质。
3.苯又能与H2和Cl2分别在催化作用下发生加成反应,说明苯具有烯烃的性质。
总之,苯易发生取代反应,能发生加成反应,难被氧化,其化学性质不同于烷烃、烯烃。
(2011年陕西延安高一联考)某液态烃的分子式为CmHn,相对分子质量为H2的39倍。它不能使酸性KMnO4溶液褪色,不能同溴的四氯化碳溶液反应而使其褪色。在催化剂存在时,7.8 g该烃能与0.3 mol H2发生加成反应生成相应的饱和烃CmHp。则:
(1)m、n、p的值分别是m=__________,n=________________________________________________________________________,
p=________。
例2
(2)CmHp的结构简式是:________________________________________________________________________。
(3)CmHn能和浓硫酸、浓硝酸的混合酸反应,该反应的化学方程式是__________________________________,该反应属于________反应,有机产物的名称是________。
【解析】 解答本题可先由CmHn相对分子质量是H2的39倍,求出其相对分子质量,再由与H2加成推出不饱和键的情况。结合所学知识,可推断出CmHn的分子式,然后结合苯的性质和结构特点得出答案。
由题意知CmHn的相对分子质量为39×2=78,所以可推知1 mol CmHn可与3 mol H2发生加成反应,习惯方法应推知其分子中有3个双键,但它不能使酸性KMnO4溶液和溴的四氯化碳溶液褪色,根据所学知识,推测符合其情况的只有苯环的结构,从而推出CmHn的分子式为C6H6,C6H6能与3 mol H2加成生成C6H12,也能与浓硝酸发生取代反应。
变式训练2 下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②CH3CH2CH===CH2
③ ④CH3CH3
A.①②③④ B.③④
C.①②④ D.①②
解析:选D。酸性KMnO4溶液褪色的原因是发生氧化还原反应;溴水褪色的原理有两种:一是发生化学反应,二是利用萃取原理。SO2具有还原性,能被强氧化剂Br2及酸性KMnO4溶液氧化而使其褪色;CH3—CH2—CH===CH2中有双键,遇溶液Br2能发生加成反应,遇酸性KMnO4溶液能被氧化,从而使溴水及酸性KMnO4溶液褪色;苯结构稳定,不能被酸性KMnO4氧化,但可萃取溴水中的Br2,使溴水褪色,此过程属物理变化过程;CH3CH3既不能使溴水褪色,也不能使酸性KMnO4溶液褪色。
探究整合应用
解析:选D。酸性KMnO4溶液褪色的原因是发生氧化还原反应;溴水褪色的原理有两种:一是发生化学反应,二是利用萃取原理。SO2具有还原性,能被强氧化剂Br2及酸性KMnO4溶液氧化而使其褪色;CH3—CH2—CH===CH2中有双键,遇溶液Br2能发生加成反应,遇酸性KMnO4溶液能被氧化,从而使溴水及酸性KMnO4溶液褪色;苯结构稳定,不能被酸性KMnO4氧化,但可萃取溴水中的Br2,使溴水褪色,此过程属物理变化过程;CH3CH3既不能使溴水褪色,也不能使酸性KMnO4溶液褪色。
三是四种分子的内部键角和外部构型(如图)。
甲烷:键角109.5°,分子正四面体形。最多有3个H原子或1个C原子和2个H原子在同一个平面内。最多有2个原子在同一条直线上。
乙烯:键角120°,分子平面矩形。最多有6个原子在同一个平面内。最多有2个原子在同一条直线上。
乙炔:键角180°,分子直线形。最多有4个原子在同一个平面内。最多有4个原子在同一条直线上。
苯:键角120°,分子平面正六边形。最多有12个原子在同一个平面内。最多有4个原子在同一条直线上。
四是先分析后综合。如:H3C—CH3,最多有4个原子在同一个平面内。CH2CHCH3,最多有7个原子在同一个平面内。C6H5C≡CCHCH2(C6H5—是苯基),最多有18个原子在同一个平面内。
描述CH3CHCHC≡CCF3分子结构的下列叙述中,正确的是(双选)( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
例
【解析】 依基团的结构可将上式写为立体结构并编号如图所示。
①②③④这4个碳原子具有乙烯平面形结构,它们在同一平面上,而不在同一直线上,键角120°;③④⑤⑥这4个碳原子具有乙炔的线形结构,它们在同一直线上,键角为180°。由此可知,这6个碳原子不可能都在同一直线,有可能都在同一平面上。
【答案】 BC
第3课时 煤的综合利用 苯
第3课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、煤的综合利用
煤的综合利用 概念 原理及产品 应用
煤的气化 把煤转化为___________的过程 反应为:C+H2O(g)CO+H2产品:_________ 制备燃料或化工原料气
可燃性气体
水煤气
煤的液化 把煤转化为__________的过程 原理:水煤气一定温度、压强催化剂液态___________和含氧有机化合物 制备洁净的燃料油和化工原料
煤的干馏 将煤 ______________,使其发生复杂的变化的过程 产品:焦碳、煤焦油、焦炉气、粗氨水和粗苯等 获得苯、甲苯和二甲苯等有机化合物
液体燃料
碳氢化合物
隔绝空气加强热
思考感悟
1.煤的干馏和石油的分馏有什么本质区别?
【提示】 煤的干馏是复杂的化学变化;而石油的分馏是指通过加热和冷凝,把石油分成不同沸点范围的产物,属于物理变化。
二、苯
1.苯的结构
分子式 结构式 结构简式 空间构型 碳碳间共价键特点
C6H6 或 ______________,所有原子都在_____________ 介于碳碳单键和碳碳双键之间的特殊共价键
平面正六边形
同一平面上
思考感悟
2.如何通过实验证明苯分子中没有碳碳双键?
【提示】 向盛有苯的试管中滴加酸性高锰酸钾溶液或溴的四氯化碳溶液并振荡,观察是否褪色。若不褪色说明苯分子中不存在碳碳双键。
2.苯的性质
(1)物理性质
颜色 状态 气味 密度 毒性 溶解性 挥发性
无色 液体 有特殊气味 比水小 ——— _________ 易挥发
有毒
难溶于水
(2)化学性质
思考感悟
3.在标准状况下,11.2 L苯分子中碳原子数为3NA(NA代表阿伏加德罗常数),正确吗?
【提示】 不正确。因为在标准状况下,苯非气体,故11.2 L苯的物质的量不是0.5 mol,所以碳原子数不是3NA。
自主体验
思考感悟
1.下列说法中正确的是( )
A.利用煤的加工手段,不可能从煤中获得燃料油
B.煤的干馏属于化学变化
C.煤高温干馏所得的焦炉气中含有一定量的芳香烃
D.煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来
答案:B
2.下列有关苯、乙烯的比较中正确的是( )
A.分子中所有原子都在同一平面上
B.等质量燃烧时,苯耗氧气多
C.都能与溴水反应
D.都能被酸性KMnO4溶液氧化
答案:A
3.下列关于苯的性质的叙述中,不正确的是( )
A.苯是无色带有特殊气味的液体
B.常温下苯是一种不溶于水且密度小于水的液体
C.苯在一定条件下能与硝酸发生取代反应
D.苯不具有典型的双键所应具有的加成反应的性质,故不可能发生加成反应
答案:D
课堂互动讲练
苯的结构的特殊性
苯分子是一种平面正六边形结构的分子,六个碳原子和六个氢原子位于同一平面内。
分子中不存在碳碳单键,也不存在碳碳双键,而是一种介于单键和双键之间的独特的共价键。
?特别提醒:因苯的凯库勒式为,往往被误认为苯分子是单、双键交替的结构,其实苯分子中6个碳碳键完全相同,只是一种习惯用法。
苯分子实际上不具有碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实有( )
①苯的间位二元取代物只有一种;
②苯的邻位二元取代物只有一种;
③苯不能使酸性KMnO4溶液褪色;
④苯能在一定条件下与氢气反应生成环己烷;
⑤苯在FeBr3存在的条件下同液溴发生取代反应。
A.①③④ B.③④⑤
C.②③⑤ D.①③⑤
例1
【解析】 抓住苯分子的独特结构与性质的关系,发挥空间想象能力,认真分析苯的不同结构对二元取代物的影响和不同的结构特点对物质化学性质的影响。
苯分子若是单、双键交替结构,则:间位二元取代物RR和RR是相同的;邻位二元取代物RR和RR是不同的;存在典型的碳碳双键必然能使酸性KMnO4溶液褪色,能与H2发生加成反应,也容易与溴发生加成反应而不是取代反应。因此②③⑤说明苯分子中不存在碳碳双键。
【答案】 C
变式训练1 能够说明苯分子中不存在单、双键,而是所有碳碳键完全相同的事实是(双选)( )
A.甲苯无同分异构体
B.苯分子中各原子均在一个平面内,各键键角均为120°
C.邻二甲苯只有一种
D.1 mol苯最多只能与3 mol H2加成
解析:选BC。苯分子中各原子均在一个平面内,各键键角均为120°,说明苯分子中六元环上的碳碳键键长相等,若由单、双键构成,其键长不可能相等,单键键长一定大于双键的键长,故B正确;若苯分子中存在单、双键,则邻二甲苯有以下两种CH3CH3、H3CH3C,但事实上邻二甲苯只有一种,则说明所有的碳碳键完全相同。
苯的化学性质
1.苯不能使酸性KMnO4溶液和溴水褪色,由此可知苯在化学性质上与烯烃有很大差别。
2.苯在催化剂(Fe或FeBr3)作用下与液溴发生取代反应,说明苯具有类似烷烃的性质。
3.苯又能与H2和Cl2分别在催化作用下发生加成反应,说明苯具有烯烃的性质。
总之,苯易发生取代反应,能发生加成反应,难被氧化,其化学性质不同于烷烃、烯烃。
(2011年陕西延安高一联考)某液态烃的分子式为CmHn,相对分子质量为H2的39倍。它不能使酸性KMnO4溶液褪色,不能同溴的四氯化碳溶液反应而使其褪色。在催化剂存在时,7.8 g该烃能与0.3 mol H2发生加成反应生成相应的饱和烃CmHp。则:
(1)m、n、p的值分别是m=__________,n=________________________________________________________________________,
p=________。
例2
(2)CmHp的结构简式是:________________________________________________________________________。
(3)CmHn能和浓硫酸、浓硝酸的混合酸反应,该反应的化学方程式是__________________________________,该反应属于________反应,有机产物的名称是________。
【解析】 解答本题可先由CmHn相对分子质量是H2的39倍,求出其相对分子质量,再由与H2加成推出不饱和键的情况。结合所学知识,可推断出CmHn的分子式,然后结合苯的性质和结构特点得出答案。
由题意知CmHn的相对分子质量为39×2=78,所以可推知1 mol CmHn可与3 mol H2发生加成反应,习惯方法应推知其分子中有3个双键,但它不能使酸性KMnO4溶液和溴的四氯化碳溶液褪色,根据所学知识,推测符合其情况的只有苯环的结构,从而推出CmHn的分子式为C6H6,C6H6能与3 mol H2加成生成C6H12,也能与浓硝酸发生取代反应。
变式训练2 下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②CH3CH2CH===CH2
③ ④CH3CH3
A.①②③④ B.③④
C.①②④ D.①②
解析:选D。酸性KMnO4溶液褪色的原因是发生氧化还原反应;溴水褪色的原理有两种:一是发生化学反应,二是利用萃取原理。SO2具有还原性,能被强氧化剂Br2及酸性KMnO4溶液氧化而使其褪色;CH3—CH2—CH===CH2中有双键,遇溶液Br2能发生加成反应,遇酸性KMnO4溶液能被氧化,从而使溴水及酸性KMnO4溶液褪色;苯结构稳定,不能被酸性KMnO4氧化,但可萃取溴水中的Br2,使溴水褪色,此过程属物理变化过程;CH3CH3既不能使溴水褪色,也不能使酸性KMnO4溶液褪色。
探究整合应用
解析:选D。酸性KMnO4溶液褪色的原因是发生氧化还原反应;溴水褪色的原理有两种:一是发生化学反应,二是利用萃取原理。SO2具有还原性,能被强氧化剂Br2及酸性KMnO4溶液氧化而使其褪色;CH3—CH2—CH===CH2中有双键,遇溶液Br2能发生加成反应,遇酸性KMnO4溶液能被氧化,从而使溴水及酸性KMnO4溶液褪色;苯结构稳定,不能被酸性KMnO4氧化,但可萃取溴水中的Br2,使溴水褪色,此过程属物理变化过程;CH3CH3既不能使溴水褪色,也不能使酸性KMnO4溶液褪色。
三是四种分子的内部键角和外部构型(如图)。
甲烷:键角109.5°,分子正四面体形。最多有3个H原子或1个C原子和2个H原子在同一个平面内。最多有2个原子在同一条直线上。
乙烯:键角120°,分子平面矩形。最多有6个原子在同一个平面内。最多有2个原子在同一条直线上。
乙炔:键角180°,分子直线形。最多有4个原子在同一个平面内。最多有4个原子在同一条直线上。
苯:键角120°,分子平面正六边形。最多有12个原子在同一个平面内。最多有4个原子在同一条直线上。
四是先分析后综合。如:H3C—CH3,最多有4个原子在同一个平面内。CH2CHCH3,最多有7个原子在同一个平面内。C6H5C≡CCHCH2(C6H5—是苯基),最多有18个原子在同一个平面内。
描述CH3CHCHC≡CCF3分子结构的下列叙述中,正确的是(双选)( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
例
【解析】 依基团的结构可将上式写为立体结构并编号如图所示。
①②③④这4个碳原子具有乙烯平面形结构,它们在同一平面上,而不在同一直线上,键角120°;③④⑤⑥这4个碳原子具有乙炔的线形结构,它们在同一直线上,键角为180°。由此可知,这6个碳原子不可能都在同一直线,有可能都在同一平面上。
【答案】 BC
