2011年高一化学精品课件:3.2.2 乙酸(苏教版必修2)
文档属性
| 名称 | 2011年高一化学精品课件:3.2.2 乙酸(苏教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 517.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-24 00:00:00 | ||
图片预览








文档简介
(共45张PPT)
第2课时 乙酸
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
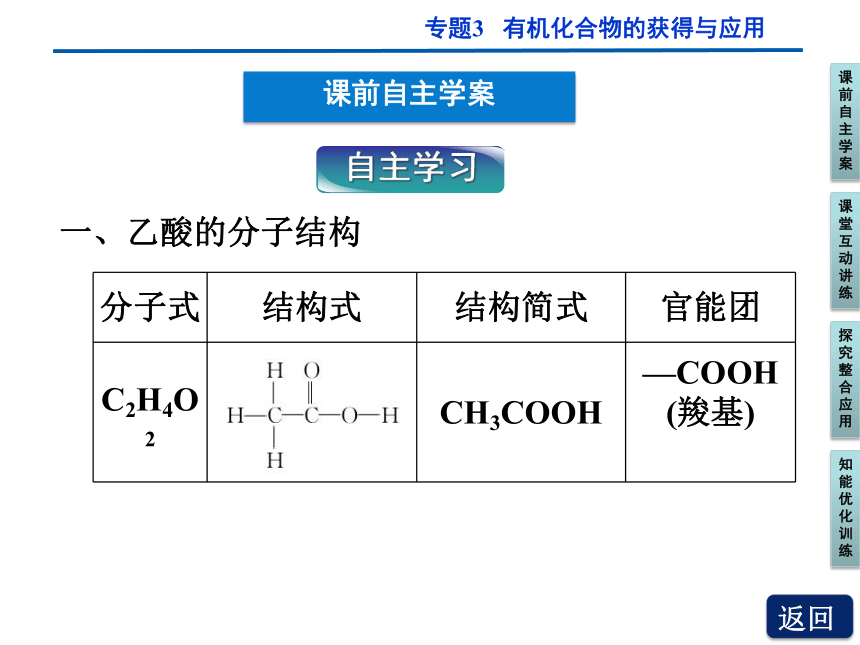
一、乙酸的分子结构
分子式 结构式 结构简式 官能团
C2H4O2 CH3COOH —COOH
(羧基)
1.无水乙酸又称冰醋酸,温度较低时,无水乙酸会凝结成像冰一样的晶体。若在实验室中遇到这种情况时,应如何从试剂瓶中取出无水乙酸?
【提示】 可将试剂瓶用手或热毛巾捂热,也可放在温水浴中温热,待冰醋酸熔化后,倒出即可。
思考感悟
二、乙酸的性质
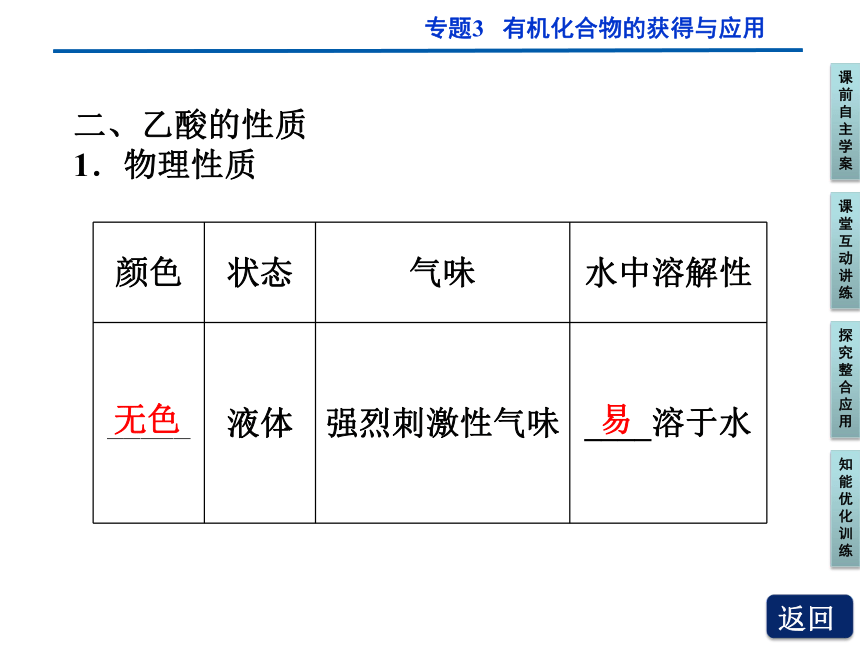
1.物理性质
颜色 状态 气味 水中溶解性
_____ 液体 强烈刺激性气味 ____溶于水
无色
易
2.化学性质
(1)弱酸性
醋酸的电离方程式为:CH3COOH??CH3COO-+H+。
①和指示剂作用:能使石蕊溶液_____。
变红
②和活泼金属反应(如Mg):_________________________________________。
③和金属氧化物反应(如CaO):_________________________________________。
④和碱反应[如Cu(OH)2]:Cu(OH)2+2CH3COOH―→(CH3COO)2Cu+2H2O。
⑤和碳酸盐反应(如Na2CO3):Na2CO3+2CH3COOH―→2CH3COONa+CO2↑+H2O。
Mg+2CH3COOH→(CH3COO)2Mg+H2↑
CaO+2CH3COOH→(CH3COO)2Ca+H2O
酯和水
羟基
氢
思考感悟
2.用结构式表示出乙酸和乙醇发生酯化反应时的断键位置。
【提示】 酯化反应中,酸断开碳氧单键,醇断开氧氢键。如:
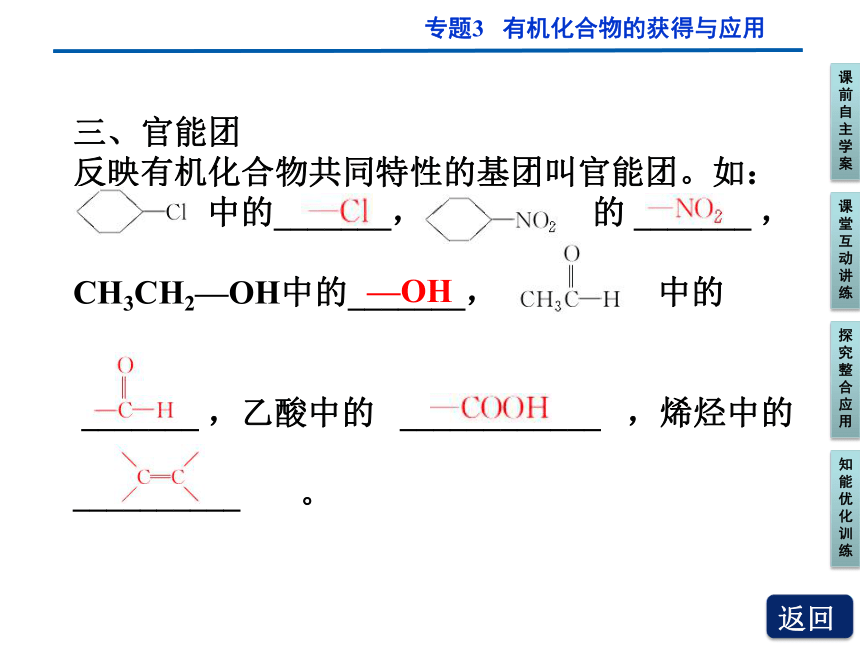
三、官能团
反映有机化合物共同特性的基团叫官能团。如:
中的_______, 中 的 _______ ,
CH3CH2—OH中的_______, 中的
_______ ,乙酸中的 ____________ ,烯烃中的
__________ 。
—OH
自主体验
1.炒菜时,加酒加醋可使莱变得味香可口,原因是( )
A.有盐类物质生成 B.有酸类物质生成
C.有醇类物质生成 D.有酯类物质生成
答案:D
答案:A
3.除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量NaOH溶液洗涤后分液
答案:C
课堂互动讲练
乙酸的酯化反应
2.实验装置
3.实验步骤
(1)在一试管中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL浓H2SO4和2 mL乙酸。
(2)如图连接好装置。
(3)用酒精灯缓慢加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上。
4.实验现象
饱和Na2CO3溶液的液面上有透明的油状液体生成,且能闻到香味。
5.实验结论
乙酸在浓H2SO4并加热的条件下与乙醇反应生成了不溶于水的乙酸乙酯。
6.注意事项
(1)装置
①用酒精灯加热,目的是加快反应速率,使生成的乙酸乙酯及时蒸出,从而提高乙酸的转化率。
②加热前,大试管中常加入几片碎瓷片,目的是防暴沸。
③导气管末端恰好接近液面,目的是防倒吸。
(2)浓硫酸的作用
浓硫酸的作用主要是催化剂、吸水剂。加入浓硫酸可以缩短达到平衡所需时间并促使反应向生成乙酸乙酯的方向进行。
(3)饱和碳酸钠溶液的作用
①与挥发出来的乙酸发生反应,生成可溶于水的乙酸钠,便于闻乙酸乙酯的香味;②溶解挥发出来的乙醇;③减小乙酸乙酯在水中的溶解度,使溶液分层,便于得到酯。
(4)酯的分离
对于生成的酯,通常用分液漏斗进行分液,将酯和饱和碳酸钠溶液分离。
?特别提醒:可用原子示踪法证明酯化反应的实质:用含18O的乙醇参与反应,生成的乙酸乙酯(CH3CO18OC2H5)分子中含18O原子,表明反应物羧酸分子中的羟基与乙醇分子中羟基上的氢原子结合成水,其余部分结合生成酯(即水中的氧原子来自于羧酸)。
(2011年吉安高一检测)下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
例1
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_______________________________________。
【实验步骤】
(1)按丙同学选择的装置组装仪器,在试管中先加入3 mL 乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
【问题讨论】
a.步骤(1)安装好实验装置,加入样品前还应检查__________________________________;
b.写出试管①发生反应的化学方程式(注明反应条件)
_______________________________________;
c.试管②中饱和Na2CO3溶液的作用是___________________________________;
________(填“能”或“不能”)换成NaOH溶液,原因为_______________________________________;
d.从试管②中分离出乙酸乙酯的实验操作是________。
【思路点拨】 解答该题应注意以下三点:
(1)准确找出甲、乙装置的差别,并结合丙的改进之处判断出乙的合理性和丙的优点。
(2)制取气体或有气体参与的实验,组装好仪器后,第一步操作为检查装置气密性。
(3)除杂质的基本原则及物质的分离方法。
【解析】 根据甲、乙装置的差别及丙的改进装置便知应选择乙装置,这样可防止倒吸,这也是改进后干燥管的作用之一。由于乙醇与乙酸均易挥发,因此制取的乙酸乙酯中会混有这两种物质,可用饱和Na2CO3溶液除去乙醇和乙酸,同时还降低了乙酸乙酯的溶解度,所以可用分液的方法分离,但若用NaOH溶液,NaOH会中和CH3COOH,而使乙酸乙酯又全部水解掉,故不能用NaOH溶液。
【答案】 【装置设计】乙 能防止倒吸
变式训练1 实验室制备乙酸乙酯。回答下列问题:
(1)乙醇、乙酸和浓硫酸混合时,应怎样操作?为什么?
答:________________________________________。
(2)反应中浓硫酸的作用是什么?
答:_____________________________________。
(3)反应中乙醇和乙酸的转化率能达到百分之百吗?为什么?
答:________________________________________________________________________。
(4)收集在试管内的乙酸乙酯是浮在碳酸钠溶液上层,还是沉在试管底部,还是与Na2CO3融为一体?为什么?
答:________________________________________________________________________。
解析:乙醇与浓硫酸混合会剧烈放热,若将乙醇倒入浓硫酸中会引起液滴飞溅;由于乙酸乙酯不溶于碳酸钠溶液且浮在上层,故可用分液漏斗加以分离。
答案:(1)乙醇与浓H2SO4混合时放热,因浓H2SO4的密度大于乙醇,所以混合时应向乙醇中边摇动边慢慢加入浓H2SO4,冷却后加乙酸 (2)浓H2SO4是催化剂和吸水剂
(3)不能。因为该反应是可逆反应 (4)浮在上层,因为乙酸乙酯不溶于水且比水轻
正确理解酯化反应
(1)酯化反应机理是:羧酸分子中羧基上的羟基与醇分子中的羟基上的氢原子结合而生成了水,余下部分结合生成酯。即羧酸脱羟基,醇脱氢。
(2)与醇发生酯化反应的酸可以是有机酸,也可以是含氧无机酸,可以是一元酸,也可以是多元酸,醇也可以是一元醇或多元醇。例如:
甲酸甲酯:
丙酸乙酯:
硝化甘油的制取:
乙醇与乙二酸反应:
注意:在书写酯化反应方程式的时候容易漏掉水。
(3)为了促进乙酸乙酯的生成,反应条件为:①加热,②用浓硫酸作催化剂。
苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋是一种常见的有机酸,其结构简式为:
(1)苹果醋中含有的官能团的名称是________________、____________;
(2)苹果醋的分子式为____________________;
(3)1 mol苹果醋与足量金属钠反应,能生成标准状况下的氢气________L;
(4)苹果醋可能发生的反应是________(填字母代号)。
例2
A.与NaOH溶液反应
B.与石蕊试液作用
C.与乙酸在一定条件下酯化
D.与乙醇在一定条件下酯化
【解析】 据苹果醋的结构简式知道该分子中含有的官能团为羧基和羟基,分子式为C4H6O5,因两种官能团均能与Na反应,故1 mol该物质完全反应产生标准状况下H2为1.5 mol×22.4 L/mol=33.6 L。因含羧基,溶液显酸性,能与NaOH溶液反应,加入石蕊试液会变红,与乙醇发生酯化反应,有羟基,能与乙酸发生酯化反应。
【答案】 (1)羟基 羧基 (2)C4H6O5 (3)33.6
(4)ABCD
变式训练2 有机物:①CH2OH(CHOH)4COOH;
②CH3CH2CH2OH;③CH2===CH—CH2OH;
④CH2===CHCOOCH3;⑤CH2===CH—COOH中,能发生加成反应和酯化反应的是( )
A.③⑤ B.①③⑤
C.②④ D.①③
解析:选A。①②不能发生加成反应,④不能发生酯化反应,③⑤均可以,故选A。
探究整合应用
乙醇、水、碳酸、乙酸分子中羟基氢的活泼性
1.设计实验验证
(1)给四种物质编号
①H—OH,② ,③CH3CH2—OH,
④ (碳酸)
(2)设计实验
操作 现象 结论(—OH中H原子活泼性顺序)
a.四种物质各取少量于试管中,各加入紫色石蕊试液两滴 ②、④变红,其他不变 ②、④>①、③
b.在②、④试管中,各加入少量碳酸氢钠溶液 ②中产生气体 ②>④
c.在①、③中各加入少量金属钠 ①产生气体,反应迅速③产生气体,反应缓慢 ①>③
2.实验结论总结
乙醇 水 碳酸 乙酸
—OH中氢原子活泼性
电离程度 非电解质 部分电离 部分电离 部分电离
酸碱性 中性 中性 弱酸性 弱酸性
与Na 反应 反应 反应 反应
与NaOH 不反应 不反应 反应 反应
与NaHCO3 不反应 不反应 不反应 反应
3.意义
应用羟基的活泼性,可以解决有关物质类别的推断的题目。解决时可以先从羟基与Na、NaOH、NaHCO3的反应情况以及量的关系进行比较,最后推断出是醇羟基还是羧基。
为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液)。
例
(1)锥形瓶内装有某种可溶性正盐固体(其中含有3种酸的酸根的其中一种),此固体为________,分液漏斗中所盛试剂是________。
(2)装置B中所盛试剂的名称是__________________,试剂的作用是________________________。
(3)装置C中所盛试剂的名称是______________,出现的现象是____________________。
(4)由实验可知三种酸的酸性大小为____________________________(用化学式表示)。
【解析】 由于CH3COOH可与Na2CO3反应生成CO2,可以证明酸性:CH3COOH>H2CO3;由于CH3COOH具有挥发性,挥发出的CH3COOH对CO2与Na2SiO3溶液的反应有干扰作用,所以事先应除去混在CO2中的CH3COOH蒸气,除去CO2中的CH3COOH蒸气应用饱和的NaHCO3溶液;由于CO2可与NaSiO3溶液反应生成硅酸沉淀(溶液变浑浊),可以证明酸性:H2CO3>H2SiO3。
【答案】 (1)碳酸钠 乙酸
(2)饱和NaHCO3溶液 除去CO2中的CH3COOH蒸气
(3)硅酸钠溶液 有白色浑浊产生
(4)CH3COOH>H2CO3>H2SiO3
第2课时 乙酸
第2课时
课堂互动讲练
知能优化训练
课前自主学案
探究整合应用
课前自主学案
自主学习
一、乙酸的分子结构
分子式 结构式 结构简式 官能团
C2H4O2 CH3COOH —COOH
(羧基)
1.无水乙酸又称冰醋酸,温度较低时,无水乙酸会凝结成像冰一样的晶体。若在实验室中遇到这种情况时,应如何从试剂瓶中取出无水乙酸?
【提示】 可将试剂瓶用手或热毛巾捂热,也可放在温水浴中温热,待冰醋酸熔化后,倒出即可。
思考感悟
二、乙酸的性质
1.物理性质
颜色 状态 气味 水中溶解性
_____ 液体 强烈刺激性气味 ____溶于水
无色
易
2.化学性质
(1)弱酸性
醋酸的电离方程式为:CH3COOH??CH3COO-+H+。
①和指示剂作用:能使石蕊溶液_____。
变红
②和活泼金属反应(如Mg):_________________________________________。
③和金属氧化物反应(如CaO):_________________________________________。
④和碱反应[如Cu(OH)2]:Cu(OH)2+2CH3COOH―→(CH3COO)2Cu+2H2O。
⑤和碳酸盐反应(如Na2CO3):Na2CO3+2CH3COOH―→2CH3COONa+CO2↑+H2O。
Mg+2CH3COOH→(CH3COO)2Mg+H2↑
CaO+2CH3COOH→(CH3COO)2Ca+H2O
酯和水
羟基
氢
思考感悟
2.用结构式表示出乙酸和乙醇发生酯化反应时的断键位置。
【提示】 酯化反应中,酸断开碳氧单键,醇断开氧氢键。如:
三、官能团
反映有机化合物共同特性的基团叫官能团。如:
中的_______, 中 的 _______ ,
CH3CH2—OH中的_______, 中的
_______ ,乙酸中的 ____________ ,烯烃中的
__________ 。
—OH
自主体验
1.炒菜时,加酒加醋可使莱变得味香可口,原因是( )
A.有盐类物质生成 B.有酸类物质生成
C.有醇类物质生成 D.有酯类物质生成
答案:D
答案:A
3.除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量NaOH溶液洗涤后分液
答案:C
课堂互动讲练
乙酸的酯化反应
2.实验装置
3.实验步骤
(1)在一试管中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL浓H2SO4和2 mL乙酸。
(2)如图连接好装置。
(3)用酒精灯缓慢加热,将产生的蒸气经导管通到饱和Na2CO3溶液的液面上。
4.实验现象
饱和Na2CO3溶液的液面上有透明的油状液体生成,且能闻到香味。
5.实验结论
乙酸在浓H2SO4并加热的条件下与乙醇反应生成了不溶于水的乙酸乙酯。
6.注意事项
(1)装置
①用酒精灯加热,目的是加快反应速率,使生成的乙酸乙酯及时蒸出,从而提高乙酸的转化率。
②加热前,大试管中常加入几片碎瓷片,目的是防暴沸。
③导气管末端恰好接近液面,目的是防倒吸。
(2)浓硫酸的作用
浓硫酸的作用主要是催化剂、吸水剂。加入浓硫酸可以缩短达到平衡所需时间并促使反应向生成乙酸乙酯的方向进行。
(3)饱和碳酸钠溶液的作用
①与挥发出来的乙酸发生反应,生成可溶于水的乙酸钠,便于闻乙酸乙酯的香味;②溶解挥发出来的乙醇;③减小乙酸乙酯在水中的溶解度,使溶液分层,便于得到酯。
(4)酯的分离
对于生成的酯,通常用分液漏斗进行分液,将酯和饱和碳酸钠溶液分离。
?特别提醒:可用原子示踪法证明酯化反应的实质:用含18O的乙醇参与反应,生成的乙酸乙酯(CH3CO18OC2H5)分子中含18O原子,表明反应物羧酸分子中的羟基与乙醇分子中羟基上的氢原子结合成水,其余部分结合生成酯(即水中的氧原子来自于羧酸)。
(2011年吉安高一检测)下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
例1
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_______________________________________。
【实验步骤】
(1)按丙同学选择的装置组装仪器,在试管中先加入3 mL 乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
【问题讨论】
a.步骤(1)安装好实验装置,加入样品前还应检查__________________________________;
b.写出试管①发生反应的化学方程式(注明反应条件)
_______________________________________;
c.试管②中饱和Na2CO3溶液的作用是___________________________________;
________(填“能”或“不能”)换成NaOH溶液,原因为_______________________________________;
d.从试管②中分离出乙酸乙酯的实验操作是________。
【思路点拨】 解答该题应注意以下三点:
(1)准确找出甲、乙装置的差别,并结合丙的改进之处判断出乙的合理性和丙的优点。
(2)制取气体或有气体参与的实验,组装好仪器后,第一步操作为检查装置气密性。
(3)除杂质的基本原则及物质的分离方法。
【解析】 根据甲、乙装置的差别及丙的改进装置便知应选择乙装置,这样可防止倒吸,这也是改进后干燥管的作用之一。由于乙醇与乙酸均易挥发,因此制取的乙酸乙酯中会混有这两种物质,可用饱和Na2CO3溶液除去乙醇和乙酸,同时还降低了乙酸乙酯的溶解度,所以可用分液的方法分离,但若用NaOH溶液,NaOH会中和CH3COOH,而使乙酸乙酯又全部水解掉,故不能用NaOH溶液。
【答案】 【装置设计】乙 能防止倒吸
变式训练1 实验室制备乙酸乙酯。回答下列问题:
(1)乙醇、乙酸和浓硫酸混合时,应怎样操作?为什么?
答:________________________________________。
(2)反应中浓硫酸的作用是什么?
答:_____________________________________。
(3)反应中乙醇和乙酸的转化率能达到百分之百吗?为什么?
答:________________________________________________________________________。
(4)收集在试管内的乙酸乙酯是浮在碳酸钠溶液上层,还是沉在试管底部,还是与Na2CO3融为一体?为什么?
答:________________________________________________________________________。
解析:乙醇与浓硫酸混合会剧烈放热,若将乙醇倒入浓硫酸中会引起液滴飞溅;由于乙酸乙酯不溶于碳酸钠溶液且浮在上层,故可用分液漏斗加以分离。
答案:(1)乙醇与浓H2SO4混合时放热,因浓H2SO4的密度大于乙醇,所以混合时应向乙醇中边摇动边慢慢加入浓H2SO4,冷却后加乙酸 (2)浓H2SO4是催化剂和吸水剂
(3)不能。因为该反应是可逆反应 (4)浮在上层,因为乙酸乙酯不溶于水且比水轻
正确理解酯化反应
(1)酯化反应机理是:羧酸分子中羧基上的羟基与醇分子中的羟基上的氢原子结合而生成了水,余下部分结合生成酯。即羧酸脱羟基,醇脱氢。
(2)与醇发生酯化反应的酸可以是有机酸,也可以是含氧无机酸,可以是一元酸,也可以是多元酸,醇也可以是一元醇或多元醇。例如:
甲酸甲酯:
丙酸乙酯:
硝化甘油的制取:
乙醇与乙二酸反应:
注意:在书写酯化反应方程式的时候容易漏掉水。
(3)为了促进乙酸乙酯的生成,反应条件为:①加热,②用浓硫酸作催化剂。
苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋是一种常见的有机酸,其结构简式为:
(1)苹果醋中含有的官能团的名称是________________、____________;
(2)苹果醋的分子式为____________________;
(3)1 mol苹果醋与足量金属钠反应,能生成标准状况下的氢气________L;
(4)苹果醋可能发生的反应是________(填字母代号)。
例2
A.与NaOH溶液反应
B.与石蕊试液作用
C.与乙酸在一定条件下酯化
D.与乙醇在一定条件下酯化
【解析】 据苹果醋的结构简式知道该分子中含有的官能团为羧基和羟基,分子式为C4H6O5,因两种官能团均能与Na反应,故1 mol该物质完全反应产生标准状况下H2为1.5 mol×22.4 L/mol=33.6 L。因含羧基,溶液显酸性,能与NaOH溶液反应,加入石蕊试液会变红,与乙醇发生酯化反应,有羟基,能与乙酸发生酯化反应。
【答案】 (1)羟基 羧基 (2)C4H6O5 (3)33.6
(4)ABCD
变式训练2 有机物:①CH2OH(CHOH)4COOH;
②CH3CH2CH2OH;③CH2===CH—CH2OH;
④CH2===CHCOOCH3;⑤CH2===CH—COOH中,能发生加成反应和酯化反应的是( )
A.③⑤ B.①③⑤
C.②④ D.①③
解析:选A。①②不能发生加成反应,④不能发生酯化反应,③⑤均可以,故选A。
探究整合应用
乙醇、水、碳酸、乙酸分子中羟基氢的活泼性
1.设计实验验证
(1)给四种物质编号
①H—OH,② ,③CH3CH2—OH,
④ (碳酸)
(2)设计实验
操作 现象 结论(—OH中H原子活泼性顺序)
a.四种物质各取少量于试管中,各加入紫色石蕊试液两滴 ②、④变红,其他不变 ②、④>①、③
b.在②、④试管中,各加入少量碳酸氢钠溶液 ②中产生气体 ②>④
c.在①、③中各加入少量金属钠 ①产生气体,反应迅速③产生气体,反应缓慢 ①>③
2.实验结论总结
乙醇 水 碳酸 乙酸
—OH中氢原子活泼性
电离程度 非电解质 部分电离 部分电离 部分电离
酸碱性 中性 中性 弱酸性 弱酸性
与Na 反应 反应 反应 反应
与NaOH 不反应 不反应 反应 反应
与NaHCO3 不反应 不反应 不反应 反应
3.意义
应用羟基的活泼性,可以解决有关物质类别的推断的题目。解决时可以先从羟基与Na、NaOH、NaHCO3的反应情况以及量的关系进行比较,最后推断出是醇羟基还是羧基。
为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液)。
例
(1)锥形瓶内装有某种可溶性正盐固体(其中含有3种酸的酸根的其中一种),此固体为________,分液漏斗中所盛试剂是________。
(2)装置B中所盛试剂的名称是__________________,试剂的作用是________________________。
(3)装置C中所盛试剂的名称是______________,出现的现象是____________________。
(4)由实验可知三种酸的酸性大小为____________________________(用化学式表示)。
【解析】 由于CH3COOH可与Na2CO3反应生成CO2,可以证明酸性:CH3COOH>H2CO3;由于CH3COOH具有挥发性,挥发出的CH3COOH对CO2与Na2SiO3溶液的反应有干扰作用,所以事先应除去混在CO2中的CH3COOH蒸气,除去CO2中的CH3COOH蒸气应用饱和的NaHCO3溶液;由于CO2可与NaSiO3溶液反应生成硅酸沉淀(溶液变浑浊),可以证明酸性:H2CO3>H2SiO3。
【答案】 (1)碳酸钠 乙酸
(2)饱和NaHCO3溶液 除去CO2中的CH3COOH蒸气
(3)硅酸钠溶液 有白色浑浊产生
(4)CH3COOH>H2CO3>H2SiO3
