2020-2021学年高一下化学苏教版(2019)必修二专题六化学反应与能量变化第一单元化学反应速率与反应限度课时练习含答案
文档属性
| 名称 | 2020-2021学年高一下化学苏教版(2019)必修二专题六化学反应与能量变化第一单元化学反应速率与反应限度课时练习含答案 |

|
|
| 格式 | zip | ||
| 文件大小 | 226.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-24 00:00:00 | ||
图片预览



文档简介
高中化学必修第二册专题六化学反应与能量变化第一单元化学反应速率与反应限度课时练习(苏教版2019)
一、单选题
1.一定条件下,将NO2与SO2以一定比例(不是等物质的量)置于恒温恒容的密闭容器中发生反应NO2(g)+SO2(g)SO3(g)+NO(g),下列能说明反应一定达到平衡状态的有(
)
A.混合气体的密度不变
B.反应速率v(NO2):v(SO2):v(SO3):v(NO)=1:1:1:1
C.NO和SO3的体积分数之比保持不变
D.混合气体颜色保持不变
2.在密闭容器中进行下列反应:X2 (g)
+Y2(g)?2Z
(g)。已知X2、Y2和Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时,各物质的浓度有可能是(
)
A.Y2为0.2mol·L-1
B.Z为0.3mol·L-1
C.X2为0.2mol·L-1
D.Z为0.4mol·L-1
3.在社会生活生产中,下列有利于增大反应速率的措施是(
)
A.牛奶放在冰箱中
B.炼铁时将矿石粉碎
C.橡胶制品中添加抑制剂
D.在月饼包装盒内放置小包除氧剂
4.少量铁粉与100mL0.1mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的(
)
A.升高温度(不考虑盐酸挥发)
B.改用10mL
0.1mol/L硝酸
C.加入NaCl溶液
D.滴入几滴硫酸铜溶液
5.探究MnO2对H2O2分解反应速率影响的流程图如下。则下列说法正确的是(
)
A.H2O2从图II
漏斗处加入,实验进行更顺利
B.I、III处均可观察到产生大量气泡,余烬木条复燃
C.实验中先加入H2O2,后加MnO2有利于增大固液接触面
D.上述流程中,先加MnO2再插入带余烬的木条,实验效果更佳
6.已知I2(g)+H2(g)=2HI(g),到达平衡后生成物HI在反应混和物中的百分含量(C%)和反应时间的关系如图,与曲线b相比,曲线a可能是:
①充入一定量H2(g)②升高温度,③使用催化剂④压缩容器体积
A.①②
B.①④
C.②③
D.③④
7.下列食品添加剂中,其使用目的与反应速率有关的是
A.调味剂
B.着色剂
C.抗氧化剂
D.营养强化剂
8.NO和CO都是汽车尾气中的有害物质,它们能缓慢的起反应,反应的化学方程式为2NO+2CO=N2+2CO2,为了控制大气污染,选择最优方案是(
)
A.增加反应时间
B.增大压强
C.使用高效催化剂
D.升高温度
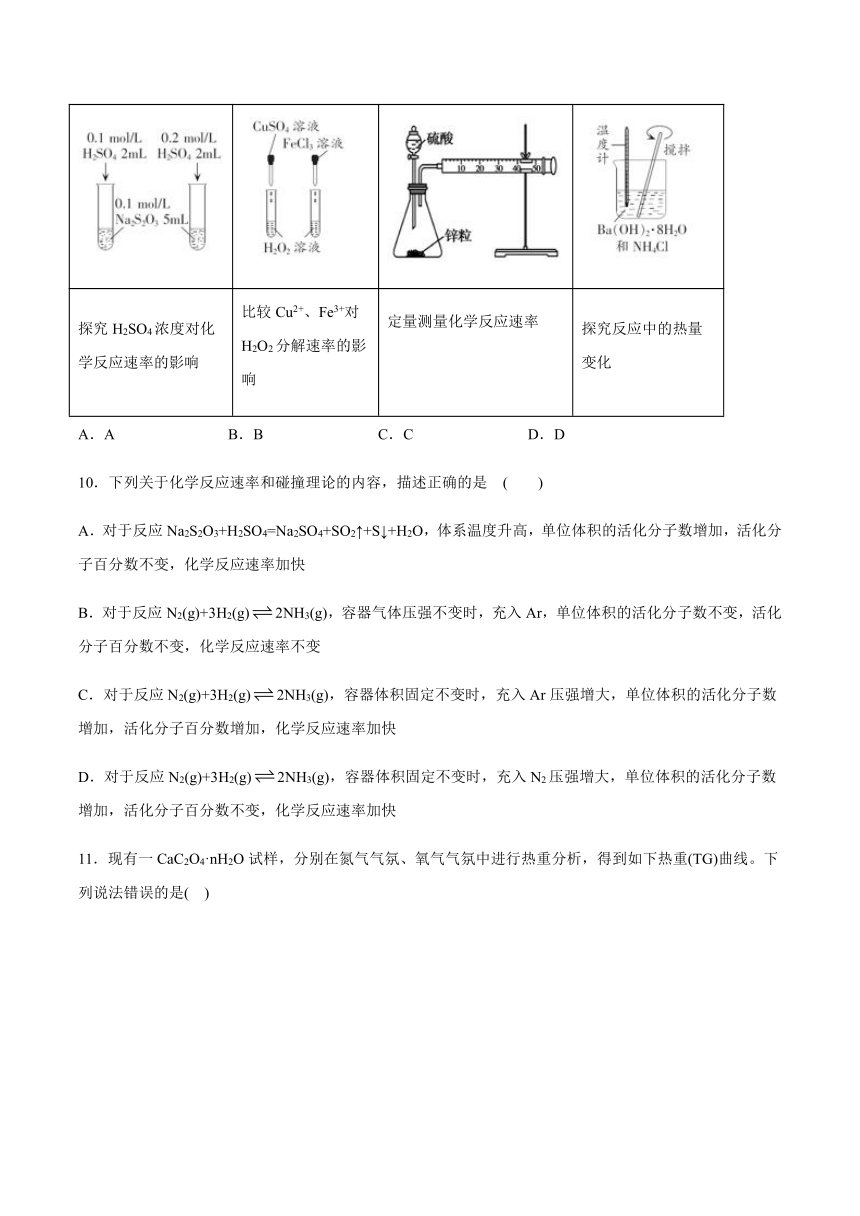
9.下列实验方案,不能达到相应实验目的的是(
)
A
B
C
D
探究H2SO4浓度对化学反应速率的影响
比较Cu2+、Fe3+对H2O2分解速率的影响
定量测量化学反应速率
探究反应中的热量变化
A.A
B.B
C.C
D.D
10.下列关于化学反应速率和碰撞理论的内容,描述正确的是 ( )
A.对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,体系温度升高,单位体积的活化分子数增加,活化分子百分数不变,化学反应速率加快
B.对于反应N2(g)+3H2(g)2NH3(g),容器气体压强不变时,充入Ar,单位体积的活化分子数不变,活化分子百分数不变,化学反应速率不变
C.对于反应N2(g)+3H2(g)2NH3(g),容器体积固定不变时,充入Ar压强增大,单位体积的活化分子数增加,活化分子百分数增加,化学反应速率加快
D.对于反应N2(g)+3H2(g)2NH3(g),容器体积固定不变时,充入N2压强增大,单位体积的活化分子数增加,活化分子百分数不变,化学反应速率加快
11.现有一CaC2O4·nH2O试样,分别在氮气气氛、氧气气氛中进行热重分析,得到如下热重(TG)曲线。下列说法错误的是(
)
A.n的值为1
B.曲线说明氧气是该反应的催化剂
C.400°C-500°C氮气气氛中的反应为CaC2O4CaCO3+CO↑
D.氧气存在时产生CO2会抑制CaCO3CaO+CO2↑进行
12.下列措施对增大化学反应速率明显有效的是
(
)
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.用H2O2制O2时加入MnO2
D.铝与盐酸反应时,加入稀的NaCl溶液
13.在密闭容器中,反应
X(g)
+
2Y(g)2Z(g)
+
W(s)达到平衡后,若将容器体积扩大一倍,对反应产生的影响是
A.v(正)
减小,
v(逆)
增大
B.v(正)
增大,
v(逆)
减小
C.v(正)
、v(逆)
都减小
D.v(正)
、v(逆)
都增大
14.在化学反应中,其他条件不同,仅改变下列其中一个条件,能提高活化分子百分数的是(
)
A.增大反应物浓度
B.增大气体反应压强
C.加入高效催化剂
D.增大固气反应接触面积
15.用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定放出气体的体积。下列选项中正确表示实验X及Y的结果的是
实验
所用的酸
X
25mL
0.2mol/L
Y
50mL
0.1mol/L
A.
B.
C.
D.
二、实验题
16.[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:
0.20
mol·L-1H2C2O4溶液、0.010
mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
。
物理量
V(H2C2O4)/mL
V(蒸馏水)/mL
V(KMnO4)/mL
T/℃
乙
①
2.0
0
4.0
50
②
2.0
0
4.0
25
③
1.0
a
4.0
25
(1)上述实验①、②是探究
____
对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则
a
为_____
;乙是实验需要测量的物理量,则表格中“乙”应填写_________
。
[测定H2C2O4·xH2O
中
x
值]
已知:M(H2C2O4)=90
g·mol-1
①称取
1.260
g
纯草酸晶体,将其酸制成
100.00
mL
水溶液为待测液;
②取
25.00
mL
待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为
0.05
00
mol·L-1
的
KMnO4
标准溶液进行滴定,所用
KMnO4
溶液体积如右图。
(2)请写出与滴定有关反应的离子方程式
_____________
。
(3)本实验滴定达到终点的现象是_____。
(4)通过上述数据,求得
x=
_______。以标准KMnO4
溶液滴定样品溶液的浓度,未用标准
KMnO4
溶液润洗滴定管,引起实验结果_________(偏大、偏小或没有影响)。
17.硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图:
回答下列问题:
(1)
步骤①要去除废铁屑表面的油污,可以采用的最佳方法是______(填选字母)。
A.水洗
B.酸洗
C.碱洗
D.碱煮水洗
E.酸煮水洗
(2)步骤②需要加热的目的是_______,温度保持80~95
℃,采用的合适加热方式是_______。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_____(填标号)。
(3)步骤③中使用足量的H2O2,反应的离子方程式是_________,为了检验该反应还是否存在Fe2+,可加入黄色铁氰化钾溶液,反应的离子方程式是________。实验中,分批加入H2O2,不仅可不引入杂质,同时为了防止__________,溶液还要保持pH小于0.5。
(4)
步骤⑤的具体实验操作有加热浓缩、冷却结晶、过滤(洗涤),经干燥得到硫酸铁铵晶体样品。采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150
℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______。
18.某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验
1
2
3
4
5
6
4mol·mol-1H2SO4/mL
40
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
①请完成此实验设计,其中:饱和CuSO4溶液的体积V6是___
mL;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,随着加入的CuSO4溶液增多时,生成氢气的速率会___(填加快、减慢或不变),请分析CuSO4溶液增多时,速率发生变化可能的原因是___。
19.溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:
实验编号
①
②
③
④
⑤
温度/℃
30
40
50
60
70
显色时间/s
160
80
40
20
10
(1)该反应的离子方程式为_____________。
(2)该实验的目的是探究___________对反应速率的影响。
(3)实验试剂除了溶液、溶液外,还需要的指示剂是________。实验仪器除了试管、试剂瓶、胶头滴管、温度计外,还需要的仪器是___________。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________(填字母)。
A.温度
B.指示剂的浓度
C.试剂的用量(体积)
D.试剂添加的顺序
(5)由上述实验记录可得出的结论是温度每升高,反应速率增大为原来的____倍。
(6)若要进行酸性强弱对反应速率的影响的探究实验,你会采取的措施是_______。
参考答案
1.D2.B3.B4.A5.C6.D7.C8.C9.B10.D11.B12.C13.C14.C15.A
16.温度
1.0
溶液褪色时间/s
5H2C2O4+2+6H+=10CO2↑+2Mn2++8H2O
当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
2
偏小
17.D
加快反应速率
热水浴
C
2Fe2++2H++H2O2=2Fe3++2H2O
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
Fe3+水解
NH4Fe(SO4)2·12H2O
18.CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
10
减慢
当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积
19.
温度
淀粉溶液
秒表
BCD
2
保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
一、单选题
1.一定条件下,将NO2与SO2以一定比例(不是等物质的量)置于恒温恒容的密闭容器中发生反应NO2(g)+SO2(g)SO3(g)+NO(g),下列能说明反应一定达到平衡状态的有(
)
A.混合气体的密度不变
B.反应速率v(NO2):v(SO2):v(SO3):v(NO)=1:1:1:1
C.NO和SO3的体积分数之比保持不变
D.混合气体颜色保持不变
2.在密闭容器中进行下列反应:X2 (g)
+Y2(g)?2Z
(g)。已知X2、Y2和Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时,各物质的浓度有可能是(
)
A.Y2为0.2mol·L-1
B.Z为0.3mol·L-1
C.X2为0.2mol·L-1
D.Z为0.4mol·L-1
3.在社会生活生产中,下列有利于增大反应速率的措施是(
)
A.牛奶放在冰箱中
B.炼铁时将矿石粉碎
C.橡胶制品中添加抑制剂
D.在月饼包装盒内放置小包除氧剂
4.少量铁粉与100mL0.1mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的(
)
A.升高温度(不考虑盐酸挥发)
B.改用10mL
0.1mol/L硝酸
C.加入NaCl溶液
D.滴入几滴硫酸铜溶液
5.探究MnO2对H2O2分解反应速率影响的流程图如下。则下列说法正确的是(
)
A.H2O2从图II
漏斗处加入,实验进行更顺利
B.I、III处均可观察到产生大量气泡,余烬木条复燃
C.实验中先加入H2O2,后加MnO2有利于增大固液接触面
D.上述流程中,先加MnO2再插入带余烬的木条,实验效果更佳
6.已知I2(g)+H2(g)=2HI(g),到达平衡后生成物HI在反应混和物中的百分含量(C%)和反应时间的关系如图,与曲线b相比,曲线a可能是:
①充入一定量H2(g)②升高温度,③使用催化剂④压缩容器体积
A.①②
B.①④
C.②③
D.③④
7.下列食品添加剂中,其使用目的与反应速率有关的是
A.调味剂
B.着色剂
C.抗氧化剂
D.营养强化剂
8.NO和CO都是汽车尾气中的有害物质,它们能缓慢的起反应,反应的化学方程式为2NO+2CO=N2+2CO2,为了控制大气污染,选择最优方案是(
)
A.增加反应时间
B.增大压强
C.使用高效催化剂
D.升高温度
9.下列实验方案,不能达到相应实验目的的是(
)
A
B
C
D
探究H2SO4浓度对化学反应速率的影响
比较Cu2+、Fe3+对H2O2分解速率的影响
定量测量化学反应速率
探究反应中的热量变化
A.A
B.B
C.C
D.D
10.下列关于化学反应速率和碰撞理论的内容,描述正确的是 ( )
A.对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,体系温度升高,单位体积的活化分子数增加,活化分子百分数不变,化学反应速率加快
B.对于反应N2(g)+3H2(g)2NH3(g),容器气体压强不变时,充入Ar,单位体积的活化分子数不变,活化分子百分数不变,化学反应速率不变
C.对于反应N2(g)+3H2(g)2NH3(g),容器体积固定不变时,充入Ar压强增大,单位体积的活化分子数增加,活化分子百分数增加,化学反应速率加快
D.对于反应N2(g)+3H2(g)2NH3(g),容器体积固定不变时,充入N2压强增大,单位体积的活化分子数增加,活化分子百分数不变,化学反应速率加快
11.现有一CaC2O4·nH2O试样,分别在氮气气氛、氧气气氛中进行热重分析,得到如下热重(TG)曲线。下列说法错误的是(
)
A.n的值为1
B.曲线说明氧气是该反应的催化剂
C.400°C-500°C氮气气氛中的反应为CaC2O4CaCO3+CO↑
D.氧气存在时产生CO2会抑制CaCO3CaO+CO2↑进行
12.下列措施对增大化学反应速率明显有效的是
(
)
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.用H2O2制O2时加入MnO2
D.铝与盐酸反应时,加入稀的NaCl溶液
13.在密闭容器中,反应
X(g)
+
2Y(g)2Z(g)
+
W(s)达到平衡后,若将容器体积扩大一倍,对反应产生的影响是
A.v(正)
减小,
v(逆)
增大
B.v(正)
增大,
v(逆)
减小
C.v(正)
、v(逆)
都减小
D.v(正)
、v(逆)
都增大
14.在化学反应中,其他条件不同,仅改变下列其中一个条件,能提高活化分子百分数的是(
)
A.增大反应物浓度
B.增大气体反应压强
C.加入高效催化剂
D.增大固气反应接触面积
15.用如图所示的实验装置进行实验X及Y时,每隔半分钟分别测定放出气体的体积。下列选项中正确表示实验X及Y的结果的是
实验
所用的酸
X
25mL
0.2mol/L
Y
50mL
0.1mol/L
A.
B.
C.
D.
二、实验题
16.[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:
0.20
mol·L-1H2C2O4溶液、0.010
mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
。
物理量
V(H2C2O4)/mL
V(蒸馏水)/mL
V(KMnO4)/mL
T/℃
乙
①
2.0
0
4.0
50
②
2.0
0
4.0
25
③
1.0
a
4.0
25
(1)上述实验①、②是探究
____
对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则
a
为_____
;乙是实验需要测量的物理量,则表格中“乙”应填写_________
。
[测定H2C2O4·xH2O
中
x
值]
已知:M(H2C2O4)=90
g·mol-1
①称取
1.260
g
纯草酸晶体,将其酸制成
100.00
mL
水溶液为待测液;
②取
25.00
mL
待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为
0.05
00
mol·L-1
的
KMnO4
标准溶液进行滴定,所用
KMnO4
溶液体积如右图。
(2)请写出与滴定有关反应的离子方程式
_____________
。
(3)本实验滴定达到终点的现象是_____。
(4)通过上述数据,求得
x=
_______。以标准KMnO4
溶液滴定样品溶液的浓度,未用标准
KMnO4
溶液润洗滴定管,引起实验结果_________(偏大、偏小或没有影响)。
17.硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图:
回答下列问题:
(1)
步骤①要去除废铁屑表面的油污,可以采用的最佳方法是______(填选字母)。
A.水洗
B.酸洗
C.碱洗
D.碱煮水洗
E.酸煮水洗
(2)步骤②需要加热的目的是_______,温度保持80~95
℃,采用的合适加热方式是_______。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_____(填标号)。
(3)步骤③中使用足量的H2O2,反应的离子方程式是_________,为了检验该反应还是否存在Fe2+,可加入黄色铁氰化钾溶液,反应的离子方程式是________。实验中,分批加入H2O2,不仅可不引入杂质,同时为了防止__________,溶液还要保持pH小于0.5。
(4)
步骤⑤的具体实验操作有加热浓缩、冷却结晶、过滤(洗涤),经干燥得到硫酸铁铵晶体样品。采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150
℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______。
18.某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验
1
2
3
4
5
6
4mol·mol-1H2SO4/mL
40
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
①请完成此实验设计,其中:饱和CuSO4溶液的体积V6是___
mL;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,随着加入的CuSO4溶液增多时,生成氢气的速率会___(填加快、减慢或不变),请分析CuSO4溶液增多时,速率发生变化可能的原因是___。
19.溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:
实验编号
①
②
③
④
⑤
温度/℃
30
40
50
60
70
显色时间/s
160
80
40
20
10
(1)该反应的离子方程式为_____________。
(2)该实验的目的是探究___________对反应速率的影响。
(3)实验试剂除了溶液、溶液外,还需要的指示剂是________。实验仪器除了试管、试剂瓶、胶头滴管、温度计外,还需要的仪器是___________。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________(填字母)。
A.温度
B.指示剂的浓度
C.试剂的用量(体积)
D.试剂添加的顺序
(5)由上述实验记录可得出的结论是温度每升高,反应速率增大为原来的____倍。
(6)若要进行酸性强弱对反应速率的影响的探究实验,你会采取的措施是_______。
参考答案
1.D2.B3.B4.A5.C6.D7.C8.C9.B10.D11.B12.C13.C14.C15.A
16.温度
1.0
溶液褪色时间/s
5H2C2O4+2+6H+=10CO2↑+2Mn2++8H2O
当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
2
偏小
17.D
加快反应速率
热水浴
C
2Fe2++2H++H2O2=2Fe3++2H2O
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
Fe3+水解
NH4Fe(SO4)2·12H2O
18.CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
10
减慢
当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积
19.
温度
淀粉溶液
秒表
BCD
2
保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
