2020-2021学年高一下化学苏教版(2019)必修二专题七氨与社会可持续发展第二单元重要的含氮化工原料课时练习含答案
文档属性
| 名称 | 2020-2021学年高一下化学苏教版(2019)必修二专题七氨与社会可持续发展第二单元重要的含氮化工原料课时练习含答案 |

|
|
| 格式 | zip | ||
| 文件大小 | 559.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-24 00:00:00 | ||
图片预览


文档简介
高中化学必修第二册专题七氨与社会可持续发展第二单元重要的含氮化工原料课时练习(苏教版2019)
一、单选题
1.铜与足量浓硝酸反应,得到硝酸铜溶液和由、、组成的混合气体,这些气体与(标准状况)混合后通入水中,能完全被水吸收生成硝酸。则消耗铜的质量为(
)
A.
B.
C.
D.
2.在一定条件下,硝酸与下列物质均能发生反应,其中硝酸只表现出氧化性的是
A.氢氧化铁
B.碳酸钠
C.木炭
D.镁
3.下列物质中,能使石蕊试液最终变红的是(
)
A.
SO2
B.Na2O2
C.Cl2
D.NH3
4.下列气体中能用碱石灰干燥的是
A.HCl
B.CO2
C.NH3
D.Cl2
5.硝酸亚铁溶液中存在下列主要平衡关系:Fe2++2H2O?Fe(OH)2+2H+,若加入HCl,则溶液的颜色主要变化是(
)
A.变黄
B.绿色变浅
C.绿色加深
D.无明显变化
6.利用如图所示装置及相关试剂可得到纯净的目标气体的是(
)
目标气体
杂质气体
装置中盛有的试剂
A
水蒸气
浓硫酸
B
HCl
饱和溶液
C
水蒸气
浓硫酸
D
NO
NO2
水
A.A
B.B
C.C
D.D
7.下列试剂的存放方法错误的是(
)
A.浓硝酸存放在棕色试剂瓶中
B.溴水放在带玻璃塞的试剂瓶中
C.白磷浸在盛有CS2的试剂瓶中
D.金属钠保存在盛有煤油的试剂瓶中
8.下列有关物质性质和用途说法错误的是
A.液氨可用作制冷剂
B.MgO熔点很高,可用于制造耐火材料
C.SO2可用作食品防腐剂
D.ClO2可用于杀菌消毒,H2O2不可以
9.实验室模拟合成氨和氨催化氧化的实验装置如下图。反应一段时间后向丙中通入O2并伸入红热的铂丝,锥形瓶中有红棕色气体出现。下列说法错误的是( )
A.分离液态空气制取氮气的依据是氮气和氧气的沸点不同
B.氮气和氢气通过甲装置混合,其主要作用是干燥和控制气体流速
C.丙中导气管不会发生倒吸的原因可能是反应中氨的产率较少
D.丙的溶液和棉花中均存在
,说明直接发生反应NH3+2O2
HNO3+H2O
10.将1.92
g铜投入10
mL一定浓度的硝酸中,铜完全溶解,产生标准状况下的NO和NO2混合气体共672
mL。反应结束后向溶液中加入70
mL1
mol/L的NaOH,恰好使溶液中的Cu2+全部转化为沉淀。若将盛有生成的气体的容器倒扣在水中,通入标准状况下一定体积的氧气,又可将气体完全转化为NO。则下列判断正确的是( )
A.体现酸性的硝酸0.03
mol
B.NO体积为336
mL
C.原硝酸浓度9
mol/L
D.通入氧气的体积504
mL
11.在标准状况下,将1.92
g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到NO2和NO混合气体
1.12
L,则混合气体中NO的体积为(
)
A.1120
mL
B.1008
mL
C.224
mL
D.112
mL
12.下列有关说法中,
正确的是
A.氯气通入KBr溶液中,
无明显现象产生
B.CO2通入BaCl2溶液中,
出现白色沉淀
C.足量氨气通入氯化铝溶液中,
出现白色沉淀
D.加热盛有浓H2SO4和木炭的试管,有无色无味的气体产生
13.下列物质的用途不正确的是
A
B
C
D
物质
硅(Si)
生石灰(CaO)
液氨(NH3)
亚硝酸钠(NaNO2)
用途
半导体材料
抗氧化剂
制冷剂
食品防腐剂
A.A
B.B
C.C
D.D
14.做过银镜反应的试管,最好选用的洗涤剂是:
(
)
A.稀HNO3
B.稀盐酸
C.稀氨水
D.烧碱溶液
15.下列变化一定属于化学变化的是(
)
①导电
②爆炸
③缓慢氧化
④SO2使品红褪色
⑤无水硫酸铜由白变蓝
⑥工业制O2
⑦白磷转化为红磷
⑧久置的浓硝酸变黄
A.②③⑥⑦
B.④⑤⑦⑧
C.②③④⑦⑧
D.③④⑤⑦⑧
二、实验题
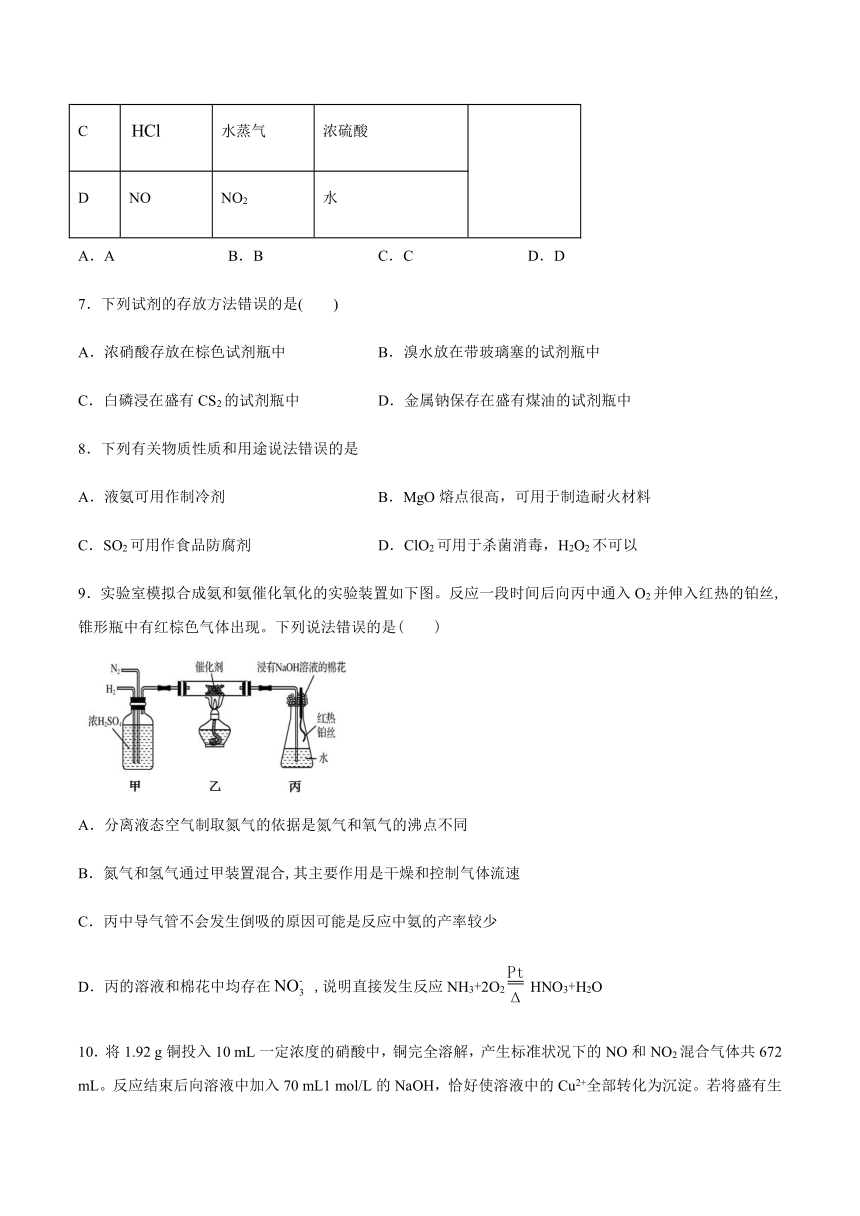
16.外观与NaCl相似的亚硝酸钠(NaNO2)可用作建筑钢材缓蚀剂。某学习小组设计如下装置制备亚硝酸钠(夹持装置已省略)。
已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3。
(1)装置A中发生反应的离子方程式为______。
(2)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡后再关上止水夹K。
①通入N2的目的是______,若实验时观察到______,说明通入N2未达到预期目的。
②若通入N2未达到预期目的,装置B可除去NO中的NO2杂质,该反应的化学方程式为______。
(3)实验时装置D中的实验现象是______。
(4)装置C、E不可省去,省去会导致产品中混有杂质______和______。
(5)装置F的作用是______。
17.下图所示装置是某化学小组模拟工业生产制取,其中a为一个可持续鼓入空气的橡皮球。
请回答下列问题:
(1)写出装置B中发生反应的化学方程式
______。
(2)已知
1mol与液态水反应生成溶液和NO气体放出热量46kJ写出该反应的热化学方程式______;该反应是一个可逆反应,欲要提高的转化率,可采取的措施是
______(填序号)。
A.升高温度
B.降低温度
C.增大压强
D.减小压强
(3)装置C中浓硫酸的作用是______。
(4)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,现象是______。
(5)实验室制取也可以用浓氨水与生石灰反应,反应的化学方程式为______。
(6)干燥管中的碱石灰用于干燥,某同学想用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置未画)进行验证。实验步骤如下:
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是______,由此该同学得出结论:不能用代替碱石灰来干燥氨气。
18.一位同学在复习时遇到这样一道习题:某无色溶液中可能含有H+、OH-、Na+、NO,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。已知:铝与稀硝酸反应时,主要生成气体NO,NO在空气中会进一步氧化为红棕色气体的NO2。
(1)未开始实验前,_______(选填“能”、“不能”)确定溶液的酸碱性;加入铝粉产生H2,说明铝具有_______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO就不能大量存在。设计实验证实如下:
装置
现象
ⅰ.实验初始,未见明显现象
ⅱ.过一会儿,出现气泡,液面上方呈浅棕色
ⅲ.试管变热,溶液沸腾
①盐酸溶解Al2O3薄膜的离子方程式是_______。
②根据现象ⅱ,推测溶液中产生了NO,将生成NO的离子方程式补充完整:_______。
_______Al+_______NO+_______=_______Al3++_______NO↑+_______。
(3)再假设:若OH-大量存在,NO也可能大量存在。重新设计实验证实如下:
装置
现象
ⅰ.实验初始,未见明显现象
ⅱ.过一会儿,出现气泡,有刺激性气味,经检验该气体含NH3
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是_______,该反应的氧化剂为:_______
(5)由上述实验得出:该溶液的溶质为_______。
三、计算题
19.将等物质的量的铁和铜的混合物24g与600mL稀硝酸恰好完全反应,生成NO6.72L(标准状况),向反应后的溶液中加入lmol·L-1NaOH溶液使金属离子恰好沉淀,过滤。计算并回答下列问题:
(1)稀硝酸的物质的量浓度是___________mol·L-1.
(2)最后所得沉淀在空气中充分加热可得固体的质量为___________。
参考答案
1.B2.C3.A4.C5.A6.C7.C8.D9.D10.B11.D12.C13.B14.A15.D
16.3Cu+8H++2NO=3Cu2++2NO↑+4H2O
除去装置中的空气
A中气体变为红棕色
3NO2+H2O=2HNO3+NO
淡黄色固体转变为白色(无色)固体
NaOH
NaNO3
吸收尾气NO,防止污染空气
17.
BC
干燥气体、吸收多余的
集气瓶中气体颜色变浅
气球膨胀
18.能
还原性
Al2O3+6H+=2Al3++3H2O
Al+
NO+4H+═Al3++NO↑+2H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
H2O
NaOH
19.2
32g
一、单选题
1.铜与足量浓硝酸反应,得到硝酸铜溶液和由、、组成的混合气体,这些气体与(标准状况)混合后通入水中,能完全被水吸收生成硝酸。则消耗铜的质量为(
)
A.
B.
C.
D.
2.在一定条件下,硝酸与下列物质均能发生反应,其中硝酸只表现出氧化性的是
A.氢氧化铁
B.碳酸钠
C.木炭
D.镁
3.下列物质中,能使石蕊试液最终变红的是(
)
A.
SO2
B.Na2O2
C.Cl2
D.NH3
4.下列气体中能用碱石灰干燥的是
A.HCl
B.CO2
C.NH3
D.Cl2
5.硝酸亚铁溶液中存在下列主要平衡关系:Fe2++2H2O?Fe(OH)2+2H+,若加入HCl,则溶液的颜色主要变化是(
)
A.变黄
B.绿色变浅
C.绿色加深
D.无明显变化
6.利用如图所示装置及相关试剂可得到纯净的目标气体的是(
)
目标气体
杂质气体
装置中盛有的试剂
A
水蒸气
浓硫酸
B
HCl
饱和溶液
C
水蒸气
浓硫酸
D
NO
NO2
水
A.A
B.B
C.C
D.D
7.下列试剂的存放方法错误的是(
)
A.浓硝酸存放在棕色试剂瓶中
B.溴水放在带玻璃塞的试剂瓶中
C.白磷浸在盛有CS2的试剂瓶中
D.金属钠保存在盛有煤油的试剂瓶中
8.下列有关物质性质和用途说法错误的是
A.液氨可用作制冷剂
B.MgO熔点很高,可用于制造耐火材料
C.SO2可用作食品防腐剂
D.ClO2可用于杀菌消毒,H2O2不可以
9.实验室模拟合成氨和氨催化氧化的实验装置如下图。反应一段时间后向丙中通入O2并伸入红热的铂丝,锥形瓶中有红棕色气体出现。下列说法错误的是( )
A.分离液态空气制取氮气的依据是氮气和氧气的沸点不同
B.氮气和氢气通过甲装置混合,其主要作用是干燥和控制气体流速
C.丙中导气管不会发生倒吸的原因可能是反应中氨的产率较少
D.丙的溶液和棉花中均存在
,说明直接发生反应NH3+2O2
HNO3+H2O
10.将1.92
g铜投入10
mL一定浓度的硝酸中,铜完全溶解,产生标准状况下的NO和NO2混合气体共672
mL。反应结束后向溶液中加入70
mL1
mol/L的NaOH,恰好使溶液中的Cu2+全部转化为沉淀。若将盛有生成的气体的容器倒扣在水中,通入标准状况下一定体积的氧气,又可将气体完全转化为NO。则下列判断正确的是( )
A.体现酸性的硝酸0.03
mol
B.NO体积为336
mL
C.原硝酸浓度9
mol/L
D.通入氧气的体积504
mL
11.在标准状况下,将1.92
g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到NO2和NO混合气体
1.12
L,则混合气体中NO的体积为(
)
A.1120
mL
B.1008
mL
C.224
mL
D.112
mL
12.下列有关说法中,
正确的是
A.氯气通入KBr溶液中,
无明显现象产生
B.CO2通入BaCl2溶液中,
出现白色沉淀
C.足量氨气通入氯化铝溶液中,
出现白色沉淀
D.加热盛有浓H2SO4和木炭的试管,有无色无味的气体产生
13.下列物质的用途不正确的是
A
B
C
D
物质
硅(Si)
生石灰(CaO)
液氨(NH3)
亚硝酸钠(NaNO2)
用途
半导体材料
抗氧化剂
制冷剂
食品防腐剂
A.A
B.B
C.C
D.D
14.做过银镜反应的试管,最好选用的洗涤剂是:
(
)
A.稀HNO3
B.稀盐酸
C.稀氨水
D.烧碱溶液
15.下列变化一定属于化学变化的是(
)
①导电
②爆炸
③缓慢氧化
④SO2使品红褪色
⑤无水硫酸铜由白变蓝
⑥工业制O2
⑦白磷转化为红磷
⑧久置的浓硝酸变黄
A.②③⑥⑦
B.④⑤⑦⑧
C.②③④⑦⑧
D.③④⑤⑦⑧
二、实验题
16.外观与NaCl相似的亚硝酸钠(NaNO2)可用作建筑钢材缓蚀剂。某学习小组设计如下装置制备亚硝酸钠(夹持装置已省略)。
已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3。
(1)装置A中发生反应的离子方程式为______。
(2)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡后再关上止水夹K。
①通入N2的目的是______,若实验时观察到______,说明通入N2未达到预期目的。
②若通入N2未达到预期目的,装置B可除去NO中的NO2杂质,该反应的化学方程式为______。
(3)实验时装置D中的实验现象是______。
(4)装置C、E不可省去,省去会导致产品中混有杂质______和______。
(5)装置F的作用是______。
17.下图所示装置是某化学小组模拟工业生产制取,其中a为一个可持续鼓入空气的橡皮球。
请回答下列问题:
(1)写出装置B中发生反应的化学方程式
______。
(2)已知
1mol与液态水反应生成溶液和NO气体放出热量46kJ写出该反应的热化学方程式______;该反应是一个可逆反应,欲要提高的转化率,可采取的措施是
______(填序号)。
A.升高温度
B.降低温度
C.增大压强
D.减小压强
(3)装置C中浓硫酸的作用是______。
(4)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,现象是______。
(5)实验室制取也可以用浓氨水与生石灰反应,反应的化学方程式为______。
(6)干燥管中的碱石灰用于干燥,某同学想用无水氯化钙代替碱石灰,并设计如图所示装置(仪器固定装置未画)进行验证。实验步骤如下:
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是______,由此该同学得出结论:不能用代替碱石灰来干燥氨气。
18.一位同学在复习时遇到这样一道习题:某无色溶液中可能含有H+、OH-、Na+、NO,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。已知:铝与稀硝酸反应时,主要生成气体NO,NO在空气中会进一步氧化为红棕色气体的NO2。
(1)未开始实验前,_______(选填“能”、“不能”)确定溶液的酸碱性;加入铝粉产生H2,说明铝具有_______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO就不能大量存在。设计实验证实如下:
装置
现象
ⅰ.实验初始,未见明显现象
ⅱ.过一会儿,出现气泡,液面上方呈浅棕色
ⅲ.试管变热,溶液沸腾
①盐酸溶解Al2O3薄膜的离子方程式是_______。
②根据现象ⅱ,推测溶液中产生了NO,将生成NO的离子方程式补充完整:_______。
_______Al+_______NO+_______=_______Al3++_______NO↑+_______。
(3)再假设:若OH-大量存在,NO也可能大量存在。重新设计实验证实如下:
装置
现象
ⅰ.实验初始,未见明显现象
ⅱ.过一会儿,出现气泡,有刺激性气味,经检验该气体含NH3
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是_______,该反应的氧化剂为:_______
(5)由上述实验得出:该溶液的溶质为_______。
三、计算题
19.将等物质的量的铁和铜的混合物24g与600mL稀硝酸恰好完全反应,生成NO6.72L(标准状况),向反应后的溶液中加入lmol·L-1NaOH溶液使金属离子恰好沉淀,过滤。计算并回答下列问题:
(1)稀硝酸的物质的量浓度是___________mol·L-1.
(2)最后所得沉淀在空气中充分加热可得固体的质量为___________。
参考答案
1.B2.C3.A4.C5.A6.C7.C8.D9.D10.B11.D12.C13.B14.A15.D
16.3Cu+8H++2NO=3Cu2++2NO↑+4H2O
除去装置中的空气
A中气体变为红棕色
3NO2+H2O=2HNO3+NO
淡黄色固体转变为白色(无色)固体
NaOH
NaNO3
吸收尾气NO,防止污染空气
17.
BC
干燥气体、吸收多余的
集气瓶中气体颜色变浅
气球膨胀
18.能
还原性
Al2O3+6H+=2Al3++3H2O
Al+
NO+4H+═Al3++NO↑+2H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
H2O
NaOH
19.2
32g
