安徽省安庆市九一六中学校2020-2021学年高一下学期开学考试化学试题 图片版含答案
文档属性
| 名称 | 安徽省安庆市九一六中学校2020-2021学年高一下学期开学考试化学试题 图片版含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-24 00:00:00 | ||
图片预览


文档简介
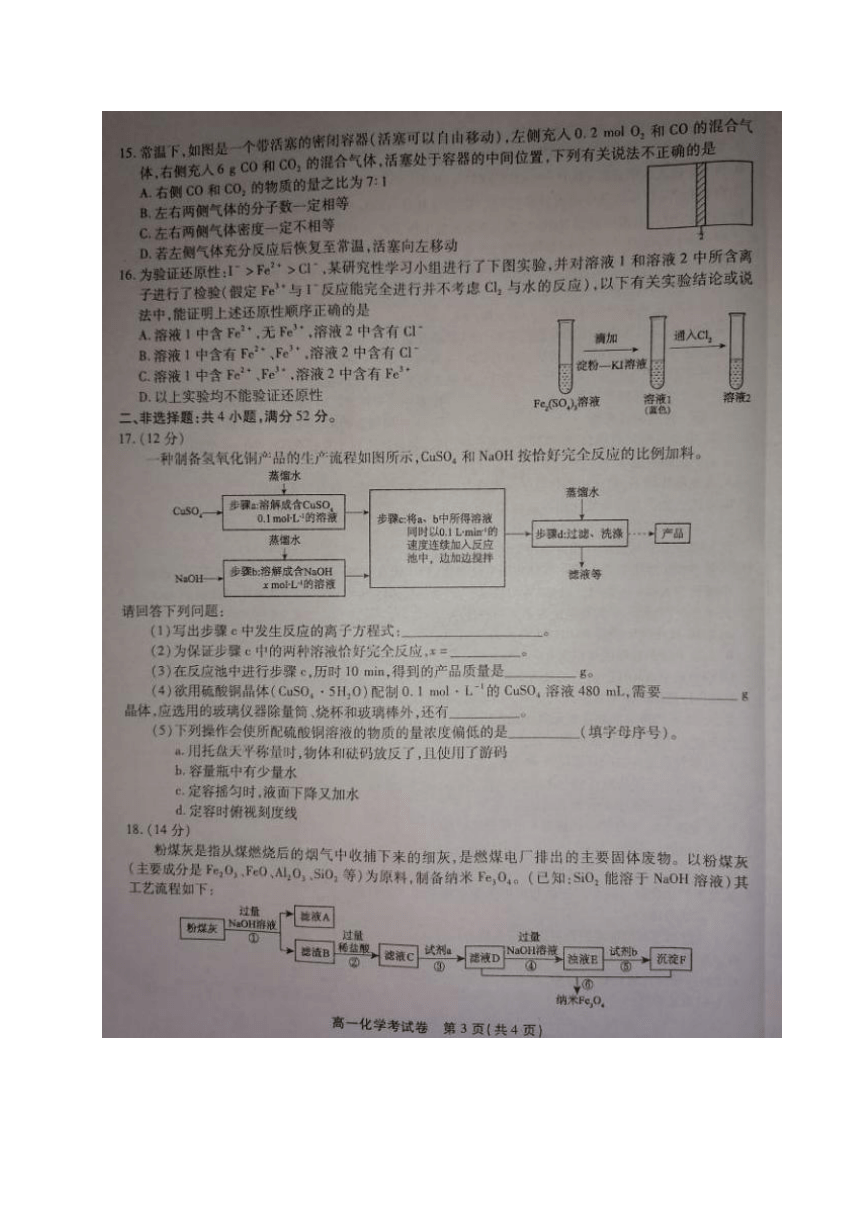
(4)12.5500mL容量瓶、胶头滴管(只写一个且正确得1分,容量瓶不写规格不得分)
(5)a、c(选不全给1分,错选不给分
【解析】(1)CuSO4和NaOH溶液反应的离子方程式为
Cu(OH),y
(2)两种溶液恰好完全反应时,CuSO4和NaOH的物质的量之比为1:2,所以x=0.2
(3)10min时,CusO4的物质的量为0.1mol,产品Cu(OH)2的质量为0.1×98=9.8g
(4)欲配置480
mL
CusO溶液,实际应配制500mL溶液,需要硫酸铜晶体的质量为0.1mol·L
容量瓶、胶头
(5)a.用托盘天平称量时,物体和砝码放反了,且使用了游码,称量的固体质量偏小,所配溶液的物
质的量浓度偏低
h.容量瓶中有少量水,无影响
定容摇匀时,液面下降,是由于液体在瓶塞处损耗,对结果无影响,又加水将导致所配溶液的物质
的量浓度偏低
d.定容时俯视刻度线,水加少了,所配溶液的物质的量浓度偏高。故选a
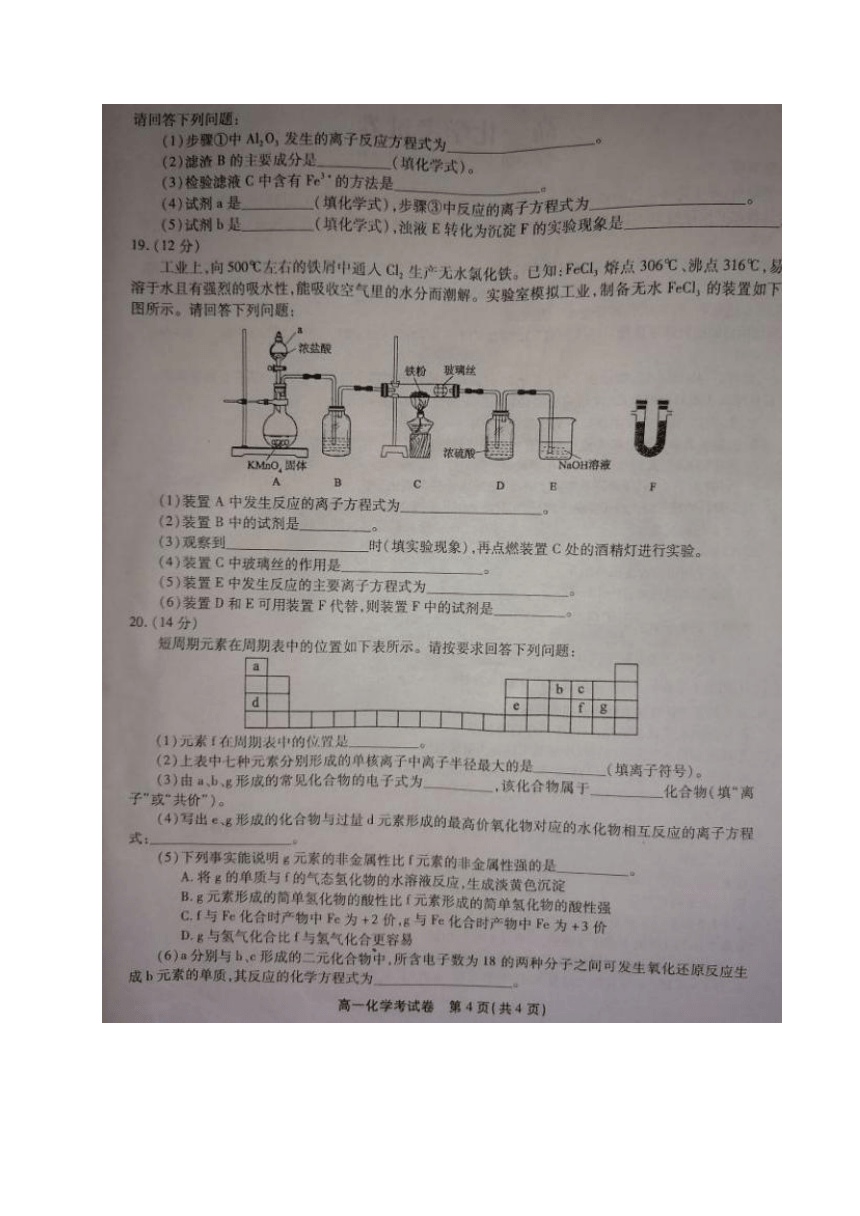
18.(共14分,每空2分)
H,O
(2)Fe2O3FeO(填一个得1分
(3)取少量滤液C于试管中,滴加KsCN溶液,若溶液变红,则原溶液中含有Fe3
(4)Fe
Fe
+2Fe
=3Fe
(5)02或H2O2白色沉淀迅速变为灰绿色沉淀最终变为红褐色沉淀
【解析】(1)过量NaOH溶液可溶解粉煤灰中的Al2O3,其反应的离子方程式为:Al2O3+2OH=
2AIO,+H,O
(2)由于Al2O3、SiO2能溶于NaOH溶液,而Fe2O3、Fe0不溶于NaOH溶液,所以滤渣B的主要成分
是Fe2O3、FeO
(3)滤液C中含有Fe2、Fe3,检验Fe3“的方法是取少量滤液C于试管中,滴加KSCN溶液,若溶液
变红,则原溶液中含有F
(4)试剂a是将Fe还原为Fe2,故试剂a是Fe:步骤③中反应的离子方程式为
(5)试剂b是将Fe(OH)2氧化为Fe(OH)3,故试剂b是O2或H2O2;he(OH)2转化为Fe(OH)3的实
验现象是白色沉淀迅速变为灰绿色沉淀,最终变为红褐色沉
19.(共12分,每空2分)
【答案】(1)2MnO:+16H+10C=2Mn2+5Cl2↑+8H2
(2)浓硫酸
(3)装置C中充满黄绿色的气体
(4)防止FeC!堵塞玻璃导管
Co.+Ho
(6)碱石灰
【解析】(1)高锰酸钾与浓盐酸反应制氯气的离子方程式为2MnO2+16H+10C
(2)装置B是除去氯气中的水蒸气,故其中的试剂是浓硫酸
(3)当装置C中充满黄绿色的气体时,说明装置中的空气已除干净,故可以点燃装置C处的酒精灯
高一化学参考答案第3页(共4页)
(5)a、c(选不全给1分,错选不给分
【解析】(1)CuSO4和NaOH溶液反应的离子方程式为
Cu(OH),y
(2)两种溶液恰好完全反应时,CuSO4和NaOH的物质的量之比为1:2,所以x=0.2
(3)10min时,CusO4的物质的量为0.1mol,产品Cu(OH)2的质量为0.1×98=9.8g
(4)欲配置480
mL
CusO溶液,实际应配制500mL溶液,需要硫酸铜晶体的质量为0.1mol·L
容量瓶、胶头
(5)a.用托盘天平称量时,物体和砝码放反了,且使用了游码,称量的固体质量偏小,所配溶液的物
质的量浓度偏低
h.容量瓶中有少量水,无影响
定容摇匀时,液面下降,是由于液体在瓶塞处损耗,对结果无影响,又加水将导致所配溶液的物质
的量浓度偏低
d.定容时俯视刻度线,水加少了,所配溶液的物质的量浓度偏高。故选a
18.(共14分,每空2分)
H,O
(2)Fe2O3FeO(填一个得1分
(3)取少量滤液C于试管中,滴加KsCN溶液,若溶液变红,则原溶液中含有Fe3
(4)Fe
Fe
+2Fe
=3Fe
(5)02或H2O2白色沉淀迅速变为灰绿色沉淀最终变为红褐色沉淀
【解析】(1)过量NaOH溶液可溶解粉煤灰中的Al2O3,其反应的离子方程式为:Al2O3+2OH=
2AIO,+H,O
(2)由于Al2O3、SiO2能溶于NaOH溶液,而Fe2O3、Fe0不溶于NaOH溶液,所以滤渣B的主要成分
是Fe2O3、FeO
(3)滤液C中含有Fe2、Fe3,检验Fe3“的方法是取少量滤液C于试管中,滴加KSCN溶液,若溶液
变红,则原溶液中含有F
(4)试剂a是将Fe还原为Fe2,故试剂a是Fe:步骤③中反应的离子方程式为
(5)试剂b是将Fe(OH)2氧化为Fe(OH)3,故试剂b是O2或H2O2;he(OH)2转化为Fe(OH)3的实
验现象是白色沉淀迅速变为灰绿色沉淀,最终变为红褐色沉
19.(共12分,每空2分)
【答案】(1)2MnO:+16H+10C=2Mn2+5Cl2↑+8H2
(2)浓硫酸
(3)装置C中充满黄绿色的气体
(4)防止FeC!堵塞玻璃导管
Co.+Ho
(6)碱石灰
【解析】(1)高锰酸钾与浓盐酸反应制氯气的离子方程式为2MnO2+16H+10C
(2)装置B是除去氯气中的水蒸气,故其中的试剂是浓硫酸
(3)当装置C中充满黄绿色的气体时,说明装置中的空气已除干净,故可以点燃装置C处的酒精灯
高一化学参考答案第3页(共4页)
同课章节目录
