2020-2021学年九年级化学人教版下册8.3 金属资源的利用和保护课件(25张PPT)
文档属性
| 名称 | 2020-2021学年九年级化学人教版下册8.3 金属资源的利用和保护课件(25张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-24 15:42:09 | ||
图片预览








文档简介
课题3 金属资源的利用和保护
第八单元 金属和金属材料
第1课时 铁的冶炼
1.金属资源的存在:______________。
2.金属元素在地壳中的含量:排在前两位的是______、_____。
3.自然界中金属的存在形式:_____、_______。
4.以化合物形式存在的金属具体表现为:_______。
5.我国矿物种类和储量情况:______________。
铝
铁
地壳和海洋
单质
化合物
矿石
齐全、丰富
自然界以单质形式存在的金
自然界以单质形式存在的银
赤铁矿: Fe2O3
黄铁矿: FeS2不能用炼铁
菱铁矿: FeCO3
常见的金属矿石
铝土矿: Al2O3
黄铜矿:CuFeS2
辉铜矿:Cu2S
早在春秋战国时期,我国就开始生产和使用铁器,从1世纪起,铁便成了一种最主要的金属材料。
上海宝山钢铁公司炼铁高炉
为纪念1996年中国钢产量突破1亿吨而发行的邮票
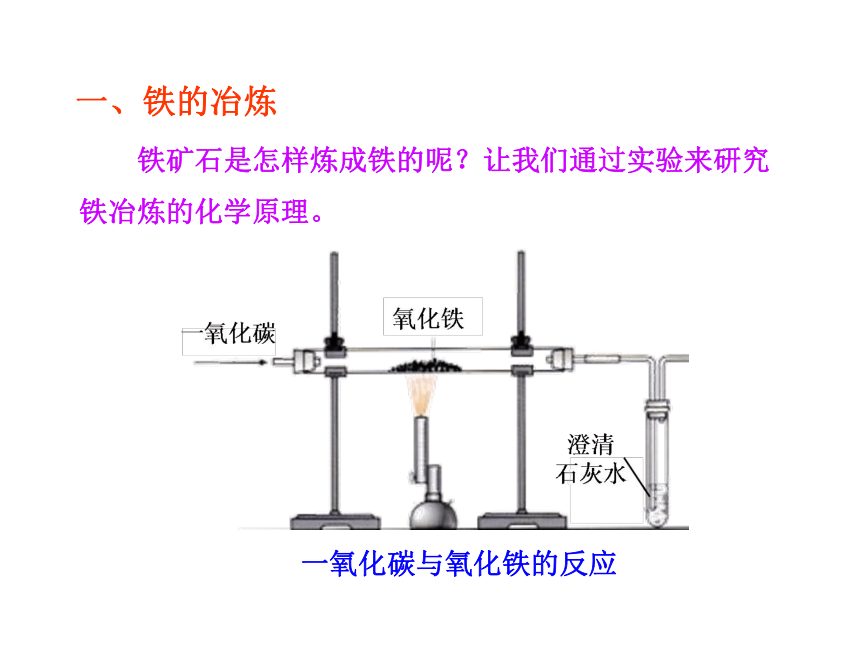
铁矿石是怎样炼成铁的呢?让我们通过实验来研究铁冶炼的化学原理。
一氧化碳与氧化铁的反应
一、铁的冶炼
实验的原理
实验的步骤
实验的现象
实验应注意哪些问题?(先加热还是先通气?实验完毕时先停止加热吗?)
实验需要改进吗?(一氧化碳有毒,实验完毕的尾气怎么处理?)
一氧化碳还原氧化铁实验
实验原理:
实验操作:
1.按上图组装仪器,并检查气密性
2.把少量研细的氧化铁粉末装进硬质玻璃管中,轻轻转
动玻璃管,使氧化铁粉末均匀地附在玻璃管内壁上
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
3.把硬质玻璃管接入装置系统中,点燃出气口处的酒精灯,先通入一氧化碳气体排出管内的空气;待排尽后,点燃酒精喷灯,并观察装置中所发生的变化。
4.当红棕色粉末已转变成黑色后,先停止酒精喷灯加热,再通一会儿一氧化碳,直至玻璃管冷却再停止通入一氧化碳,最后熄灭酒精灯。
将产生的气体通入到澄清石灰水中,澄清石灰水
变浑浊,则生成二氧化碳:CO2+Ca(OH)2====CaCO3↓+H2O;红色粉末变黑色,用磁铁或者稀盐酸来检验,证明黑色粉末
为铁。
红棕色(氧化铁)粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊。
实验现象:
问题讨论:
1.如何验证反应中生成了什么物质?
把尾气烧掉,防止污染空气。
2.装置中右边的酒精灯起什么作用?
3.石灰水的作用有哪些?
澄清石灰水用来检验生成物二氧化碳,并吸收二氧化碳,便于处理尾气。
1.一氧化碳还原氧化铁是在封闭的硬质玻璃管中进行的,先通一氧化碳,可以把管内的空气排出,防止一氧化碳与空气混合受热爆炸。
? 2.实验完毕先停止加热,还要继续通入一氧化碳直到玻璃管冷却为止。防止高温的条件下,生成的铁再被氧化。防倒吸。
注意事项:
实验改进:
?? 可将上述装置除尾气的部分,改成用气球或方便袋收集,这样收集得到的未燃的一氧化碳气体可重复利用
把尾气烧掉,防止污染空气
1.原料:铁矿石、焦炭、石灰石、空气
2.设备:高炉
3.反应原理:
C+O2 CO2
CO2+C 2CO
Fe2O3+3CO 2Fe+3CO2
CaCO3 CaO+CO2 ↑
CaO+SiO2 CaSiO3
工业炼铁
点燃
====
高温
====
高温
====
高温
====
高温
====
将铁矿石中的 SiO2转变为炉渣
点燃
(1) C + O2 === CO2
高温
(2)C + CO2 === 2CO
生铁
出铁口
炉渣
出渣口
⑶ Fe2O3 + 3CO ===== 2Fe + 3CO2
高温
高炉气体
高炉气体
① 提供还原剂CO
② 提供热量
③部分熔入铁水变成生铁
实验室制得的是单质铁,工业是生铁
炼铁主要原料是铁矿石,主要产品为生铁。
炼钢主要原料是生铁,主要产品为钢。
“百炼成钢”。
实际生产中,所用原料或产物一般都含有杂质,如何进行计算?
在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。
不纯物质、纯物质、纯度之间的关系:
列比例时,一定要用纯量。
3.含杂质的物质的化学方程式的计算:
m(纯) = m(不纯 )×纯度
m(不纯) = m(纯) ÷ 纯度
例题:用1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼含铁96%的生铁多少吨?
Fe2O3+3CO===2Fe + 3CO2
高温
解:1000t赤铁矿石中含氧化铁的质量为1000t ×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为X。
160 112
800t X
160
800t
=
112
X
X=560t
分析:带入化学方程式计算的数据应是纯净物的质量:
赤铁矿石 氧化铁 铁 生铁
⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。
解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.
Fe2O3 + 3CO=== 2Fe + 3CO2
112
X· 85% 2850t
高温
160
X· 85%
=
112
2850t
X≈4790t
答:⑴该3000 t生铁中含纯铁2850t。
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。
1.某炼钢厂日产含杂质5%的生铁3000t,试计算:
⑴该3000 t生铁中含纯铁多少吨?
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多
少吨?(计算结果保留整数)
课堂检测:
第八单元 金属和金属材料
第1课时 铁的冶炼
1.金属资源的存在:______________。
2.金属元素在地壳中的含量:排在前两位的是______、_____。
3.自然界中金属的存在形式:_____、_______。
4.以化合物形式存在的金属具体表现为:_______。
5.我国矿物种类和储量情况:______________。
铝
铁
地壳和海洋
单质
化合物
矿石
齐全、丰富
自然界以单质形式存在的金
自然界以单质形式存在的银
赤铁矿: Fe2O3
黄铁矿: FeS2不能用炼铁
菱铁矿: FeCO3
常见的金属矿石
铝土矿: Al2O3
黄铜矿:CuFeS2
辉铜矿:Cu2S
早在春秋战国时期,我国就开始生产和使用铁器,从1世纪起,铁便成了一种最主要的金属材料。
上海宝山钢铁公司炼铁高炉
为纪念1996年中国钢产量突破1亿吨而发行的邮票
铁矿石是怎样炼成铁的呢?让我们通过实验来研究铁冶炼的化学原理。
一氧化碳与氧化铁的反应
一、铁的冶炼
实验的原理
实验的步骤
实验的现象
实验应注意哪些问题?(先加热还是先通气?实验完毕时先停止加热吗?)
实验需要改进吗?(一氧化碳有毒,实验完毕的尾气怎么处理?)
一氧化碳还原氧化铁实验
实验原理:
实验操作:
1.按上图组装仪器,并检查气密性
2.把少量研细的氧化铁粉末装进硬质玻璃管中,轻轻转
动玻璃管,使氧化铁粉末均匀地附在玻璃管内壁上
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
3.把硬质玻璃管接入装置系统中,点燃出气口处的酒精灯,先通入一氧化碳气体排出管内的空气;待排尽后,点燃酒精喷灯,并观察装置中所发生的变化。
4.当红棕色粉末已转变成黑色后,先停止酒精喷灯加热,再通一会儿一氧化碳,直至玻璃管冷却再停止通入一氧化碳,最后熄灭酒精灯。
将产生的气体通入到澄清石灰水中,澄清石灰水
变浑浊,则生成二氧化碳:CO2+Ca(OH)2====CaCO3↓+H2O;红色粉末变黑色,用磁铁或者稀盐酸来检验,证明黑色粉末
为铁。
红棕色(氧化铁)粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊。
实验现象:
问题讨论:
1.如何验证反应中生成了什么物质?
把尾气烧掉,防止污染空气。
2.装置中右边的酒精灯起什么作用?
3.石灰水的作用有哪些?
澄清石灰水用来检验生成物二氧化碳,并吸收二氧化碳,便于处理尾气。
1.一氧化碳还原氧化铁是在封闭的硬质玻璃管中进行的,先通一氧化碳,可以把管内的空气排出,防止一氧化碳与空气混合受热爆炸。
? 2.实验完毕先停止加热,还要继续通入一氧化碳直到玻璃管冷却为止。防止高温的条件下,生成的铁再被氧化。防倒吸。
注意事项:
实验改进:
?? 可将上述装置除尾气的部分,改成用气球或方便袋收集,这样收集得到的未燃的一氧化碳气体可重复利用
把尾气烧掉,防止污染空气
1.原料:铁矿石、焦炭、石灰石、空气
2.设备:高炉
3.反应原理:
C+O2 CO2
CO2+C 2CO
Fe2O3+3CO 2Fe+3CO2
CaCO3 CaO+CO2 ↑
CaO+SiO2 CaSiO3
工业炼铁
点燃
====
高温
====
高温
====
高温
====
高温
====
将铁矿石中的 SiO2转变为炉渣
点燃
(1) C + O2 === CO2
高温
(2)C + CO2 === 2CO
生铁
出铁口
炉渣
出渣口
⑶ Fe2O3 + 3CO ===== 2Fe + 3CO2
高温
高炉气体
高炉气体
① 提供还原剂CO
② 提供热量
③部分熔入铁水变成生铁
实验室制得的是单质铁,工业是生铁
炼铁主要原料是铁矿石,主要产品为生铁。
炼钢主要原料是生铁,主要产品为钢。
“百炼成钢”。
实际生产中,所用原料或产物一般都含有杂质,如何进行计算?
在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。
不纯物质、纯物质、纯度之间的关系:
列比例时,一定要用纯量。
3.含杂质的物质的化学方程式的计算:
m(纯) = m(不纯 )×纯度
m(不纯) = m(纯) ÷ 纯度
例题:用1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼含铁96%的生铁多少吨?
Fe2O3+3CO===2Fe + 3CO2
高温
解:1000t赤铁矿石中含氧化铁的质量为1000t ×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为X。
160 112
800t X
160
800t
=
112
X
X=560t
分析:带入化学方程式计算的数据应是纯净物的质量:
赤铁矿石 氧化铁 铁 生铁
⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。
解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.
Fe2O3 + 3CO=== 2Fe + 3CO2
112
X· 85% 2850t
高温
160
X· 85%
=
112
2850t
X≈4790t
答:⑴该3000 t生铁中含纯铁2850t。
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。
1.某炼钢厂日产含杂质5%的生铁3000t,试计算:
⑴该3000 t生铁中含纯铁多少吨?
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多
少吨?(计算结果保留整数)
课堂检测:
同课章节目录
