2020-2021学年九年级化学人教版下册化学第十一单元课题1生活中常见的盐-盐的化学性质课件(共20张PPT)
文档属性
| 名称 | 2020-2021学年九年级化学人教版下册化学第十一单元课题1生活中常见的盐-盐的化学性质课件(共20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 100.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-24 15:58:14 | ||
图片预览




文档简介
课题1 生活中常见的盐(七)
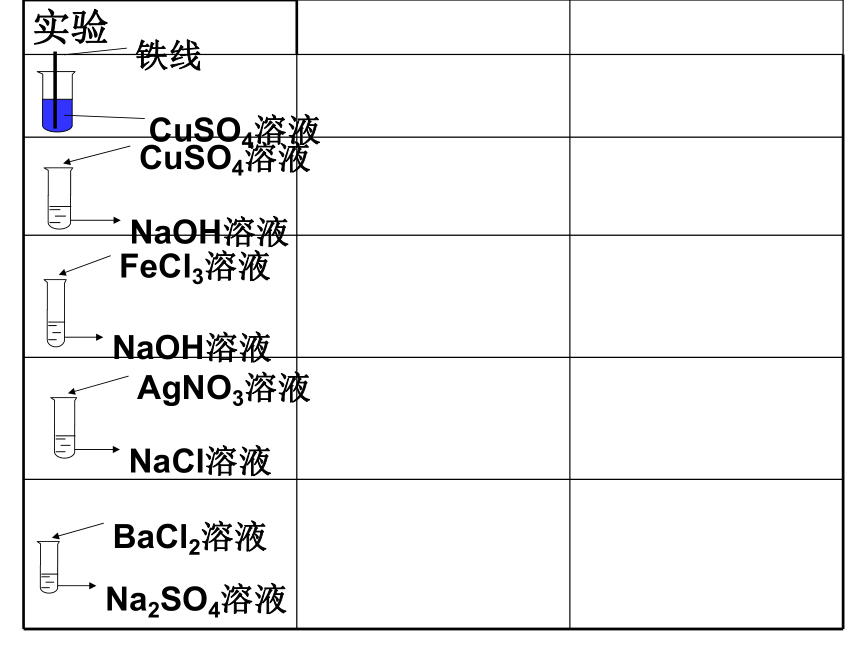
实验
铁线
CuSO4溶液
CuSO4溶液
NaOH溶液
FeCl3溶液
NaOH溶液
AgNO3溶液
NaCl溶液
BaCl2溶液
Na2SO4溶液
实验
现象
化学方程式
铁线
CuSO4溶液
CuSO4溶液
NaOH溶液
FeCl3溶液
NaOH溶液
AgNO3溶液
NaCl溶液
BaCl2溶液
Na2SO4溶液
铁线表面有红色物质出现,蓝色溶液变成浅绿色
Fe+CuSO4=
Cu+FeSO4
蓝色溶液变蓝色沉淀
CuSO4+ NaOH
= Na2SO4 + Cu(OH)2
2
黄色溶液变红褐色沉淀
FeCl3+ NaOH=
NaCl + Fe(OH)3
3
3
有白色沉淀
NaCl+AgNO3=
NaNO3 + AgCl
有白色沉淀
Na2SO4+BaCl2=
NaCl + BaSO4
2
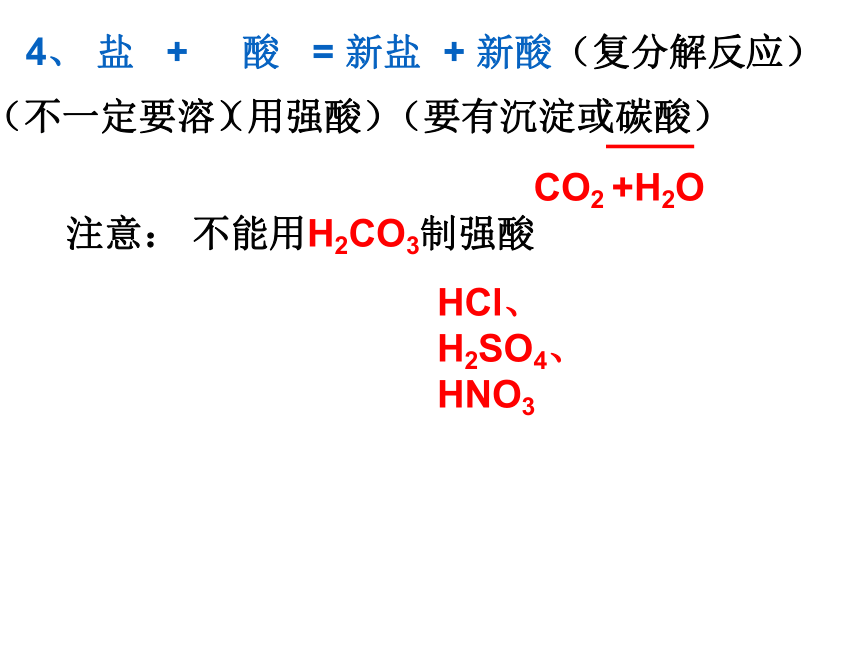
4、 盐 + 酸 =
(复分解反应)
(金+酸根)
(H+酸根)
新盐 + 新酸
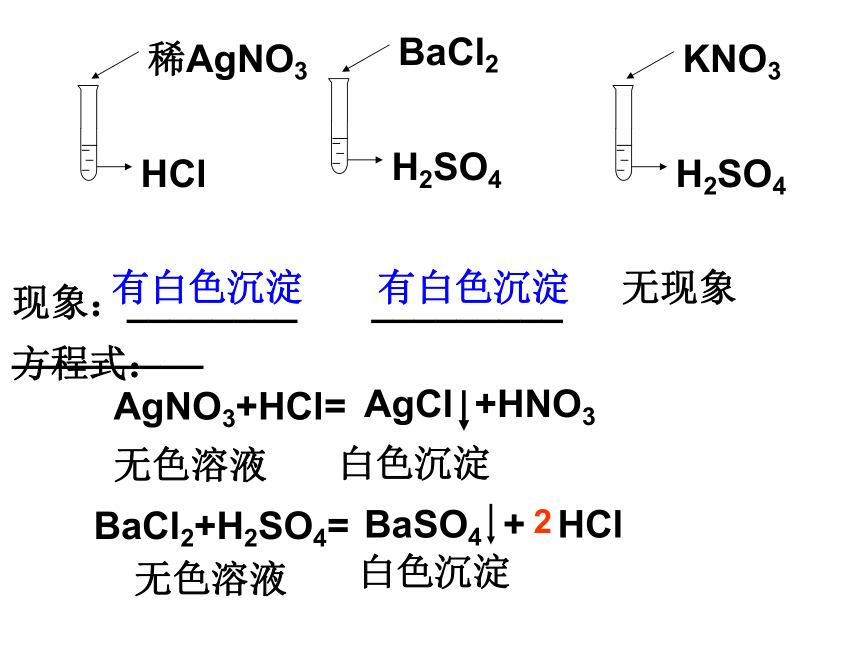
稀AgNO3
HCl
BaCl2
H2SO4
KNO3
H2SO4
现象:________ _________ _________
有白色沉淀
有白色沉淀
无现象
方程式:
BaCl2+H2SO4=
BaSO4 + HCl
AgNO3+HCl=
AgCl +HNO3
2
无色溶液
白色沉淀
无色溶液
白色沉淀
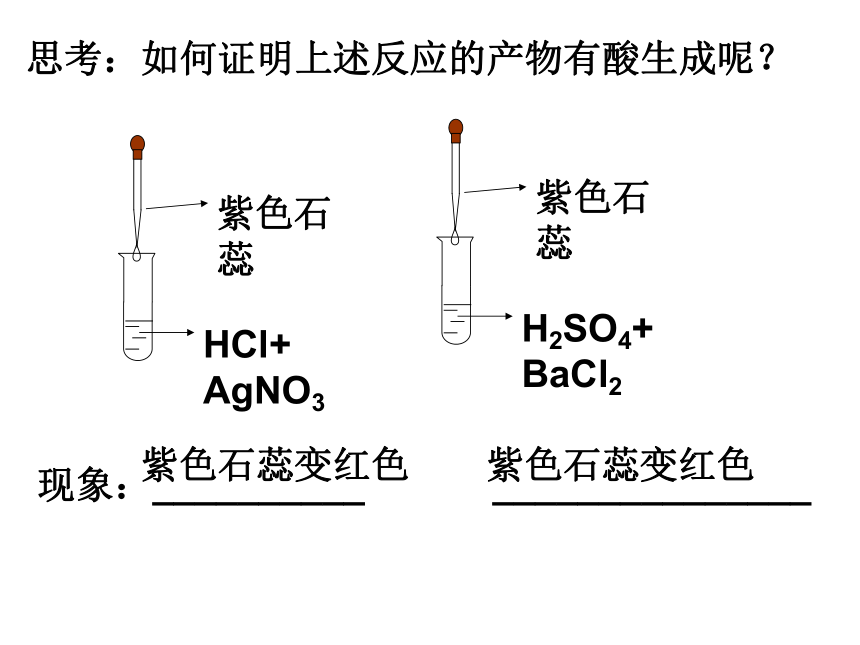
思考:如何证明上述反应的产物有酸生成呢?
紫色石蕊
HCl+
AgNO3
紫色石蕊
H2SO4+
BaCl2
现象:__________ _______________
紫色石蕊变红色
紫色石蕊变红色
方程式:
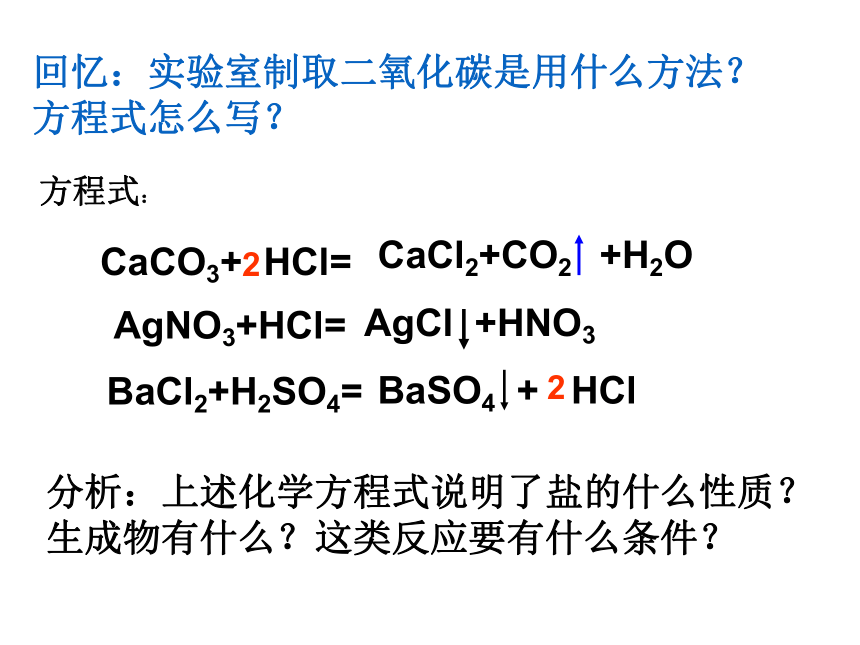
CaCO3+ HCl=
CaCl2+CO2 +H2O
2
回忆:实验室制取二氧化碳是用什么方法?方程式怎么写?
BaCl2+H2SO4=
BaSO4 + HCl
AgNO3+HCl=
AgCl +HNO3
2
分析:上述化学方程式说明了盐的什么性质?生成物有什么?这类反应要有什么条件?
(要有沉淀或碳酸)
CO2 +H2O
注意: 不能用H2CO3制强酸
HCl、H2SO4、HNO3
4、 盐 + 酸 = 新盐 + 新酸
(复分解反应)
(不一定要溶)
(用强酸)
(1)NaNO3 + HCl
(2)Na2CO3 + H2SO4
(3)NaCl + H2SO4
(4)Ag2CO3 + HCl
(5)BaCl2 + H2CO3
(5)BaCO3 + H2SO4
【练习】判断下列反应能否发生,能的写出化学方程式
设问:如何区分稀盐酸和稀硫酸?
BaCl2
HCl
BaCl2
H2SO4
现象:__________ _______________
有白色沉淀
无现象
分析:
BaCl2+H2SO4=
BaSO4 + HCl
2
BaCl2+HCl=
无现象
结论:
区分稀盐酸和稀硫酸的方法:
取样,加入BaCl2溶液,有白色沉淀的是稀硫酸,无现象的是稀盐酸
设问:上面生成的AgCl 、 BaSO4 有什么性质?
稀AgNO3
HCl
BaCl2
H2SO4
稀HNO3
AgCl+HNO3
稀HNO3
BaSO4+HCl
现象:__________
现象:__________
白色沉淀不溶于稀硝酸
白色沉淀不溶于稀硝酸
某些沉淀物的性质
(1) AgCl 、 BaSO4 白色沉淀不溶于稀HNO3
(2) Ag2CO3 、 BaCO3 CaCO3 (白色沉淀),所有难溶的CO3盐溶于稀HNO3
,且有气泡生成
(3) Cu(OH)2 (蓝色) Mg(OH)2 (白色) Fe(OH)3 (红褐色),难溶的碱溶于稀HNO3,但无气泡生成
2KCl + 3O2
K2MnO4 + MnO2 + O2
5、某些盐会分解
CaCO3
高温
(只有难溶的CO3盐才会分解)
2KMnO4
△
2KClO3
MnO2
△
CaO + CO2
补充、某些沉淀物的性质
BaCl2
Na2CO3
【实验】①
有气泡
对应的化学方程式:
①
BaCl2 + Na2CO3 =
BaCO3 + HNO3 =
HNO3
白色
BaCO3
BaCO3 + NaCl
2
Ba(NO3)2+ H2O + CO2
2
沉淀消失
溶
返回
AgNO3
NaCl
【实验】②
对应的化学方程式:
②
AgCl + HNO3 = 不反应
HNO3
白色
AgCl
白色
无消失
为什么?
AgNO3+NaCl=
AgCl +NaNO3
返回
BaCl2
Na2SO4
【实验】③
对应的化学方程式:
③
BaSO4 + HNO3 = 不反应
HNO3
白色
BaSO4
白色
无消失
为什么?
BaCl2+Na2SO4=
BaSO4 + NaCl
2
返回
重要结论:
① 所有难溶的CO3盐都能被HNO3溶解
(并有H2O + CO2气泡生成)
② 只有 AgCl 不能被HNO3溶解
BaSO4
③ 所有难溶的碱,如Fe(OH)3、Cu(OH)2都能被
HNO3溶解(无气泡)
某些沉淀物的性质
【练习】
1、给出下列沉淀物 AgCl BaSO4 CaCO3 BaCO3
Cu(OH)2 Fe(OH)3
① 不溶于HNO3的沉淀物只有___________________ ② 溶于HNO3,且有气泡的沉淀物是______________ ③ 溶于HNO3,但无气泡的沉淀物质_______________
AgCl
BaSO4
CaCO3
BaCO3
Cu(OH)2
Fe(OH)3
2、某含钠的化合物A,在它的溶液中加入AgNO3后,
产生一种白色沉淀,向沉淀物中加入稀HNO3
① 若沉淀物不消失,则A是________
② 若沉淀物消失,且有气泡生成,则A是________
NaCl
Na2CO3
3、某含钠的化合物B,在B的溶液中加入BaCl2后,
产生一种白色沉淀,向沉淀物中加入稀HNO3
① 若沉淀物不消失,则B是________
② 若沉淀物消失,且有气泡生成,则B是________
K2SO4
K2CO3
4、某化合物M为溶液,加入BaCl2后产生一种不溶于
HNO3的沉淀,则M可能是( )
A. AgNO3 B. Na2SO4 C. Na2CO3 D. NaOH
A B
【练习】判断下列反应能否发生,能的写出化学
方程式
① CaCO3 + HCl
② Na2CO3 + HNO3
③ AgNO3 + HCl
④ BaCl2 + H2SO4
⑤ KNO3 + H2SO4
⑥ H2CO3 + CaCl2
⑦ NaCl + HNO3
⑧ AgCl + HNO3
⑨ BaSO4 + HNO3
√
= K2SO4 + 2HNO3
= NaNO3 + HCl
2
2
2
= AgCl + HNO3
= BaSO4 + 2HCl
= CaCO3 + 2HCl
= CaCl2 + H2O + CO2
= 2NaNO3 + H2O + CO2
√
√
√
实验
铁线
CuSO4溶液
CuSO4溶液
NaOH溶液
FeCl3溶液
NaOH溶液
AgNO3溶液
NaCl溶液
BaCl2溶液
Na2SO4溶液
实验
现象
化学方程式
铁线
CuSO4溶液
CuSO4溶液
NaOH溶液
FeCl3溶液
NaOH溶液
AgNO3溶液
NaCl溶液
BaCl2溶液
Na2SO4溶液
铁线表面有红色物质出现,蓝色溶液变成浅绿色
Fe+CuSO4=
Cu+FeSO4
蓝色溶液变蓝色沉淀
CuSO4+ NaOH
= Na2SO4 + Cu(OH)2
2
黄色溶液变红褐色沉淀
FeCl3+ NaOH=
NaCl + Fe(OH)3
3
3
有白色沉淀
NaCl+AgNO3=
NaNO3 + AgCl
有白色沉淀
Na2SO4+BaCl2=
NaCl + BaSO4
2
4、 盐 + 酸 =
(复分解反应)
(金+酸根)
(H+酸根)
新盐 + 新酸
稀AgNO3
HCl
BaCl2
H2SO4
KNO3
H2SO4
现象:________ _________ _________
有白色沉淀
有白色沉淀
无现象
方程式:
BaCl2+H2SO4=
BaSO4 + HCl
AgNO3+HCl=
AgCl +HNO3
2
无色溶液
白色沉淀
无色溶液
白色沉淀
思考:如何证明上述反应的产物有酸生成呢?
紫色石蕊
HCl+
AgNO3
紫色石蕊
H2SO4+
BaCl2
现象:__________ _______________
紫色石蕊变红色
紫色石蕊变红色
方程式:
CaCO3+ HCl=
CaCl2+CO2 +H2O
2
回忆:实验室制取二氧化碳是用什么方法?方程式怎么写?
BaCl2+H2SO4=
BaSO4 + HCl
AgNO3+HCl=
AgCl +HNO3
2
分析:上述化学方程式说明了盐的什么性质?生成物有什么?这类反应要有什么条件?
(要有沉淀或碳酸)
CO2 +H2O
注意: 不能用H2CO3制强酸
HCl、H2SO4、HNO3
4、 盐 + 酸 = 新盐 + 新酸
(复分解反应)
(不一定要溶)
(用强酸)
(1)NaNO3 + HCl
(2)Na2CO3 + H2SO4
(3)NaCl + H2SO4
(4)Ag2CO3 + HCl
(5)BaCl2 + H2CO3
(5)BaCO3 + H2SO4
【练习】判断下列反应能否发生,能的写出化学方程式
设问:如何区分稀盐酸和稀硫酸?
BaCl2
HCl
BaCl2
H2SO4
现象:__________ _______________
有白色沉淀
无现象
分析:
BaCl2+H2SO4=
BaSO4 + HCl
2
BaCl2+HCl=
无现象
结论:
区分稀盐酸和稀硫酸的方法:
取样,加入BaCl2溶液,有白色沉淀的是稀硫酸,无现象的是稀盐酸
设问:上面生成的AgCl 、 BaSO4 有什么性质?
稀AgNO3
HCl
BaCl2
H2SO4
稀HNO3
AgCl+HNO3
稀HNO3
BaSO4+HCl
现象:__________
现象:__________
白色沉淀不溶于稀硝酸
白色沉淀不溶于稀硝酸
某些沉淀物的性质
(1) AgCl 、 BaSO4 白色沉淀不溶于稀HNO3
(2) Ag2CO3 、 BaCO3 CaCO3 (白色沉淀),所有难溶的CO3盐溶于稀HNO3
,且有气泡生成
(3) Cu(OH)2 (蓝色) Mg(OH)2 (白色) Fe(OH)3 (红褐色),难溶的碱溶于稀HNO3,但无气泡生成
2KCl + 3O2
K2MnO4 + MnO2 + O2
5、某些盐会分解
CaCO3
高温
(只有难溶的CO3盐才会分解)
2KMnO4
△
2KClO3
MnO2
△
CaO + CO2
补充、某些沉淀物的性质
BaCl2
Na2CO3
【实验】①
有气泡
对应的化学方程式:
①
BaCl2 + Na2CO3 =
BaCO3 + HNO3 =
HNO3
白色
BaCO3
BaCO3 + NaCl
2
Ba(NO3)2+ H2O + CO2
2
沉淀消失
溶
返回
AgNO3
NaCl
【实验】②
对应的化学方程式:
②
AgCl + HNO3 = 不反应
HNO3
白色
AgCl
白色
无消失
为什么?
AgNO3+NaCl=
AgCl +NaNO3
返回
BaCl2
Na2SO4
【实验】③
对应的化学方程式:
③
BaSO4 + HNO3 = 不反应
HNO3
白色
BaSO4
白色
无消失
为什么?
BaCl2+Na2SO4=
BaSO4 + NaCl
2
返回
重要结论:
① 所有难溶的CO3盐都能被HNO3溶解
(并有H2O + CO2气泡生成)
② 只有 AgCl 不能被HNO3溶解
BaSO4
③ 所有难溶的碱,如Fe(OH)3、Cu(OH)2都能被
HNO3溶解(无气泡)
某些沉淀物的性质
【练习】
1、给出下列沉淀物 AgCl BaSO4 CaCO3 BaCO3
Cu(OH)2 Fe(OH)3
① 不溶于HNO3的沉淀物只有___________________ ② 溶于HNO3,且有气泡的沉淀物是______________ ③ 溶于HNO3,但无气泡的沉淀物质_______________
AgCl
BaSO4
CaCO3
BaCO3
Cu(OH)2
Fe(OH)3
2、某含钠的化合物A,在它的溶液中加入AgNO3后,
产生一种白色沉淀,向沉淀物中加入稀HNO3
① 若沉淀物不消失,则A是________
② 若沉淀物消失,且有气泡生成,则A是________
NaCl
Na2CO3
3、某含钠的化合物B,在B的溶液中加入BaCl2后,
产生一种白色沉淀,向沉淀物中加入稀HNO3
① 若沉淀物不消失,则B是________
② 若沉淀物消失,且有气泡生成,则B是________
K2SO4
K2CO3
4、某化合物M为溶液,加入BaCl2后产生一种不溶于
HNO3的沉淀,则M可能是( )
A. AgNO3 B. Na2SO4 C. Na2CO3 D. NaOH
A B
【练习】判断下列反应能否发生,能的写出化学
方程式
① CaCO3 + HCl
② Na2CO3 + HNO3
③ AgNO3 + HCl
④ BaCl2 + H2SO4
⑤ KNO3 + H2SO4
⑥ H2CO3 + CaCl2
⑦ NaCl + HNO3
⑧ AgCl + HNO3
⑨ BaSO4 + HNO3
√
= K2SO4 + 2HNO3
= NaNO3 + HCl
2
2
2
= AgCl + HNO3
= BaSO4 + 2HCl
= CaCO3 + 2HCl
= CaCl2 + H2O + CO2
= 2NaNO3 + H2O + CO2
√
√
√
同课章节目录
