2020-2021学年高一化学人教版必修2第二章第三节 化学反应的速率和限度(第一课时)课件(共22张ppt)
文档属性
| 名称 | 2020-2021学年高一化学人教版必修2第二章第三节 化学反应的速率和限度(第一课时)课件(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-25 11:17:53 | ||
图片预览








文档简介
(共22张PPT)
第三节
化学反应的速率和限度
(第一课时)
在化学实验和日常生活中,我们
经常观察到这样的现象:有的反应进
行的快,有的进行的慢。
较慢
较快
很慢
很快
石油的形成
定向爆破
一、化学反应速率
阅读P47——P48,并完成学案的第一部分(自主学习)
自主学习
学生活动一:
1、定义:
2、表示方法:
3、表达式:
4、单位:
表示化学反应快慢的物理量
通常用单位时间内反应物浓度的
减小或生成物浓度的增加来表示。
常见单位:mol/(L.min)或mol/(L.s)
B
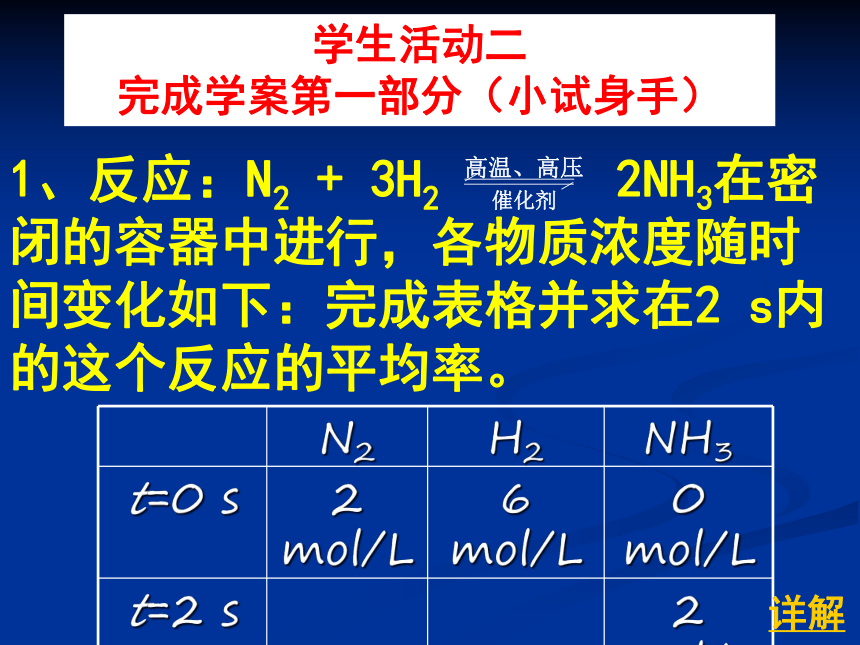
学生活动二
完成学案第一部分(小试身手)
N2
H2
NH3
t=0
s
2
mol/L
6
mol/L
0
mol/L
t=2
s
2
mol/L
1、反应:N2
+
3H2
2NH3在密闭的容器中进行,各物质浓度随时间变化如下:完成表格并求在2
s内的这个反应的平均率。
高温、高压
催化剂
详解
N2
+
3H2
2NH3
高温、高压
催化剂
2s的浓度:
3
mol/L
1
mol/L
2
mol/L
起始浓度:
2
mol/L
6
mol/L
0
mol/L
浓度的变化量:
2
mol/L
3
mol/L
1
mol/L
v(N2)=0.5
mol/(L·s)
v(H2)=1.5
mol/(L·s)
v(NH3)=1
mol/(L·s)
2、在2A
+
B
==
3C
+
4D
反应中,表示该反应速率最快的是(
)
A、V(A)=0.5
mol/(L·S)
B、V(B)=0.3
mol/(L·S)
C、V(C)=0.8
mol/(L·S)
D、V(D)=
1
mol/(L·S)
注意
注意
5、注意事项:
(1)同一反应用不同物质表示的化学反应速率数值可能不同,但表示的意义是相同的,而且必须注明反应物质.
(2)同一化学反应中各物质的反应速率之比等于反应方程式中化学计量数之比。
(3)比较同一个反应的速率大小时,应选用同一种物质。
交流与思考
化学反应的速率受哪些因素的影响?
1、在相同条件下,钠和镁同时与水反应,
谁反应的更快?为什么?
2、你家里的酸奶通常放在什么地方?
为什么?
内因
外因
不同反应间的反应速率主要是由物
质的本性决定的,物质的本性我们没办
法改变,但我们可以通过改变外界条件
来改变化学反应的速率。
二、影响化学反应速率的因素
1.内因:反应物的性质
2.外因
根据我们已有的知识和日常生活经验,你认为哪些外界因素可能会影响化学反应的速率?
温度、催化剂、浓度、
反应物的状态、固体表面积、光、形成原电池等。
学生活动三
探究影响化学反应速率的外因
药品:0.1
mol/L硫代硫酸钠(Na2S2O3)、0.1
mol/L硫酸、1
mol/L硫酸、5%的过氧化氢、二氧化锰、FeCl3溶液。
根据我们现有的药品,分别设计实验,探究浓度、催化剂对化学反应速率是如何影响的,并完成探究学案。
仪器和药品
方案制定和实施
得出结论
浓度
催化剂
提示:
Na2S2O3
与H2SO4的反应原理
Na2S2O3
+
H2SO4
=
Na2SO4
+
SO2
↑+
S↓+
H2O
建议
几点建议
◆
组长明确分工,学会合作。
◆
尊重实验事实,客观纪录实验现象。
◆
每个小组请一名同学对本组设计的实
验方案和实验结果作全班发言。
◆
勤于思考,敢于提出实验中遇到的问
题,但同时也要善于倾听别人意见。
◆
及时完成学案。
实验给我们的启示
③设计实验的原则:简约性、科学性、安全性、可行性。
②对比实验的过程中,一定要控制好
“单一变量”。
①
观察反应速率大小的方法:
根据气泡产生的快慢、沉淀量的多少、
颜色的深浅、放热的多少等。
(1)Fe
(s)
+
CuSO4
(aq)=FeSO4
(aq)
+
Cu
(s)
这个反应,增加Fe
(s)的量。
巩固训练一
1、判断下列化学反应的速率是否受到影响
(2)对于2
Na
+
2
H2O
=
2
NaOH
+
H2↑这个反应,改变水的量。
启发
启发
①
若反应物是固体或纯液体,量的改变不影响化学反应速率。
②
溶液量的改变,没有引起反应物浓度的改变,也不影响化学反应速率。
2.把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现氢气生成的速率变化情况如下图所示:
其中t1~t2速率变化的主要原因是:_________________
t2~t3速率变化的主要原因是:_______________。
创新训练
思考与交流
你知道工业合成氨选择什么条件吗?为什么?
高温、高压、催化剂
N2
+
3H2
2NH3
高温、高压
催化剂
思考
①此时管内压强有何变化?
②气体的体积有何变化?
③气体的物质的量又何变化?
3、判断下列化学反应的速率是否受到影响?
巩固训练二
(1)Fe
(s)+
CuSO4
(aq)
=
FeSO4
(aq)
+
Cu
(s)
对于这个反应,增大压强。
(2)
向容器中充入1
mol氮气和3
mol氢气发生合成氨反应:
①恒温、恒容下向容器中充入氮气。
②恒温、恒容下向容器中充入氦气,使容器中总压强增大一倍。
启发
启发
①
对于只有固体和液体参加的反应,压强的改变,不影响化学反应的速率。
②
虽然有气体参加反应,但若压强的改变没有引起反应物浓度的改变,化学反应的速率也不会改变。
课堂小结
知识总结
1、化学反应速率的概念,并通过简单的计算归纳总结了化学反应速率与化学计量数的关系。同时通过实验探究,了解了外界条件对化学反应速率的影响。
2、科学探究流程:
提出猜想
制定探究方案
实施探究实验
记录实验现象
反思与评价
方法总结
查阅资料,有哪些科学家因研究催化剂而获得诺贝尔化学奖。并发表你的感想,写一篇小论文。
作业布置
第三节
化学反应的速率和限度
(第一课时)
在化学实验和日常生活中,我们
经常观察到这样的现象:有的反应进
行的快,有的进行的慢。
较慢
较快
很慢
很快
石油的形成
定向爆破
一、化学反应速率
阅读P47——P48,并完成学案的第一部分(自主学习)
自主学习
学生活动一:
1、定义:
2、表示方法:
3、表达式:
4、单位:
表示化学反应快慢的物理量
通常用单位时间内反应物浓度的
减小或生成物浓度的增加来表示。
常见单位:mol/(L.min)或mol/(L.s)
B
学生活动二
完成学案第一部分(小试身手)
N2
H2
NH3
t=0
s
2
mol/L
6
mol/L
0
mol/L
t=2
s
2
mol/L
1、反应:N2
+
3H2
2NH3在密闭的容器中进行,各物质浓度随时间变化如下:完成表格并求在2
s内的这个反应的平均率。
高温、高压
催化剂
详解
N2
+
3H2
2NH3
高温、高压
催化剂
2s的浓度:
3
mol/L
1
mol/L
2
mol/L
起始浓度:
2
mol/L
6
mol/L
0
mol/L
浓度的变化量:
2
mol/L
3
mol/L
1
mol/L
v(N2)=0.5
mol/(L·s)
v(H2)=1.5
mol/(L·s)
v(NH3)=1
mol/(L·s)
2、在2A
+
B
==
3C
+
4D
反应中,表示该反应速率最快的是(
)
A、V(A)=0.5
mol/(L·S)
B、V(B)=0.3
mol/(L·S)
C、V(C)=0.8
mol/(L·S)
D、V(D)=
1
mol/(L·S)
注意
注意
5、注意事项:
(1)同一反应用不同物质表示的化学反应速率数值可能不同,但表示的意义是相同的,而且必须注明反应物质.
(2)同一化学反应中各物质的反应速率之比等于反应方程式中化学计量数之比。
(3)比较同一个反应的速率大小时,应选用同一种物质。
交流与思考
化学反应的速率受哪些因素的影响?
1、在相同条件下,钠和镁同时与水反应,
谁反应的更快?为什么?
2、你家里的酸奶通常放在什么地方?
为什么?
内因
外因
不同反应间的反应速率主要是由物
质的本性决定的,物质的本性我们没办
法改变,但我们可以通过改变外界条件
来改变化学反应的速率。
二、影响化学反应速率的因素
1.内因:反应物的性质
2.外因
根据我们已有的知识和日常生活经验,你认为哪些外界因素可能会影响化学反应的速率?
温度、催化剂、浓度、
反应物的状态、固体表面积、光、形成原电池等。
学生活动三
探究影响化学反应速率的外因
药品:0.1
mol/L硫代硫酸钠(Na2S2O3)、0.1
mol/L硫酸、1
mol/L硫酸、5%的过氧化氢、二氧化锰、FeCl3溶液。
根据我们现有的药品,分别设计实验,探究浓度、催化剂对化学反应速率是如何影响的,并完成探究学案。
仪器和药品
方案制定和实施
得出结论
浓度
催化剂
提示:
Na2S2O3
与H2SO4的反应原理
Na2S2O3
+
H2SO4
=
Na2SO4
+
SO2
↑+
S↓+
H2O
建议
几点建议
◆
组长明确分工,学会合作。
◆
尊重实验事实,客观纪录实验现象。
◆
每个小组请一名同学对本组设计的实
验方案和实验结果作全班发言。
◆
勤于思考,敢于提出实验中遇到的问
题,但同时也要善于倾听别人意见。
◆
及时完成学案。
实验给我们的启示
③设计实验的原则:简约性、科学性、安全性、可行性。
②对比实验的过程中,一定要控制好
“单一变量”。
①
观察反应速率大小的方法:
根据气泡产生的快慢、沉淀量的多少、
颜色的深浅、放热的多少等。
(1)Fe
(s)
+
CuSO4
(aq)=FeSO4
(aq)
+
Cu
(s)
这个反应,增加Fe
(s)的量。
巩固训练一
1、判断下列化学反应的速率是否受到影响
(2)对于2
Na
+
2
H2O
=
2
NaOH
+
H2↑这个反应,改变水的量。
启发
启发
①
若反应物是固体或纯液体,量的改变不影响化学反应速率。
②
溶液量的改变,没有引起反应物浓度的改变,也不影响化学反应速率。
2.把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现氢气生成的速率变化情况如下图所示:
其中t1~t2速率变化的主要原因是:_________________
t2~t3速率变化的主要原因是:_______________。
创新训练
思考与交流
你知道工业合成氨选择什么条件吗?为什么?
高温、高压、催化剂
N2
+
3H2
2NH3
高温、高压
催化剂
思考
①此时管内压强有何变化?
②气体的体积有何变化?
③气体的物质的量又何变化?
3、判断下列化学反应的速率是否受到影响?
巩固训练二
(1)Fe
(s)+
CuSO4
(aq)
=
FeSO4
(aq)
+
Cu
(s)
对于这个反应,增大压强。
(2)
向容器中充入1
mol氮气和3
mol氢气发生合成氨反应:
①恒温、恒容下向容器中充入氮气。
②恒温、恒容下向容器中充入氦气,使容器中总压强增大一倍。
启发
启发
①
对于只有固体和液体参加的反应,压强的改变,不影响化学反应的速率。
②
虽然有气体参加反应,但若压强的改变没有引起反应物浓度的改变,化学反应的速率也不会改变。
课堂小结
知识总结
1、化学反应速率的概念,并通过简单的计算归纳总结了化学反应速率与化学计量数的关系。同时通过实验探究,了解了外界条件对化学反应速率的影响。
2、科学探究流程:
提出猜想
制定探究方案
实施探究实验
记录实验现象
反思与评价
方法总结
查阅资料,有哪些科学家因研究催化剂而获得诺贝尔化学奖。并发表你的感想,写一篇小论文。
作业布置
