第九单元 溶液复习学案
图片预览

文档简介
第九单元 《 溶液》学案
【复习目标:】1、建立溶液的概念并认识溶液、溶质、溶剂三者之间的关系。
2、如何引导学生从微观角度分析溶解过程中的放热和吸热现象。
3、建立饱和溶液和溶解度的概念
4、溶液的溶质质量分数的概念和简单的计算以及配制一定溶质质量分数的溶液。
5、溶液的溶质质量分数简单的计算以及溶质质量分数和化学方程式混合的综合计算。
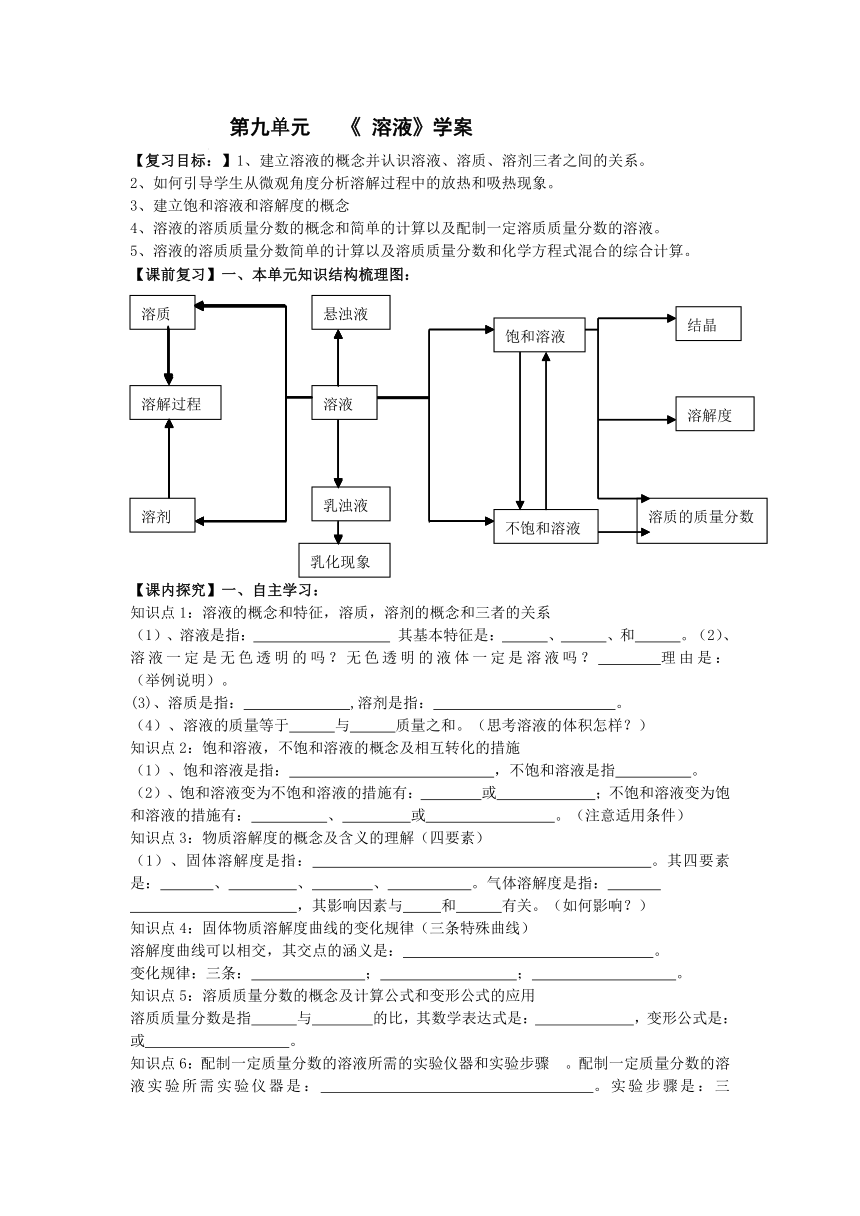
【课前复习】一、本单元知识结构梳理图:
【课内探究】一、自主学习:
知识点1:溶液的概念和特征,溶质,溶剂的概念和三者的关系
(1)、溶液是指: 其基本特征是: 、 、和 。(2)、溶液一定是无色透明的吗?无色透明的液体一定是溶液吗? 理由是: (举例说明)。
(3)、溶质是指: ,溶剂是指: 。
(4)、溶液的质量等于 与 质量之和。(思考溶液的体积怎样?)
知识点2:饱和溶液,不饱和溶液的概念及相互转化的措施
(1)、饱和溶液是指: ,不饱和溶液是指 。
(2)、饱和溶液变为不饱和溶液的措施有: 或 ;不饱和溶液变为饱和溶液的措施有: 、 或 。(注意适用条件)
知识点3:物质溶解度的概念及含义的理解(四要素)
(1)、固体溶解度是指: 。其四要素是: 、 、 、 。气体溶解度是指:
,其影响因素与 和 有关。(如何影响?)
知识点4:固体物质溶解度曲线的变化规律(三条特殊曲线)
溶解度曲线可以相交,其交点的涵义是: 。
变化规律:三条: ; ; 。
知识点5:溶质质量分数的概念及计算公式和变形公式的应用
溶质质量分数是指 与 的比,其数学表达式是: ,变形公式是: 或 。
知识点6:配制一定质量分数的溶液所需的实验仪器和实验步骤 。配制一定质量分数的溶液实验所需实验仪器是: 。实验步骤是:三步: 、 、 。
三、精讲点拨:1、溶液从广义上来讲,不一定都是液体,只要是一种或几种物质分散到另一种物质里形成的均一,稳定的混合物就是溶液。例如:空气就是一种溶液,前面学习的合金也是一种溶液。所以,溶液,溶质和溶剂都可以是固体,液体和气体三种状态,不一定都是液体。
关于溶质和溶剂的区分有三种情况:1、固体和液体混合:一般把固体看作溶质,液体看作溶剂;2、气体和液体混合:一般把气体看作是溶质,液体看作溶剂;3、液体和液体混合:一般把量少的看作是溶质,量多的看作是溶剂(当与水混合时,不论量多量少,水都作溶剂,水是一种最常用的溶剂,但并不是唯一的溶剂。)
2、四者的关系是:饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。溶液的“饱和与不饱和”反映的是在一定温度下,一定量的溶剂里能否继续溶解某种溶质的问题,而溶液的“浓和稀”反映的是在一定量的溶液里,所含溶质质量的多或少的问题,两者之间并无必然的联系。
3、溶解度和溶质质量分数的区别见下表:
溶解度 溶质的质量分数
意义 表示物质溶解性大小的量度 表示溶液中溶质质量的相对多少
温度要求 与温度有关 一般与温度无关
量的关系 表示溶质质量与溶剂质量的关系 表示溶质质量与溶液质量的关系
溶液是否饱和 饱和溶液 不一定是饱和溶液
有无单位 与质量的单位相同(克或千克) 无
计算公式 溶解度﹦(溶质质量/溶剂质量)×100克 溶质的质量分数﹦(溶质质量/溶液质量)×100%
联系 都能表示已经溶解的溶质的质量,在一定温度下,若某物质的溶解度是Sg,其饱和溶液的溶质质量分数为(Sg/100g+Sg)×100%=a%(a%为饱和溶液的溶质质量分数)则有:在该温度下,S>a,可推导出S=100a/100-a
通过以上表格我们可以看出:溶解度对应的溶液一定是饱和溶液,而质量分数对应的溶液不一定是饱和溶液。只有当溶液达到饱和时,质量分数才与溶解度有这样的关系:(Sg/100g+Sg)×100%=a%(当S>a时,才成立)。此时,质量分数与溶解度有关,与温度有关。利用溶解度可以计算该温度下饱和溶液的溶质质量分数。(给我们提供了一种计算饱和溶液溶质质量分数的方法)
4、溶解度曲线的意义及应用主要从以下三个方面理解:
点:曲线上的点:表示此物质在该温度下的溶解度;两曲线的交点:表示两物质在此温度下的溶解度相等。
线:物质在不同温度下的溶解度随温度变化的趋势。
面:曲线下面的各点:表示的溶液是不饱和溶液;曲线上面的各点:表示溶液是饱和溶液且有未溶晶体存在。(或是过饱和溶液)
5、溶质质量分数与化学方程式的综合计算:
在进行此类计算时,首先要正确区分反应后所得溶液的溶质和溶剂各是什么,其次是分别求出溶质和溶液的质量。求溶液质量时很容易出错,要特别注意。通常有两种方法:一是:溶液组成法:溶液质量=溶质质量+溶剂质量,其中溶质质量必须是被溶解了的质量,溶剂水是根据不同的题目通常有两种情况:原溶液中的水和反应后新生成的水。求水的质量时一定要找全,找准水的质量,然后在加上溶质的质量就是溶液的质量。这一点很容易出错,要特别注意。二是:质量守恒法:公式:反应后溶液的质量=反应前溶液的质量-反应后生成沉淀的质量-生成气体的质量。此法比较简单,不容易出错,我们提倡使用此法求解。
6、配制溶液实验的误差分析:导致所配制的溶液的溶质质量分数偏小的原因可能有以下几种情况:(1)、用量筒量水时仰视读数,(2)、配制溶液时,烧杯用蒸馏水润洗 (3)、在托盘天平的左盘称取药品时,游码不在零位置就调节天平平衡,后将游码移动得到读数 (4)、盛装溶液的试剂瓶用蒸馏水润洗 (5)、使用的药品不纯 (6)、用天平称量药品时,药品放在右盘,砝码放在左盘进行称量。(偏高的原因请同学们自己总结)
交流与反思:通过本节课的学习,本节课你还有没有感到疑惑的知识谈谈本节课你的收获与感悟。
四、巩固检测:选择题:
1、把少量物质分别加入到另一种物质中,充分搅拌,可以得到溶液的是( )
A、碘加入到汽油中 B、面粉加入到水中C、高锰酸钾加入到汽油中 D、植物油加入到水中
2、乳化在工农业生产和日常生活中有着十分广泛的应用,下列各用途与乳化有关的是( )
①用洗衣粉洗去衣服上的油脂② 用盐酸洗去铁块表面的铁锈 ③农药、医药制剂的配制 ④将浓硫酸加入到水中放出大量的热 ⑤金属表面油污的清洗 ⑥各种日用洗涤剂和化妆品的配制
A、①②③④⑤⑥B、①②③⑤⑥C、①③⑤⑥D、①③④⑤⑥
3、生活中的下列现象不能说明气体的溶解度随温度的升高而减小的是( )
A、打开啤酒瓶盖,有大量气泡冒出B、烧开水时,沸腾前有气泡逸出C、夏季黄昏,池塘里的鱼常浮出水面D、喝汽水时感到有气体冲到鼻腔
4、现有60℃硝酸钾溶液500克,保持温度不变,蒸发10克水,则溶液中一定保持不变的是( )
A、溶质的质量 B、溶剂的质量 C、溶液的质量 D、硝酸钾的溶解度
5、在25℃时,向饱和的澄清石灰水中加入少量的氧化钙再恢复至25℃,关于该溶液的下列说法正确是( )A、溶质是质量不变 B、溶质的质量减少
C、溶质的质量分数减少 D、溶质的质量分数增大
6、现有100克溶质质量分数为10%的食盐溶液,若使溶液中溶质质量分数增加一倍,下列操作中正确的是( )A、加入食盐10克 B、加入水50克 C、蒸发掉水50克
D、加入100克溶质质量分数为10%的食盐溶液
7、某同学在t℃时,用100克硝酸钾溶液做结晶实验,他先将溶液蒸发掉20克水,冷却至t℃,得到8克晶体(晶体不含结晶水);然后继续蒸发掉10克水,冷却到t℃,又得到6克晶体。则该同学所取原溶液中溶质的质量是( )A、10克 B、35克 C、37克 D、60克
8、在配制质量分数为10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的原因可能是( )①用量筒量取水时俯视读数② 配制溶液的烧杯用少量蒸馏水润洗 ③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数 ④盛装溶液的试剂瓶用蒸馏水润洗⑤使用的氯化钠晶体不纯 A、①②③④⑤ B、①②④⑤ C、①②③ D、②③④⑤
9、京京在厨房做饭时,发现很多因素都能影响食盐在水中的溶解速率,于是就大胆进行猜测,请你帮助京京猜想一下:(1)、从你能想到的可能影响食盐在水中溶解速率的因素中,写出两项,并预测此因素对食盐溶解速率的影响。因素1: ,你的预测: 。
因素2: ,你的预测: 。 因素3: ,你的预测: 。
(2)、从你所列因素中选出一项,通过实验验证你的预测,你设计的实验方案是:
。
10、如图所示:是A、B、C三种物质的溶解度曲线,据图回答下列问题:
(1)、曲线上Q点表示的意义是 。(2)、t1 ℃ 时,A、B、C 三种物质的溶解度由大到小的顺序是: (填写序号,下同)。(3)、t1 ℃ 时,30克A物质加入到50克水中不断搅拌充分溶解,形成的溶液的溶质质量是 。(4)、将t1 ℃ 时,A、B、C 三种物质饱和溶液的温度升高到t2℃ 时,三种溶液的溶质质量分数有大到小的关系是: 。(5)、若A中混有少量晶体B,欲提纯晶体A,可采取的最合理的结晶方法是: 法。
11、现有一块质量为20g的铜锌合金,与148.4g稀硫酸恰好完全反应,生成氢气0.4g,求:(1)、此合金中铜的质量分数(2)、所用稀硫酸的溶质质量分数(3)、反应后所得溶液的溶质质量分数
12、某化学研究小组对当地的石灰石样品进行实验研究。称取石灰石样品8克,把稀盐酸分四次加入样品中,测得实验数据如下表(样品中的杂质不溶于水,也不反应,二氧化碳不溶解)。
实验序号 加入稀盐酸的质量/g 剩余物质的质量/g
第一次 10 5.5
第二次 10 3
第三次 10 1.6
第四次 10 m
(1)、第四次剩余物质的质量m= g。(2)、石灰石样品中碳酸钙的质量分数是多少?
(3)、 此稀盐酸的溶质质量分数是多少?
13、将10g碳酸钙粉末放入一定量的盐酸中恰好完全反应,所得溶液中溶质质量分数为20%,试求:(1)、生成二氧化碳的质量(2)、反应后所得溶液的质量
(3)、参加反应的盐酸的溶质的质量分数(计算结果保留一位小数)
悬浊液
溶质
饱和溶液
结晶
溶液
溶解过程
溶解度
溶质的质量分数
溶剂
乳浊液
不饱和溶液
乳化现象
溶解度\克
温度/℃
A
B
C
0
t2
t1
Q
30
【复习目标:】1、建立溶液的概念并认识溶液、溶质、溶剂三者之间的关系。
2、如何引导学生从微观角度分析溶解过程中的放热和吸热现象。
3、建立饱和溶液和溶解度的概念
4、溶液的溶质质量分数的概念和简单的计算以及配制一定溶质质量分数的溶液。
5、溶液的溶质质量分数简单的计算以及溶质质量分数和化学方程式混合的综合计算。
【课前复习】一、本单元知识结构梳理图:
【课内探究】一、自主学习:
知识点1:溶液的概念和特征,溶质,溶剂的概念和三者的关系
(1)、溶液是指: 其基本特征是: 、 、和 。(2)、溶液一定是无色透明的吗?无色透明的液体一定是溶液吗? 理由是: (举例说明)。
(3)、溶质是指: ,溶剂是指: 。
(4)、溶液的质量等于 与 质量之和。(思考溶液的体积怎样?)
知识点2:饱和溶液,不饱和溶液的概念及相互转化的措施
(1)、饱和溶液是指: ,不饱和溶液是指 。
(2)、饱和溶液变为不饱和溶液的措施有: 或 ;不饱和溶液变为饱和溶液的措施有: 、 或 。(注意适用条件)
知识点3:物质溶解度的概念及含义的理解(四要素)
(1)、固体溶解度是指: 。其四要素是: 、 、 、 。气体溶解度是指:
,其影响因素与 和 有关。(如何影响?)
知识点4:固体物质溶解度曲线的变化规律(三条特殊曲线)
溶解度曲线可以相交,其交点的涵义是: 。
变化规律:三条: ; ; 。
知识点5:溶质质量分数的概念及计算公式和变形公式的应用
溶质质量分数是指 与 的比,其数学表达式是: ,变形公式是: 或 。
知识点6:配制一定质量分数的溶液所需的实验仪器和实验步骤 。配制一定质量分数的溶液实验所需实验仪器是: 。实验步骤是:三步: 、 、 。
三、精讲点拨:1、溶液从广义上来讲,不一定都是液体,只要是一种或几种物质分散到另一种物质里形成的均一,稳定的混合物就是溶液。例如:空气就是一种溶液,前面学习的合金也是一种溶液。所以,溶液,溶质和溶剂都可以是固体,液体和气体三种状态,不一定都是液体。
关于溶质和溶剂的区分有三种情况:1、固体和液体混合:一般把固体看作溶质,液体看作溶剂;2、气体和液体混合:一般把气体看作是溶质,液体看作溶剂;3、液体和液体混合:一般把量少的看作是溶质,量多的看作是溶剂(当与水混合时,不论量多量少,水都作溶剂,水是一种最常用的溶剂,但并不是唯一的溶剂。)
2、四者的关系是:饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。溶液的“饱和与不饱和”反映的是在一定温度下,一定量的溶剂里能否继续溶解某种溶质的问题,而溶液的“浓和稀”反映的是在一定量的溶液里,所含溶质质量的多或少的问题,两者之间并无必然的联系。
3、溶解度和溶质质量分数的区别见下表:
溶解度 溶质的质量分数
意义 表示物质溶解性大小的量度 表示溶液中溶质质量的相对多少
温度要求 与温度有关 一般与温度无关
量的关系 表示溶质质量与溶剂质量的关系 表示溶质质量与溶液质量的关系
溶液是否饱和 饱和溶液 不一定是饱和溶液
有无单位 与质量的单位相同(克或千克) 无
计算公式 溶解度﹦(溶质质量/溶剂质量)×100克 溶质的质量分数﹦(溶质质量/溶液质量)×100%
联系 都能表示已经溶解的溶质的质量,在一定温度下,若某物质的溶解度是Sg,其饱和溶液的溶质质量分数为(Sg/100g+Sg)×100%=a%(a%为饱和溶液的溶质质量分数)则有:在该温度下,S>a,可推导出S=100a/100-a
通过以上表格我们可以看出:溶解度对应的溶液一定是饱和溶液,而质量分数对应的溶液不一定是饱和溶液。只有当溶液达到饱和时,质量分数才与溶解度有这样的关系:(Sg/100g+Sg)×100%=a%(当S>a时,才成立)。此时,质量分数与溶解度有关,与温度有关。利用溶解度可以计算该温度下饱和溶液的溶质质量分数。(给我们提供了一种计算饱和溶液溶质质量分数的方法)
4、溶解度曲线的意义及应用主要从以下三个方面理解:
点:曲线上的点:表示此物质在该温度下的溶解度;两曲线的交点:表示两物质在此温度下的溶解度相等。
线:物质在不同温度下的溶解度随温度变化的趋势。
面:曲线下面的各点:表示的溶液是不饱和溶液;曲线上面的各点:表示溶液是饱和溶液且有未溶晶体存在。(或是过饱和溶液)
5、溶质质量分数与化学方程式的综合计算:
在进行此类计算时,首先要正确区分反应后所得溶液的溶质和溶剂各是什么,其次是分别求出溶质和溶液的质量。求溶液质量时很容易出错,要特别注意。通常有两种方法:一是:溶液组成法:溶液质量=溶质质量+溶剂质量,其中溶质质量必须是被溶解了的质量,溶剂水是根据不同的题目通常有两种情况:原溶液中的水和反应后新生成的水。求水的质量时一定要找全,找准水的质量,然后在加上溶质的质量就是溶液的质量。这一点很容易出错,要特别注意。二是:质量守恒法:公式:反应后溶液的质量=反应前溶液的质量-反应后生成沉淀的质量-生成气体的质量。此法比较简单,不容易出错,我们提倡使用此法求解。
6、配制溶液实验的误差分析:导致所配制的溶液的溶质质量分数偏小的原因可能有以下几种情况:(1)、用量筒量水时仰视读数,(2)、配制溶液时,烧杯用蒸馏水润洗 (3)、在托盘天平的左盘称取药品时,游码不在零位置就调节天平平衡,后将游码移动得到读数 (4)、盛装溶液的试剂瓶用蒸馏水润洗 (5)、使用的药品不纯 (6)、用天平称量药品时,药品放在右盘,砝码放在左盘进行称量。(偏高的原因请同学们自己总结)
交流与反思:通过本节课的学习,本节课你还有没有感到疑惑的知识谈谈本节课你的收获与感悟。
四、巩固检测:选择题:
1、把少量物质分别加入到另一种物质中,充分搅拌,可以得到溶液的是( )
A、碘加入到汽油中 B、面粉加入到水中C、高锰酸钾加入到汽油中 D、植物油加入到水中
2、乳化在工农业生产和日常生活中有着十分广泛的应用,下列各用途与乳化有关的是( )
①用洗衣粉洗去衣服上的油脂② 用盐酸洗去铁块表面的铁锈 ③农药、医药制剂的配制 ④将浓硫酸加入到水中放出大量的热 ⑤金属表面油污的清洗 ⑥各种日用洗涤剂和化妆品的配制
A、①②③④⑤⑥B、①②③⑤⑥C、①③⑤⑥D、①③④⑤⑥
3、生活中的下列现象不能说明气体的溶解度随温度的升高而减小的是( )
A、打开啤酒瓶盖,有大量气泡冒出B、烧开水时,沸腾前有气泡逸出C、夏季黄昏,池塘里的鱼常浮出水面D、喝汽水时感到有气体冲到鼻腔
4、现有60℃硝酸钾溶液500克,保持温度不变,蒸发10克水,则溶液中一定保持不变的是( )
A、溶质的质量 B、溶剂的质量 C、溶液的质量 D、硝酸钾的溶解度
5、在25℃时,向饱和的澄清石灰水中加入少量的氧化钙再恢复至25℃,关于该溶液的下列说法正确是( )A、溶质是质量不变 B、溶质的质量减少
C、溶质的质量分数减少 D、溶质的质量分数增大
6、现有100克溶质质量分数为10%的食盐溶液,若使溶液中溶质质量分数增加一倍,下列操作中正确的是( )A、加入食盐10克 B、加入水50克 C、蒸发掉水50克
D、加入100克溶质质量分数为10%的食盐溶液
7、某同学在t℃时,用100克硝酸钾溶液做结晶实验,他先将溶液蒸发掉20克水,冷却至t℃,得到8克晶体(晶体不含结晶水);然后继续蒸发掉10克水,冷却到t℃,又得到6克晶体。则该同学所取原溶液中溶质的质量是( )A、10克 B、35克 C、37克 D、60克
8、在配制质量分数为10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的原因可能是( )①用量筒量取水时俯视读数② 配制溶液的烧杯用少量蒸馏水润洗 ③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数 ④盛装溶液的试剂瓶用蒸馏水润洗⑤使用的氯化钠晶体不纯 A、①②③④⑤ B、①②④⑤ C、①②③ D、②③④⑤
9、京京在厨房做饭时,发现很多因素都能影响食盐在水中的溶解速率,于是就大胆进行猜测,请你帮助京京猜想一下:(1)、从你能想到的可能影响食盐在水中溶解速率的因素中,写出两项,并预测此因素对食盐溶解速率的影响。因素1: ,你的预测: 。
因素2: ,你的预测: 。 因素3: ,你的预测: 。
(2)、从你所列因素中选出一项,通过实验验证你的预测,你设计的实验方案是:
。
10、如图所示:是A、B、C三种物质的溶解度曲线,据图回答下列问题:
(1)、曲线上Q点表示的意义是 。(2)、t1 ℃ 时,A、B、C 三种物质的溶解度由大到小的顺序是: (填写序号,下同)。(3)、t1 ℃ 时,30克A物质加入到50克水中不断搅拌充分溶解,形成的溶液的溶质质量是 。(4)、将t1 ℃ 时,A、B、C 三种物质饱和溶液的温度升高到t2℃ 时,三种溶液的溶质质量分数有大到小的关系是: 。(5)、若A中混有少量晶体B,欲提纯晶体A,可采取的最合理的结晶方法是: 法。
11、现有一块质量为20g的铜锌合金,与148.4g稀硫酸恰好完全反应,生成氢气0.4g,求:(1)、此合金中铜的质量分数(2)、所用稀硫酸的溶质质量分数(3)、反应后所得溶液的溶质质量分数
12、某化学研究小组对当地的石灰石样品进行实验研究。称取石灰石样品8克,把稀盐酸分四次加入样品中,测得实验数据如下表(样品中的杂质不溶于水,也不反应,二氧化碳不溶解)。
实验序号 加入稀盐酸的质量/g 剩余物质的质量/g
第一次 10 5.5
第二次 10 3
第三次 10 1.6
第四次 10 m
(1)、第四次剩余物质的质量m= g。(2)、石灰石样品中碳酸钙的质量分数是多少?
(3)、 此稀盐酸的溶质质量分数是多少?
13、将10g碳酸钙粉末放入一定量的盐酸中恰好完全反应,所得溶液中溶质质量分数为20%,试求:(1)、生成二氧化碳的质量(2)、反应后所得溶液的质量
(3)、参加反应的盐酸的溶质的质量分数(计算结果保留一位小数)
悬浊液
溶质
饱和溶液
结晶
溶液
溶解过程
溶解度
溶质的质量分数
溶剂
乳浊液
不饱和溶液
乳化现象
溶解度\克
温度/℃
A
B
C
0
t2
t1
Q
30
同课章节目录
