新人教版高一化学必修第二册第六章第一节《化学反应与能量变化》第1-2课时 化学能与热能 教学课件(68张ppt)
文档属性
| 名称 | 新人教版高一化学必修第二册第六章第一节《化学反应与能量变化》第1-2课时 化学能与热能 教学课件(68张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-25 15:28:02 | ||
图片预览









文档简介
(共68张PPT)
新人教版高一化学必修第二册第六章
第一节
化学反应与能量变化
化学能与热能
第1课时
第2课时
第一节
化学反应与能量变化
化学能与热能
第1课时
700多年前,著名的意大利旅行家马克·波罗到过中国,看见中国人烧煤炼铁,这是他生平第一次看到煤做燃料,马克·波罗在他的游记里记载了这件新鲜事。书中写到,中国有一种黑色石头,能燃烧,着起火来像火柴一样,而且终夜不灭。现代科学可以这样解释,煤中含有大量的碳,燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么关系?石灰石要经过高温煅烧才能变成生石灰,高温条件提供的热能在石灰石的分解中有什么作用?请随我一起学习化学能与热能。
化学变化的特征:
化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。
一是制取新物质;
二是利用反应中的能量。
我们利用化学反应可以:
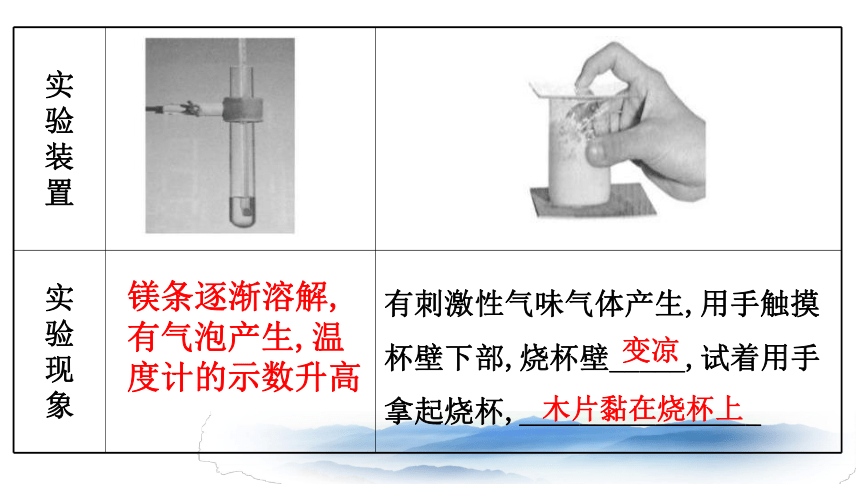
实验
实
验
操
作
试管中加入2
mL
2
mol·L-1盐酸,并用温度计测量其温度,再向试管中放入打磨过的镁条
将20
g
Ba(OH)2·8H2O晶体研细后与10
g
NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,玻璃片盖上烧杯
一、
化学反应与能量
实
验
装
置
实
验
现
象
有刺激性气味气体产生,用手触摸杯壁下部,烧杯壁_____,试着用手拿起烧杯,________________
镁条逐渐溶解,有气泡产生,温度计的示数升高
变凉
木片黏在烧杯上
实验
结论
该反应_________
该反应_________
化学反应发生时伴有_________________
放出热量
吸收热量
热量的释放和吸收
链接实验视频
根据上述两个反应、以及学过的其他化学反应和生活
经验,说明化学反应发生的过程中伴随有能量的变化:
有的化学反应放热,化学能转化为热能;
有的化学反应吸热,热能转化为化学能。
释放热量的化学反应,叫放热反应
吸收热量的化学反应,叫吸热反应
【思考】冬季生活中常常采用下列方法获得热量:
①烧炭取暖;②用电暖器取暖;③天然气壁挂炉取暖;④空调取暖;⑤地下水循环取暖等,都属于放热反应吗?
提示:①③属于。发生化学反应时释放热量才是放热反应,①③分别属于煤炭和甲烷的燃烧反应。②④是电能转化为热能;⑤只是热量的交换。
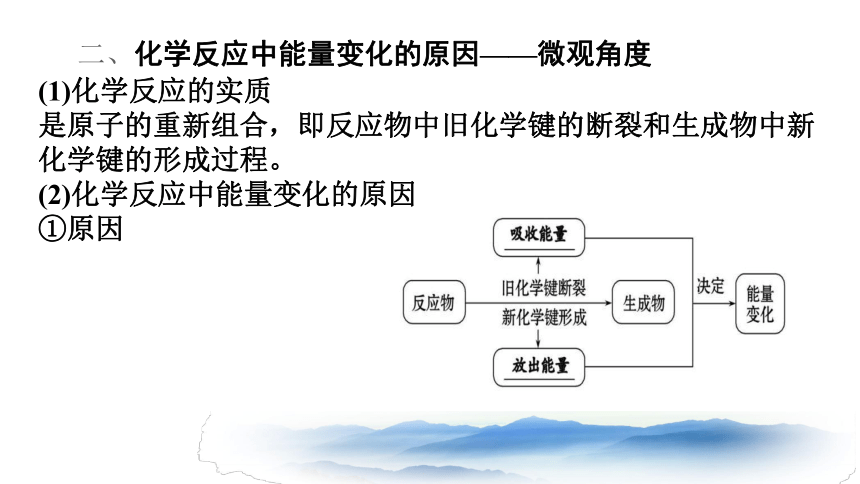
二、化学反应中能量变化的原因——微观角度
(1)化学反应的实质
是原子的重新组合,即反应物中旧化学键的断裂和生成物中新化学键的形成过程。
(2)化学反应中能量变化的原因
①原因
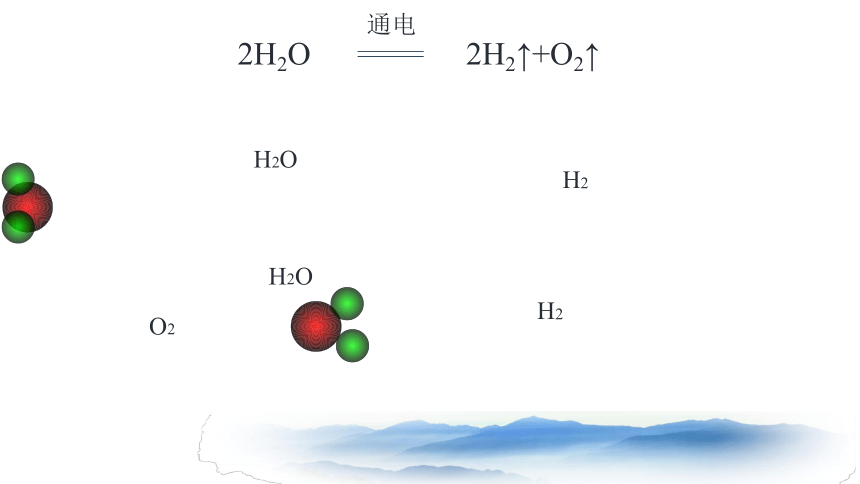
H2O
H2O
H2
H2
O2
2H2O
通电
2H2↑+O2↑
反应物
原子拆分,旧键断裂
原子结合,新键形成
生成物
化学反应的过程
吸收能量
放出能量
化学反应中能量变化的主要原因:
就是化学键的断裂与形成
计算分析:
化学键
反应中能量变化
1
mol化学键
反应中能量变化
H—H
吸收436
kJ
共吸收679
kJ
Cl—Cl
吸收243
kJ
H—Cl
放出431
kJ
共放出862
kJ
结论
679
kJ-862
kJ=-183
kJ,即反应放出
183
kJ热量
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
化学反应中能量变化的主要原因
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
吸收能量
断开
断开
吸收能量
形成
放出能量
点燃
化学键的断裂和形成是化学反应中能量变化的主要原因。
从化学键的观点来分析能量的变化
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
2.化学反应中能量变化的决定因素——宏观角度
各种物质都储存有化学能。不同的物质不仅组成不同,结构不同,所包含的化学能也不同。
(1)物质的稳定性与能量的关系
(2)化学反应中能量变化的决定因素(用E表示物质能量)
在化学反应中,物质发生了变化,化学能也随之改变。化学反应过程中吸收或放出能量可形象地表示如下:
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放出能量
吸收能量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
结论:化学反应中的能量变化取决于反应物总能量与生成物总能量的相对大小。
图示:
反应物的能量
生成物的能量
能量的释放
反应物的能量
生成物的能量
能量的吸收
反应物的总能量=生成物的总能量+放出的能量
生成物的总能量=反应物的总能量+吸收的能量
图
2-1
水
能
、
化
学
能
对
比
示
意
图
规律:
(1)如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
(2)如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。
规律
吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应。
(2)根据化学键断裂或形成时的能量变化判断——用于计算。
若断裂反应物中的化学键所吸收的总能量小于形成生成物中化学键所放出的总能量,属于放热反应,反之是吸热反应。
(3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。
(4)根据反应条件判断。凡是持续加热才能进行的反应一般是吸热反应。
特别提醒
(1)三个“不一定”:
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;
②放热反应常温下不一定容易发生,如铝热反应;
③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(2)吸热反应和放热反应都是化学变化。NaOH固体溶于水是放热过程,但不是放热反应;升华、蒸发、蒸馏等过程是吸热过程,但不是吸热反应。
(3)吸热反应不一定需要加热,放热反应不一定不需要加热
(4)化学变化一定伴随着能量变化,有能量变化不一定是化学变化
易错提醒
1.化学反应中的能量变化决定于反应物总能量和生成物总能量的相对大小,不取决于部分反应物和部分生成物能量的相对大小。
2.需要加热的化学反应不一定是吸热反应,常温下能够进行的化学反应,也不一定是放热反应。
3.任何化学反应,不是吸热反应,就是放热反应,即任何化学反应过程中都会有能量的变化。
4.切勿把吸热的物理过程或放热的物理过程判断为吸热反应或放热反应。
1.下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
A
【解析】任何化学反应都有能量的变化,但有能量变化的过程不一定是化学变化,如物质的三态变化,虽然存在能量变化,但不存在旧化学键的断裂与新化学键的形成,故不是化学变化,B项错误;化学反应中能量变化的形式有多种,除热能外,还有光能、电能等,C项错误;由图象知,该过程中反应物的总能量大于生成物的总能量,故该过程中放出能量,D项错误。
2.已知2SO2+O2
2SO3为放热反应,对该反应的下列说法正确的是
( )
A.O2的能量一定高于SO2的能量
B.2
mol
SO2和1
mol
O2的总能量一定高于2
mol
SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
B
【解析】因反应2SO2+O2
2SO3为放热反应,所以2
mol
SO2和1
mol
O2的能量和一定高于2
mol
SO3的能量,A错误,B正确,C错误;化学反应的实质是旧键的断裂和新键的形成,而断键过程需要吸收能量,故放热反应有些也需要一定条件,该反应是放热的,但需要加热才能发生,D错误。
3.
下列各图中,表示吸热反应的图是
( )
【解析】反应物的总能量小于生成物的总能量则为吸热反应。
A
4.关于吸热反应的说法正确的是
( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
【解析】反应放热还是吸热与是否加热无直接的关系,与是否使用催化剂也无直接关系,多数吸热反应需要加热,但有的不需要加热,例如Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,且该反应属于复分解反应,故A、B、C三项错。放热反应的逆过程一定是吸热反应,D正确。
D
随着人们生活节奏的加快,市场上出现了多种类型的“即食饭盒”等快速给食物加热的产品。
下面让我们探究它们的工作原理。
(1)有一“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合?
( )
A.硝酸铵和水
B.浓硫酸和水
C.氧化钙和水
D.固体酒精和水
提示:硝酸铵溶于水吸热,A选项错误;浓硫酸具有腐蚀性,且操作不方便,B选项错误;氧化钙与水反应放出大量的热,C选项正确;酒精溶于水时热效应不明显,D选项错误。
C
(2)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生反应:Mg+2H2O====X+H2↑。请根据以上信息回答下列各题:
①该饭盒底部“即热”存在什么能量之间的转化?
提示:化学能转化为热能。
②已知X是一种碱,则X的化学式是什么?你推断X的化学式的依据是什么?
提示:根据质量守恒(原子守恒)定律可知X的化学式为Mg(OH)2。
③上述化学反应属于哪种基本反应类型?由该反应可知化学反应发生时都伴随什么变化?
提示:置换反应。化学反应发生时都伴随着物质的变化和能量的变化。
谢谢大家
第一节
化学反应与能量变化
化学能与热能
第2课时
二:化学能与热能的相互转化
1.两条基本的自然规律
(1)质量守恒定律:自然界的物质发生转化时,
保持不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但体系包含的
不变。
2.化学能与热能的相互转化
(1)吸热反应和放热反应
①吸热反应:
吸收热量的化学反应。
②放热反应:
放出热量的化学反应。
放热反应
吸热反应
定义
释放热量的化学反应
吸收热量的化学反应
宏观
解释
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
微观
解释
生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量
生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
吸热反应与放热反应的比较
1.放热反应和吸热反应
图示
实例
NaOH+HCl===
NaCl+H2O
Ba(OH)2·8H2O+2NH4Cl===
BaCl2+2NH3↑+10H2O
常见的放热反应和吸热反应
放热反应
吸热反应
大部分化合反应
酸碱中和反应
金属与酸或水的置换反应
可燃物的燃烧反应
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
大部分分解反应
缓慢氧化还原反应(食物腐败、铁的生锈、葡萄糖体内氧化)
C+CO2==2CO
△
C+H2O==H2+CO
高温
CuO+H2
==
Cu+H2O
△
【规律方法】放热反应和吸热反应判断“四"方法
(1)依据反应条件判断。通常需要持续加热的反应为吸热反应。
(2)依据能量变化图象判断。反应物的总能量大于生成物的总能量,则反应为放热反应;反之,则为吸热反应。
(3)依据断键和成键所吸收和释放的能量数据判断。如果旧键断裂吸收的能量大于新键形成释放的能量,则为吸热反应;反之,为放热反应。
(4)经验判断法:根据常见的放热反应、吸热反应的类型判断。
能量和动力
能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可回避的能源危机。
三、化学能的应用
16.6%
2.1%
5.1%
76.2%
我国化石燃料和水电能源消耗构成图
常见的能源主要有以下十种:
太阳能、化石能源、水能、
风能、潮汐能、地热能、生物质能、核能以
及氢能。
社会发展与能源利用
人类利用能源的三个阶段
柴草时期
中国古代制陶图
化石能源时期
多能源结构时期
1.化石燃料利用过程中亟待解决的两方面问题
(1)一是其短期内不可再生,储量有限;
(2)二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
2.在燃料利用过程中,节能的主要环节:
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
3.新能源
(1)特点:资源丰富、______________________。
(2)人们比较关注的新能源:_____能、___能、地热能、海洋能和___能等。
可以再生,对环境无污染
太阳
风
氢
[思考]1.有化学键断裂的变化一定是化学变化吗?
[提示] 有化学键断裂的变化不一定是化学变化。如:HCl溶于水时,在水分子的作用下,H—Cl键被破坏,但是无新化学键的生成,不是化学变化。
2.放热反应是否一定不需加热?吸热反应是否一定必须加热?
[提示] 根据2Na+O2△(=====)Na2O2和NH4Cl与Ba(OH)2·8H2O反应可知,放热反应可能需要加热,吸热反应也可能不需加热。因此化学反应是吸热还是放热与反应条件无关,而是决定于反应物总能量与生成物总能量的相对大小。
3.(1)物质发生化学反应都伴随着能量的变化,那么有能量变化的物质变化一定是化学变化吗?
(2)化学反应中的能量变化是否只表现为热量的变化?
[提示] (1)不一定。物质发生物理变化时也会伴有能量变化。如浓硫酸的稀释、氢氧化钠的溶解、冰融化成液态的水等都有能量的变化。
(2)不是。化学反应中一定有能量的变化,通常表现为热量的变化,但也可能有其他的能量形式,如电能或光能等。
【思考】2019中国(山西)国际清洁能源博览会于2019年6月28日上午在太原开幕。
本次展会以“清洁低碳、绿色发展”为主题,聚焦煤炭清洁利用、新能源、储能、节能环保等领域,展示新技术新产品新应用,搭建中西部清洁能源及设备供需平台,促进煤改电、煤改气、煤改清洁采暖在中西部的实施,加强雾霾的治理,有效改善呼吸环境。
(1)提高燃料的燃烧效率应该从哪些方面考虑?
提示:使燃料与氧气充分接触,如将煤粉碎、液化和气化;通入充足的氧气。
(2)日常生产、生活中常常采用下列能源:
①煤;②石油;③天然气;④太阳能;⑤水能;⑥氢能;⑦核能;⑧风能;⑨地热能等,属于清洁能源的有哪些?
提示:④⑤⑥⑦⑧⑨。清洁能源即绿色能源,是指不排放污染物、能够直接用于生产生活的能源,它包括核能和可再生能源。可再生能源是指原材料可以再生的能源,如水力发电、风力发电、太阳能、水能、生物能(沼气)、地热能(包括地源和水源)、海潮能等能源。
1.下列变化过程需要吸收能量的是( )
A.氢气球遇火发生爆炸
B.向污染的河水中投放生石灰
C.
D.
D
解析 氢气的燃烧爆炸、CaO与水的反应、形成化学键的过程都要放出能量,断裂化学键时需要吸收能量。
2.现在人类直接利用的主要化石能源是( )
A.太阳能
B.核能
C.氢能
D.煤
D
解析 化石能源包括石油、煤和天然气。
A.为放热反应
B.为吸热反应
C.属于燃烧反应
D.属于中和反应
3.如图为某化学反应的能量—反应进程图,由此可判断该反应( )
B
解析 由图像可知该反应反应物的总能量低于生成物的总能量,该反应是吸热反应,而物质的燃烧反应、酸碱中和反应是放热反应。
4.下列有关能量转化的认识不正确的是( )
A.通过植物的光合作用,太阳能转化为化学能
B.人类使用照明设备,将电能转化为光能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效
D.燃料燃烧,只是将化学能转化为了热能
D
解析 A项,植物的光合作用是在太阳光作用下合成了新物质,太阳能转化为化学能,正确;B项,人类使用照明设备照明是电能转化为光能,正确;C项,生物体内的化学变化过程在能量转化上更为合理、有效,正确;D项,燃烧是剧烈的发光放热的氧化还原反应,反应过程中可产生光能、热能等,错误。
谢谢大家
新人教版高一化学必修第二册第六章
第一节
化学反应与能量变化
化学能与热能
第1课时
第2课时
第一节
化学反应与能量变化
化学能与热能
第1课时
700多年前,著名的意大利旅行家马克·波罗到过中国,看见中国人烧煤炼铁,这是他生平第一次看到煤做燃料,马克·波罗在他的游记里记载了这件新鲜事。书中写到,中国有一种黑色石头,能燃烧,着起火来像火柴一样,而且终夜不灭。现代科学可以这样解释,煤中含有大量的碳,燃烧时放出热能。你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么关系?石灰石要经过高温煅烧才能变成生石灰,高温条件提供的热能在石灰石的分解中有什么作用?请随我一起学习化学能与热能。
化学变化的特征:
化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。
一是制取新物质;
二是利用反应中的能量。
我们利用化学反应可以:
实验
实
验
操
作
试管中加入2
mL
2
mol·L-1盐酸,并用温度计测量其温度,再向试管中放入打磨过的镁条
将20
g
Ba(OH)2·8H2O晶体研细后与10
g
NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,玻璃片盖上烧杯
一、
化学反应与能量
实
验
装
置
实
验
现
象
有刺激性气味气体产生,用手触摸杯壁下部,烧杯壁_____,试着用手拿起烧杯,________________
镁条逐渐溶解,有气泡产生,温度计的示数升高
变凉
木片黏在烧杯上
实验
结论
该反应_________
该反应_________
化学反应发生时伴有_________________
放出热量
吸收热量
热量的释放和吸收
链接实验视频
根据上述两个反应、以及学过的其他化学反应和生活
经验,说明化学反应发生的过程中伴随有能量的变化:
有的化学反应放热,化学能转化为热能;
有的化学反应吸热,热能转化为化学能。
释放热量的化学反应,叫放热反应
吸收热量的化学反应,叫吸热反应
【思考】冬季生活中常常采用下列方法获得热量:
①烧炭取暖;②用电暖器取暖;③天然气壁挂炉取暖;④空调取暖;⑤地下水循环取暖等,都属于放热反应吗?
提示:①③属于。发生化学反应时释放热量才是放热反应,①③分别属于煤炭和甲烷的燃烧反应。②④是电能转化为热能;⑤只是热量的交换。
二、化学反应中能量变化的原因——微观角度
(1)化学反应的实质
是原子的重新组合,即反应物中旧化学键的断裂和生成物中新化学键的形成过程。
(2)化学反应中能量变化的原因
①原因
H2O
H2O
H2
H2
O2
2H2O
通电
2H2↑+O2↑
反应物
原子拆分,旧键断裂
原子结合,新键形成
生成物
化学反应的过程
吸收能量
放出能量
化学反应中能量变化的主要原因:
就是化学键的断裂与形成
计算分析:
化学键
反应中能量变化
1
mol化学键
反应中能量变化
H—H
吸收436
kJ
共吸收679
kJ
Cl—Cl
吸收243
kJ
H—Cl
放出431
kJ
共放出862
kJ
结论
679
kJ-862
kJ=-183
kJ,即反应放出
183
kJ热量
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
化学反应中能量变化的主要原因
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
吸收能量
断开
断开
吸收能量
形成
放出能量
点燃
化学键的断裂和形成是化学反应中能量变化的主要原因。
从化学键的观点来分析能量的变化
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小
2.化学反应中能量变化的决定因素——宏观角度
各种物质都储存有化学能。不同的物质不仅组成不同,结构不同,所包含的化学能也不同。
(1)物质的稳定性与能量的关系
(2)化学反应中能量变化的决定因素(用E表示物质能量)
在化学反应中,物质发生了变化,化学能也随之改变。化学反应过程中吸收或放出能量可形象地表示如下:
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放出能量
吸收能量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
结论:化学反应中的能量变化取决于反应物总能量与生成物总能量的相对大小。
图示:
反应物的能量
生成物的能量
能量的释放
反应物的能量
生成物的能量
能量的吸收
反应物的总能量=生成物的总能量+放出的能量
生成物的总能量=反应物的总能量+吸收的能量
图
2-1
水
能
、
化
学
能
对
比
示
意
图
规律:
(1)如果反应物所具有的总能量高于生成物所具有的总能量,那么在发生化学反应时,就有部分能量以热的形式释放出来;
(2)如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量,才能转化为生成物。
规律
吸热反应和放热反应的判断方法
(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应。
(2)根据化学键断裂或形成时的能量变化判断——用于计算。
若断裂反应物中的化学键所吸收的总能量小于形成生成物中化学键所放出的总能量,属于放热反应,反之是吸热反应。
(3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。
(4)根据反应条件判断。凡是持续加热才能进行的反应一般是吸热反应。
特别提醒
(1)三个“不一定”:
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;
②放热反应常温下不一定容易发生,如铝热反应;
③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(2)吸热反应和放热反应都是化学变化。NaOH固体溶于水是放热过程,但不是放热反应;升华、蒸发、蒸馏等过程是吸热过程,但不是吸热反应。
(3)吸热反应不一定需要加热,放热反应不一定不需要加热
(4)化学变化一定伴随着能量变化,有能量变化不一定是化学变化
易错提醒
1.化学反应中的能量变化决定于反应物总能量和生成物总能量的相对大小,不取决于部分反应物和部分生成物能量的相对大小。
2.需要加热的化学反应不一定是吸热反应,常温下能够进行的化学反应,也不一定是放热反应。
3.任何化学反应,不是吸热反应,就是放热反应,即任何化学反应过程中都会有能量的变化。
4.切勿把吸热的物理过程或放热的物理过程判断为吸热反应或放热反应。
1.下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
A
【解析】任何化学反应都有能量的变化,但有能量变化的过程不一定是化学变化,如物质的三态变化,虽然存在能量变化,但不存在旧化学键的断裂与新化学键的形成,故不是化学变化,B项错误;化学反应中能量变化的形式有多种,除热能外,还有光能、电能等,C项错误;由图象知,该过程中反应物的总能量大于生成物的总能量,故该过程中放出能量,D项错误。
2.已知2SO2+O2
2SO3为放热反应,对该反应的下列说法正确的是
( )
A.O2的能量一定高于SO2的能量
B.2
mol
SO2和1
mol
O2的总能量一定高于2
mol
SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
B
【解析】因反应2SO2+O2
2SO3为放热反应,所以2
mol
SO2和1
mol
O2的能量和一定高于2
mol
SO3的能量,A错误,B正确,C错误;化学反应的实质是旧键的断裂和新键的形成,而断键过程需要吸收能量,故放热反应有些也需要一定条件,该反应是放热的,但需要加热才能发生,D错误。
3.
下列各图中,表示吸热反应的图是
( )
【解析】反应物的总能量小于生成物的总能量则为吸热反应。
A
4.关于吸热反应的说法正确的是
( )
A.凡需加热的反应一定是吸热反应
B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应
D.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
【解析】反应放热还是吸热与是否加热无直接的关系,与是否使用催化剂也无直接关系,多数吸热反应需要加热,但有的不需要加热,例如Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,且该反应属于复分解反应,故A、B、C三项错。放热反应的逆过程一定是吸热反应,D正确。
D
随着人们生活节奏的加快,市场上出现了多种类型的“即食饭盒”等快速给食物加热的产品。
下面让我们探究它们的工作原理。
(1)有一“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,可以食用了,非常方便。请你推测其白色固体和无色液体可能是如下哪个组合?
( )
A.硝酸铵和水
B.浓硫酸和水
C.氧化钙和水
D.固体酒精和水
提示:硝酸铵溶于水吸热,A选项错误;浓硫酸具有腐蚀性,且操作不方便,B选项错误;氧化钙与水反应放出大量的热,C选项正确;酒精溶于水时热效应不明显,D选项错误。
C
(2)目前市面上有一种新型饭盒“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物。使用时打开隔离层,即发生反应:Mg+2H2O====X+H2↑。请根据以上信息回答下列各题:
①该饭盒底部“即热”存在什么能量之间的转化?
提示:化学能转化为热能。
②已知X是一种碱,则X的化学式是什么?你推断X的化学式的依据是什么?
提示:根据质量守恒(原子守恒)定律可知X的化学式为Mg(OH)2。
③上述化学反应属于哪种基本反应类型?由该反应可知化学反应发生时都伴随什么变化?
提示:置换反应。化学反应发生时都伴随着物质的变化和能量的变化。
谢谢大家
第一节
化学反应与能量变化
化学能与热能
第2课时
二:化学能与热能的相互转化
1.两条基本的自然规律
(1)质量守恒定律:自然界的物质发生转化时,
保持不变。
(2)能量守恒定律:一种形式的能量可以转化为另一种形式的能量,但体系包含的
不变。
2.化学能与热能的相互转化
(1)吸热反应和放热反应
①吸热反应:
吸收热量的化学反应。
②放热反应:
放出热量的化学反应。
放热反应
吸热反应
定义
释放热量的化学反应
吸收热量的化学反应
宏观
解释
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
微观
解释
生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量
生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量
吸热反应与放热反应的比较
1.放热反应和吸热反应
图示
实例
NaOH+HCl===
NaCl+H2O
Ba(OH)2·8H2O+2NH4Cl===
BaCl2+2NH3↑+10H2O
常见的放热反应和吸热反应
放热反应
吸热反应
大部分化合反应
酸碱中和反应
金属与酸或水的置换反应
可燃物的燃烧反应
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
大部分分解反应
缓慢氧化还原反应(食物腐败、铁的生锈、葡萄糖体内氧化)
C+CO2==2CO
△
C+H2O==H2+CO
高温
CuO+H2
==
Cu+H2O
△
【规律方法】放热反应和吸热反应判断“四"方法
(1)依据反应条件判断。通常需要持续加热的反应为吸热反应。
(2)依据能量变化图象判断。反应物的总能量大于生成物的总能量,则反应为放热反应;反之,则为吸热反应。
(3)依据断键和成键所吸收和释放的能量数据判断。如果旧键断裂吸收的能量大于新键形成释放的能量,则为吸热反应;反之,为放热反应。
(4)经验判断法:根据常见的放热反应、吸热反应的类型判断。
能量和动力
能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可回避的能源危机。
三、化学能的应用
16.6%
2.1%
5.1%
76.2%
我国化石燃料和水电能源消耗构成图
常见的能源主要有以下十种:
太阳能、化石能源、水能、
风能、潮汐能、地热能、生物质能、核能以
及氢能。
社会发展与能源利用
人类利用能源的三个阶段
柴草时期
中国古代制陶图
化石能源时期
多能源结构时期
1.化石燃料利用过程中亟待解决的两方面问题
(1)一是其短期内不可再生,储量有限;
(2)二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
2.在燃料利用过程中,节能的主要环节:
(1)燃料燃烧阶段——可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
(2)能量利用阶段——可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能量利用率。
3.新能源
(1)特点:资源丰富、______________________。
(2)人们比较关注的新能源:_____能、___能、地热能、海洋能和___能等。
可以再生,对环境无污染
太阳
风
氢
[思考]1.有化学键断裂的变化一定是化学变化吗?
[提示] 有化学键断裂的变化不一定是化学变化。如:HCl溶于水时,在水分子的作用下,H—Cl键被破坏,但是无新化学键的生成,不是化学变化。
2.放热反应是否一定不需加热?吸热反应是否一定必须加热?
[提示] 根据2Na+O2△(=====)Na2O2和NH4Cl与Ba(OH)2·8H2O反应可知,放热反应可能需要加热,吸热反应也可能不需加热。因此化学反应是吸热还是放热与反应条件无关,而是决定于反应物总能量与生成物总能量的相对大小。
3.(1)物质发生化学反应都伴随着能量的变化,那么有能量变化的物质变化一定是化学变化吗?
(2)化学反应中的能量变化是否只表现为热量的变化?
[提示] (1)不一定。物质发生物理变化时也会伴有能量变化。如浓硫酸的稀释、氢氧化钠的溶解、冰融化成液态的水等都有能量的变化。
(2)不是。化学反应中一定有能量的变化,通常表现为热量的变化,但也可能有其他的能量形式,如电能或光能等。
【思考】2019中国(山西)国际清洁能源博览会于2019年6月28日上午在太原开幕。
本次展会以“清洁低碳、绿色发展”为主题,聚焦煤炭清洁利用、新能源、储能、节能环保等领域,展示新技术新产品新应用,搭建中西部清洁能源及设备供需平台,促进煤改电、煤改气、煤改清洁采暖在中西部的实施,加强雾霾的治理,有效改善呼吸环境。
(1)提高燃料的燃烧效率应该从哪些方面考虑?
提示:使燃料与氧气充分接触,如将煤粉碎、液化和气化;通入充足的氧气。
(2)日常生产、生活中常常采用下列能源:
①煤;②石油;③天然气;④太阳能;⑤水能;⑥氢能;⑦核能;⑧风能;⑨地热能等,属于清洁能源的有哪些?
提示:④⑤⑥⑦⑧⑨。清洁能源即绿色能源,是指不排放污染物、能够直接用于生产生活的能源,它包括核能和可再生能源。可再生能源是指原材料可以再生的能源,如水力发电、风力发电、太阳能、水能、生物能(沼气)、地热能(包括地源和水源)、海潮能等能源。
1.下列变化过程需要吸收能量的是( )
A.氢气球遇火发生爆炸
B.向污染的河水中投放生石灰
C.
D.
D
解析 氢气的燃烧爆炸、CaO与水的反应、形成化学键的过程都要放出能量,断裂化学键时需要吸收能量。
2.现在人类直接利用的主要化石能源是( )
A.太阳能
B.核能
C.氢能
D.煤
D
解析 化石能源包括石油、煤和天然气。
A.为放热反应
B.为吸热反应
C.属于燃烧反应
D.属于中和反应
3.如图为某化学反应的能量—反应进程图,由此可判断该反应( )
B
解析 由图像可知该反应反应物的总能量低于生成物的总能量,该反应是吸热反应,而物质的燃烧反应、酸碱中和反应是放热反应。
4.下列有关能量转化的认识不正确的是( )
A.通过植物的光合作用,太阳能转化为化学能
B.人类使用照明设备,将电能转化为光能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效
D.燃料燃烧,只是将化学能转化为了热能
D
解析 A项,植物的光合作用是在太阳光作用下合成了新物质,太阳能转化为化学能,正确;B项,人类使用照明设备照明是电能转化为光能,正确;C项,生物体内的化学变化过程在能量转化上更为合理、有效,正确;D项,燃烧是剧烈的发光放热的氧化还原反应,反应过程中可产生光能、热能等,错误。
谢谢大家
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
