人教版高中化学必修1第二章第3节氧化还原反应(共40张ppt)
文档属性
| 名称 | 人教版高中化学必修1第二章第3节氧化还原反应(共40张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-26 00:00:00 | ||
图片预览










文档简介
(共40张PPT)
氧化还原反应
第一课时
无处不在的氧化还原反应
氧化还原反应在工农业生产、科学技术和日常生活中有着广泛的应用,现作一些简单介绍。
食物的腐烂、铁的生锈、通常使用的干电池、蓄电池都发生着氧化还原反应,煤炭、石油、天然气等燃料的燃烧。
植物的光合作用、人和动物呼吸的作用及食物的消化过程都包含着复杂的氧化还原反应。
我们所需要的各种各样的金属,都是通过氧化还原反应提炼而得到的。如钠、铝、炼铁、炼钢等等。许多重要化工产品的制造,如合成氨、接触法制硫酸、氨氧化法制硝酸、食盐水电解制烧碱等,主要反应也都是氧化还原反应。
由此可见,在许多领域里都涉及到氧化还原反应,学习和掌握氧化还原反应对我们的生活和今后参加工作都是很有意义的。
无处不在的氧化还原反应
【学习目标】
(1)通过分析化学反应中元素化合价的变化,建立氧化还原反应的概念;
(2)通过实验事实和思考,初步理解氧化还原反应的本质;
(3)了解氧化—还原反应在工农业生产、日常生活中的应用。
【学习重点】
(1)认识并建立氧化还原反应的概念。
(2)理解氧化还原反应的本质是电子转移。
⑥CaO
+
H2O
==
Ca(OH)
2
①Fe+CuSO4
==
Cu+FeSO4
【知识回顾】
在初中我们学过哪几种反应类型?判断下列反应属于那种反应类型?
⑦CaCO3==CaO+CO2
↑
高温
⑧2KClO3==2KCl+3O2
↑
△
③NaOH+HCl==NaCl+H2O
化合反应
分解反应
②Zn
+
H2SO4
=
ZnSO4
+
H2↑
④NaCl+AgNO3=NaNO3
+
AgCl
↓
置换反应
复分解反应
标出下述反应中元素的化合价?并判断哪些反应存在元素化合价的变化?
√√
√
√
⑤2Na+Cl2
===
2NaCl
点燃
一、氧化还原反应
1.概念:
在化学反应过程中有元素化合价变化的化学反应叫氧化还原反应
元素化合价没发生变化的化学反应叫非氧化还原反应
⑤2Na+Cl2
===
2NaCl
点燃
⑥CaO
+
H2O
==
Ca(OH)
2
①Fe+CuSO4
==
Cu+FeSO4
【交流研讨】
判断下列反应那些属于氧化还原反应?
⑦CaCO3===CaO+CO2
↑
高温
⑧2KClO3===2KCl+3O2
↑
△
③NaOH+HCl==NaCl+H2O
化合反应
分解反应
是
是
否
否
是
否
否
是
②Zn
+
H2SO4
=
ZnSO4
+
H2↑
④NaCl+AgNO3=NaNO3
+
AgCl
↓
置换反应
复分解反应
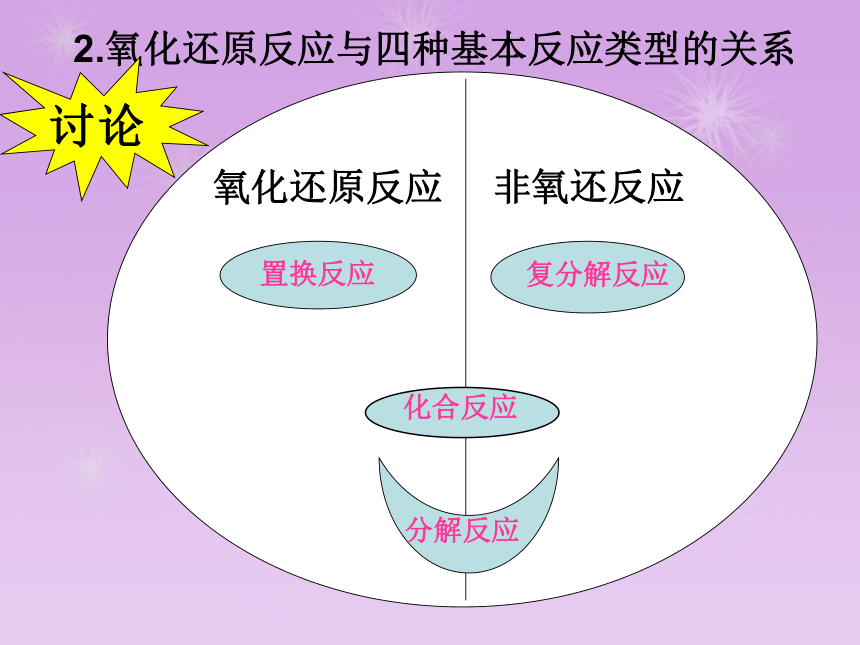
氧化还原反应
非氧还反应
置换反应
复分解反应
化合反应
分解反应
2.氧化还原反应与四种基本反应类型的关系
讨论
讨论
3.氧化反应和还原反应
氧化反应:反应物所含某种或某些元素化合价升高的反应
还原反应:反应物所含某种或某些元素化合价降低的反应
4.氧化反应和还原反应的关系?
【阅读思考】P49页
氧化和还原是两个对立的过程相互依存而统一于一个氧化还原反应中。
5.氧化还原反应的实质
探究
钠在氯气中剧烈燃烧生成氯化钠,这个反应是氧化还原反应吗?为什么?
2Na
+
Cl2====
2NaCl
点燃
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
Na和Cl的反应
+11
8
2
+17
8
8
2
Na+
Cl-
2Na
+
Cl2====
2NaCl
点燃
讨论化合价升降与电子转移有何关系?
5.氧化还原反应的实质
氧化还原反应的实质:电子的转移
【实验探究】
Zn+CuSO4
=
Cu+ZnSO4
按照课本50页图2-3-5连接装置进行实验,观察电流计的指针是否发生偏转。
思考:这一现象,对你认识金属锌与CuSO4溶液反应的实质有什么启发?
现象:电流计指针发生了偏转
结论:线路内有电流产生,发生了电子的定向移动
6、电子转移的表示方法
⑴.双线桥法
起点——反应物中的
变价元素
终点——变价后的该元素
(生成物一侧)
例:
MnO2+4HCl
MnCl2+Cl2↑+2H2O
+4
+2
-1
0
(箭尾)
(箭头)
△
步骤:
⑴.标出变价元素的化合价
⑵.用双箭号表示,箭头从反应物指向
生成物的同一种元素。
⑶.标出失去或得到的电子总数
MnO2+4HCl
MnCl2+Cl2↑+2H2O
△
得到2e-
(或化合价降低2)
失去2e-
(或化合价升高2)
+4
+2
-1
0
MnO2+4HCl
MnCl2+Cl2↑+2H2O
△
+4
+2
-1
0
⑵.单线桥法
起点——还原剂中的
变价元素
终点——氧化剂中的
变价元素
(箭尾)
(箭头)
例:
MnO2+4HCl
MnCl2+Cl2↑+2H2O
+4
-1
△
氧化剂
还原剂
步骤:
1.标出变价元素的化合价
+2
0
2.用单箭号表示,箭头从还原剂指
向氧化剂的变价元素。
注意:1.在表示氧化还原反应中电子
转移的方向和数目时通常用
——双线桥法
(但不写“得”、“失”)
2e-
⑶.标出转移电子的总数
MnO2+4HCl
MnCl2+Cl2↑+2H2O
+4
-1
△
氧化剂
还原剂
+2
0
2.熟练后可省略其“中间环节”
2e-
CuSO4溶液
小灯泡发光
实现了化学能向电能的转变
7.氧化还原反应的应用
【课堂小结】
⑴化合价升降是氧化还原反应的标志;
⑵氧化还原反应的实质是电子转移
;
⑶化合价升高
→失去e-
→
发生氧化反应
化合价降低
→得到e-
→
发生
还原反应
补充练习:
下列化学反应中,那些属于氧还反应?在氧还反应中哪种元素发生了氧化反应,哪种元素发生了还原反应?
1.
2Cu+O2
=
2CuO
△
2.CaO+H2O=Ca(OH)2
3.CaCO3
=
CaO+CO2↑
高温
4.2KMnO4
=
K2MnO4+MnO2+O2↑
△
5.NaCl+AgNO3=NaNO3
+
AgCl
↓
6.CuO
+
H2
=
Cu
+
H2O
△
化学1(必修)第2章第三节氧化剂和还原剂
第二课时
复习:化学反应的类型
化学反应
1.据反应物和生成物的类别及反应前后物质种类的多少
2.反应中是否得氧或失氧
氧化反应
还原反应
复分解反应
化合反应
分解反应
置换反应
A+B==AB
AB==A+B
AB+C==A+CB
AB+CD==AD+CB
交流·研讨
1﹑Cu+Cl2=CuCl2
2﹑Zn+2H+=Zn++H2
3﹑CaCO3+2H+=Ca2++CO2+H2O
4﹑BaCl2+H2SO4=BaSO4+2HCl
5﹑Fe2O3+3CO=2Fe+3CO2
高温
【问】
1、哪些是氧化还原反应?
2、氧化还原反应实质?
3、用双线桥表示电子转移的数目和方向?
拓展
哪些元素化合价升高,对应的物质?
哪些元素化合价降低,对应的物质?
化合价升高的元素
物质
化合价降低的元素
物质
Cu
Zn
C
Cu
Zn
CO
Cl
H
Fe
Cl2
H+
Fe2O3
还原剂
氧化剂
一﹑氧化剂还原剂
1、氧化剂:
所含元素化合价降低的反应物
2、还原剂:
所含元素化合价升高的反应物
特征
氧化剂:
还原剂:
必含有化合价能降低的元素
必含有化合价能升高的元素
还原剂—价升高—失电子—
被氧化—氧化反应
-4
–3
–2
–1
0
+1
+2
+3
+4
+5
+6
+7
氧化剂—价降低—得电子—被还原—还原反应
3、氧化产物:
4、还原产物:
还原剂对应的产物
氧化剂对应的产物
还原剂
氧化产物
+
+
氧化剂
还原产物
价降低、得电子
被还原、还原反应
价升高、失电子、
被氧化、氧化反应
小结:
5、常见的氧化剂:
O2
Cl2
活泼非金属单质HClO
NaClO
Na2O2
H2O2
KMnO4浓
H2SO4
HNO3
H+
Cu2+
Fe3+
Ag+
6、常见的还原剂:
金属单质
C
H2
S
CO
SO2
S2-
Fe2+
I-
6、氧化性还原性强弱的比较
⑴利用氧化还原反应方程式
氧化剂+还原剂=氧化产物+还原产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
例:
有A
B
C
D四种物质,已知它们能发生下列变化
(1)A2++B=B2++A
(2)A2++C=C2++A
(3)B2++C=C2++B
(4)C2++D=D2++C
由此可知,各物质的氧化性﹑还原性强弱顺序
氧化性:
还原性:
A2+>B2+>C2+>D2+
D>C>B>A
⑵看同一元素的化合价
当元素处于最高价态时
当元素处于最低价态时
当元素处于中间价态时
只有氧化性
只有还原性
即有氧化性又有还原性
例:
Cl2+NaOH=NaCl+NaClO+H2O
⑶看氧化还原反应的程度
例
Fe+Cl2
Fe+HCl
2Fe+3Cl2=2FeCl3
Fe+2HCl=FeCl2+H2
点燃
+3
+2
氧化性:Cl2>H+
⑷利用金属活动性顺序表
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
失电子能力减弱,还原性减弱
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Fe
Ag
+
2+
+
2+
3+
2+
2+
2+
2+
+
2+
3+
+
得电子能力增强,氧化性增强
练习:从下列物质中选择填空(填代码)
①S
②Na
③F2
④SO2
⑤Fe2+
⑥KMnO4
⑦Cl-
⑧H2O2
⑴只能作氧化剂的是
;
⑵只能作还原剂的是
;
⑶既能作氧化剂,又能作还原剂的
是
。
③
② ⑦
①④⑤⑥⑧
思考1
观察以下氧化还原反应,找出
变价元素,分析化合价变化特点。
②Cl2+H2O=HCl
+
HClO
⑴
二、氧化还原反应的基本类型
1、一般的氧化还原反应
一种元素的化合价升高,而另一种
元素的化合价降低。
①2H2O2=2H2O
+
O2↑
MnO2+4HCl
MnCl2+Cl2↑+2H2O
+4
+2
-1
0
△
2、歧化反应:
——在氧化还原反应中,发生化合
价变化的元素是反应物中同一物质
中同一价态的同一元素——一部分
化合价升高,另一部分化合价降低。
练
习
将下列反应中属于歧化反应的
标出变价元素的化合价
⑴
3S+6KOH=2K2S+K2SO3+3H2O
⑵
H2+CuO=Cu+H2O
⑶
3NO2+H2O=2HNO3+NO↑
3、归中反应:
——在氧化还原反应中,元素化合
价变化发生在反应物中不同价态的
同一元素之间,反应后都转化为同
一价态的生成物。
练
习
找出下列反应中的归中反应并标
出变价元素的化合价
A.
NaH+H2O==NaOH+H2↑
B.
2HNO3+NO=3NO2+H2O
C.
KClO3+6HCl=KCl+3Cl2↑+3H2O
D.
Fe+2FeCl3=3FeCl2
。
思考2
⑴发生归中(或歧化)反应的
元素必须具备的条件(化合价)是
什么?
——该元素至少具有
“三种化合价”
三、氧化还原反应的一般规律
2.强弱律:自发发生的氧化还原反应总是
由“强”成“弱”的。(判定强弱)
1.电子得失(或化合价升降)总数相等
3.价态律:元素处于最高(低)价,只有
氧化(还原)性,中间价则两性都有。
4.归中律:邻价态间的转化最易。只靠拢
不交叉规律——归中反应
5.先后律:谁强谁先反应。
用于氧化还原
反应的计算
1.标出电子转移的方向和数目,并指
出氧化剂及还原剂。
⑵.
2KClO3
2KCl
+
3O2↑
MnO2
△
⑴.2Al
+
3H2SO4
Al2
(SO4)3
+3
H2↑
⑶.
Fe
+
CuSO4
=
FeSO4
+
Cu
⑷.
2H2
+
O2
2H2O
点燃
【巩固练习】
2、有以下几个反应:
①
2KMnO4+16HCl=2KCl+2MnCl2
+5Cl2+8H2O
②
2FeCl3+2KI=2KCl+2FeCl2+I2
③
Cl2
+2NaBr
=2NaCl
+
Br2
,
④
3Br2+6FeCl2=2FeBr3+4FeCl3
⑤
I2+SO2+2H2O=2HI+H2SO4;
⑴则物质的氧化性强弱顺序为:
。
⑵据②③可知Cl-、Br-、Fe2+的还原性
强弱顺序为
。
KMnO4>Cl2>Br2>FeCl3>I2>SO2
Fe2+>Br->Cl-
⑶向FeBr2溶液中通入少量Cl2,请写出发生反应的化学方程式,并改写为离子反应方程式。
①化学方程式为
;
②离子方程式为
。
6FeBr2+3Cl2=4FeBr3+2FeCl3
2Fe2++Cl2=2Fe3++2Cl-
③课下思考:若通入过量Cl2呢?
【小结】
1、了解氧化还原反应的类型;初步
理解歧化和归中两种氧化还原反
应类型及其反应中的价态规律。
2、掌握氧化还原反应中电子转移的
方向和数目的表示方法,主要掌
握其中的单线桥表示法。
【布置作业】
氧化还原反应
第一课时
无处不在的氧化还原反应
氧化还原反应在工农业生产、科学技术和日常生活中有着广泛的应用,现作一些简单介绍。
食物的腐烂、铁的生锈、通常使用的干电池、蓄电池都发生着氧化还原反应,煤炭、石油、天然气等燃料的燃烧。
植物的光合作用、人和动物呼吸的作用及食物的消化过程都包含着复杂的氧化还原反应。
我们所需要的各种各样的金属,都是通过氧化还原反应提炼而得到的。如钠、铝、炼铁、炼钢等等。许多重要化工产品的制造,如合成氨、接触法制硫酸、氨氧化法制硝酸、食盐水电解制烧碱等,主要反应也都是氧化还原反应。
由此可见,在许多领域里都涉及到氧化还原反应,学习和掌握氧化还原反应对我们的生活和今后参加工作都是很有意义的。
无处不在的氧化还原反应
【学习目标】
(1)通过分析化学反应中元素化合价的变化,建立氧化还原反应的概念;
(2)通过实验事实和思考,初步理解氧化还原反应的本质;
(3)了解氧化—还原反应在工农业生产、日常生活中的应用。
【学习重点】
(1)认识并建立氧化还原反应的概念。
(2)理解氧化还原反应的本质是电子转移。
⑥CaO
+
H2O
==
Ca(OH)
2
①Fe+CuSO4
==
Cu+FeSO4
【知识回顾】
在初中我们学过哪几种反应类型?判断下列反应属于那种反应类型?
⑦CaCO3==CaO+CO2
↑
高温
⑧2KClO3==2KCl+3O2
↑
△
③NaOH+HCl==NaCl+H2O
化合反应
分解反应
②Zn
+
H2SO4
=
ZnSO4
+
H2↑
④NaCl+AgNO3=NaNO3
+
AgCl
↓
置换反应
复分解反应
标出下述反应中元素的化合价?并判断哪些反应存在元素化合价的变化?
√√
√
√
⑤2Na+Cl2
===
2NaCl
点燃
一、氧化还原反应
1.概念:
在化学反应过程中有元素化合价变化的化学反应叫氧化还原反应
元素化合价没发生变化的化学反应叫非氧化还原反应
⑤2Na+Cl2
===
2NaCl
点燃
⑥CaO
+
H2O
==
Ca(OH)
2
①Fe+CuSO4
==
Cu+FeSO4
【交流研讨】
判断下列反应那些属于氧化还原反应?
⑦CaCO3===CaO+CO2
↑
高温
⑧2KClO3===2KCl+3O2
↑
△
③NaOH+HCl==NaCl+H2O
化合反应
分解反应
是
是
否
否
是
否
否
是
②Zn
+
H2SO4
=
ZnSO4
+
H2↑
④NaCl+AgNO3=NaNO3
+
AgCl
↓
置换反应
复分解反应
氧化还原反应
非氧还反应
置换反应
复分解反应
化合反应
分解反应
2.氧化还原反应与四种基本反应类型的关系
讨论
讨论
3.氧化反应和还原反应
氧化反应:反应物所含某种或某些元素化合价升高的反应
还原反应:反应物所含某种或某些元素化合价降低的反应
4.氧化反应和还原反应的关系?
【阅读思考】P49页
氧化和还原是两个对立的过程相互依存而统一于一个氧化还原反应中。
5.氧化还原反应的实质
探究
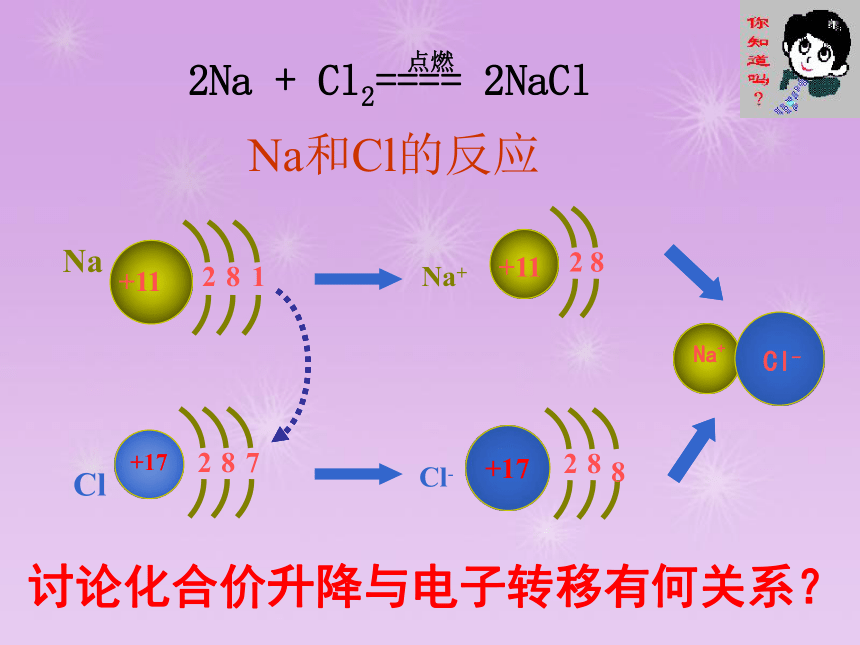
钠在氯气中剧烈燃烧生成氯化钠,这个反应是氧化还原反应吗?为什么?
2Na
+
Cl2====
2NaCl
点燃
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
Na和Cl的反应
+11
8
2
+17
8
8
2
Na+
Cl-
2Na
+
Cl2====
2NaCl
点燃
讨论化合价升降与电子转移有何关系?
5.氧化还原反应的实质
氧化还原反应的实质:电子的转移
【实验探究】
Zn+CuSO4
=
Cu+ZnSO4
按照课本50页图2-3-5连接装置进行实验,观察电流计的指针是否发生偏转。
思考:这一现象,对你认识金属锌与CuSO4溶液反应的实质有什么启发?
现象:电流计指针发生了偏转
结论:线路内有电流产生,发生了电子的定向移动
6、电子转移的表示方法
⑴.双线桥法
起点——反应物中的
变价元素
终点——变价后的该元素
(生成物一侧)
例:
MnO2+4HCl
MnCl2+Cl2↑+2H2O
+4
+2
-1
0
(箭尾)
(箭头)
△
步骤:
⑴.标出变价元素的化合价
⑵.用双箭号表示,箭头从反应物指向
生成物的同一种元素。
⑶.标出失去或得到的电子总数
MnO2+4HCl
MnCl2+Cl2↑+2H2O
△
得到2e-
(或化合价降低2)
失去2e-
(或化合价升高2)
+4
+2
-1
0
MnO2+4HCl
MnCl2+Cl2↑+2H2O
△
+4
+2
-1
0
⑵.单线桥法
起点——还原剂中的
变价元素
终点——氧化剂中的
变价元素
(箭尾)
(箭头)
例:
MnO2+4HCl
MnCl2+Cl2↑+2H2O
+4
-1
△
氧化剂
还原剂
步骤:
1.标出变价元素的化合价
+2
0
2.用单箭号表示,箭头从还原剂指
向氧化剂的变价元素。
注意:1.在表示氧化还原反应中电子
转移的方向和数目时通常用
——双线桥法
(但不写“得”、“失”)
2e-
⑶.标出转移电子的总数
MnO2+4HCl
MnCl2+Cl2↑+2H2O
+4
-1
△
氧化剂
还原剂
+2
0
2.熟练后可省略其“中间环节”
2e-
CuSO4溶液
小灯泡发光
实现了化学能向电能的转变
7.氧化还原反应的应用
【课堂小结】
⑴化合价升降是氧化还原反应的标志;
⑵氧化还原反应的实质是电子转移
;
⑶化合价升高
→失去e-
→
发生氧化反应
化合价降低
→得到e-
→
发生
还原反应
补充练习:
下列化学反应中,那些属于氧还反应?在氧还反应中哪种元素发生了氧化反应,哪种元素发生了还原反应?
1.
2Cu+O2
=
2CuO
△
2.CaO+H2O=Ca(OH)2
3.CaCO3
=
CaO+CO2↑
高温
4.2KMnO4
=
K2MnO4+MnO2+O2↑
△
5.NaCl+AgNO3=NaNO3
+
AgCl
↓
6.CuO
+
H2
=
Cu
+
H2O
△
化学1(必修)第2章第三节氧化剂和还原剂
第二课时
复习:化学反应的类型
化学反应
1.据反应物和生成物的类别及反应前后物质种类的多少
2.反应中是否得氧或失氧
氧化反应
还原反应
复分解反应
化合反应
分解反应
置换反应
A+B==AB
AB==A+B
AB+C==A+CB
AB+CD==AD+CB
交流·研讨
1﹑Cu+Cl2=CuCl2
2﹑Zn+2H+=Zn++H2
3﹑CaCO3+2H+=Ca2++CO2+H2O
4﹑BaCl2+H2SO4=BaSO4+2HCl
5﹑Fe2O3+3CO=2Fe+3CO2
高温
【问】
1、哪些是氧化还原反应?
2、氧化还原反应实质?
3、用双线桥表示电子转移的数目和方向?
拓展
哪些元素化合价升高,对应的物质?
哪些元素化合价降低,对应的物质?
化合价升高的元素
物质
化合价降低的元素
物质
Cu
Zn
C
Cu
Zn
CO
Cl
H
Fe
Cl2
H+
Fe2O3
还原剂
氧化剂
一﹑氧化剂还原剂
1、氧化剂:
所含元素化合价降低的反应物
2、还原剂:
所含元素化合价升高的反应物
特征
氧化剂:
还原剂:
必含有化合价能降低的元素
必含有化合价能升高的元素
还原剂—价升高—失电子—
被氧化—氧化反应
-4
–3
–2
–1
0
+1
+2
+3
+4
+5
+6
+7
氧化剂—价降低—得电子—被还原—还原反应
3、氧化产物:
4、还原产物:
还原剂对应的产物
氧化剂对应的产物
还原剂
氧化产物
+
+
氧化剂
还原产物
价降低、得电子
被还原、还原反应
价升高、失电子、
被氧化、氧化反应
小结:
5、常见的氧化剂:
O2
Cl2
活泼非金属单质HClO
NaClO
Na2O2
H2O2
KMnO4浓
H2SO4
HNO3
H+
Cu2+
Fe3+
Ag+
6、常见的还原剂:
金属单质
C
H2
S
CO
SO2
S2-
Fe2+
I-
6、氧化性还原性强弱的比较
⑴利用氧化还原反应方程式
氧化剂+还原剂=氧化产物+还原产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
例:
有A
B
C
D四种物质,已知它们能发生下列变化
(1)A2++B=B2++A
(2)A2++C=C2++A
(3)B2++C=C2++B
(4)C2++D=D2++C
由此可知,各物质的氧化性﹑还原性强弱顺序
氧化性:
还原性:
A2+>B2+>C2+>D2+
D>C>B>A
⑵看同一元素的化合价
当元素处于最高价态时
当元素处于最低价态时
当元素处于中间价态时
只有氧化性
只有还原性
即有氧化性又有还原性
例:
Cl2+NaOH=NaCl+NaClO+H2O
⑶看氧化还原反应的程度
例
Fe+Cl2
Fe+HCl
2Fe+3Cl2=2FeCl3
Fe+2HCl=FeCl2+H2
点燃
+3
+2
氧化性:Cl2>H+
⑷利用金属活动性顺序表
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
失电子能力减弱,还原性减弱
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Fe
Ag
+
2+
+
2+
3+
2+
2+
2+
2+
+
2+
3+
+
得电子能力增强,氧化性增强
练习:从下列物质中选择填空(填代码)
①S
②Na
③F2
④SO2
⑤Fe2+
⑥KMnO4
⑦Cl-
⑧H2O2
⑴只能作氧化剂的是
;
⑵只能作还原剂的是
;
⑶既能作氧化剂,又能作还原剂的
是
。
③
② ⑦
①④⑤⑥⑧
思考1
观察以下氧化还原反应,找出
变价元素,分析化合价变化特点。
②Cl2+H2O=HCl
+
HClO
⑴
二、氧化还原反应的基本类型
1、一般的氧化还原反应
一种元素的化合价升高,而另一种
元素的化合价降低。
①2H2O2=2H2O
+
O2↑
MnO2+4HCl
MnCl2+Cl2↑+2H2O
+4
+2
-1
0
△
2、歧化反应:
——在氧化还原反应中,发生化合
价变化的元素是反应物中同一物质
中同一价态的同一元素——一部分
化合价升高,另一部分化合价降低。
练
习
将下列反应中属于歧化反应的
标出变价元素的化合价
⑴
3S+6KOH=2K2S+K2SO3+3H2O
⑵
H2+CuO=Cu+H2O
⑶
3NO2+H2O=2HNO3+NO↑
3、归中反应:
——在氧化还原反应中,元素化合
价变化发生在反应物中不同价态的
同一元素之间,反应后都转化为同
一价态的生成物。
练
习
找出下列反应中的归中反应并标
出变价元素的化合价
A.
NaH+H2O==NaOH+H2↑
B.
2HNO3+NO=3NO2+H2O
C.
KClO3+6HCl=KCl+3Cl2↑+3H2O
D.
Fe+2FeCl3=3FeCl2
。
思考2
⑴发生归中(或歧化)反应的
元素必须具备的条件(化合价)是
什么?
——该元素至少具有
“三种化合价”
三、氧化还原反应的一般规律
2.强弱律:自发发生的氧化还原反应总是
由“强”成“弱”的。(判定强弱)
1.电子得失(或化合价升降)总数相等
3.价态律:元素处于最高(低)价,只有
氧化(还原)性,中间价则两性都有。
4.归中律:邻价态间的转化最易。只靠拢
不交叉规律——归中反应
5.先后律:谁强谁先反应。
用于氧化还原
反应的计算
1.标出电子转移的方向和数目,并指
出氧化剂及还原剂。
⑵.
2KClO3
2KCl
+
3O2↑
MnO2
△
⑴.2Al
+
3H2SO4
Al2
(SO4)3
+3
H2↑
⑶.
Fe
+
CuSO4
=
FeSO4
+
Cu
⑷.
2H2
+
O2
2H2O
点燃
【巩固练习】
2、有以下几个反应:
①
2KMnO4+16HCl=2KCl+2MnCl2
+5Cl2+8H2O
②
2FeCl3+2KI=2KCl+2FeCl2+I2
③
Cl2
+2NaBr
=2NaCl
+
Br2
,
④
3Br2+6FeCl2=2FeBr3+4FeCl3
⑤
I2+SO2+2H2O=2HI+H2SO4;
⑴则物质的氧化性强弱顺序为:
。
⑵据②③可知Cl-、Br-、Fe2+的还原性
强弱顺序为
。
KMnO4>Cl2>Br2>FeCl3>I2>SO2
Fe2+>Br->Cl-
⑶向FeBr2溶液中通入少量Cl2,请写出发生反应的化学方程式,并改写为离子反应方程式。
①化学方程式为
;
②离子方程式为
。
6FeBr2+3Cl2=4FeBr3+2FeCl3
2Fe2++Cl2=2Fe3++2Cl-
③课下思考:若通入过量Cl2呢?
【小结】
1、了解氧化还原反应的类型;初步
理解歧化和归中两种氧化还原反
应类型及其反应中的价态规律。
2、掌握氧化还原反应中电子转移的
方向和数目的表示方法,主要掌
握其中的单线桥表示法。
【布置作业】
