江西省上饶市横峰中学2020-2021学年高二下学期入学考试化学试题(统招班) PDF版含答案
文档属性
| 名称 | 江西省上饶市横峰中学2020-2021学年高二下学期入学考试化学试题(统招班) PDF版含答案 |  | |
| 格式 | |||
| 文件大小 | 940.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-26 20:30:06 | ||
图片预览

文档简介
?1
③
CO(g)
2H
(g)
CH
OH(g)?
?
?
?ΔH
90.8kJ
mol
.
横峰中学
2020—
2021
学年度第二学期复学考试
2
3
2
下列说法正确的是(
)
化学试卷(统招班)
A.①中反应的热化学方程式为
命题人:
审题人:
考试时间:
90分钟
分值:
100分
?1
CO
(g)
3H
(g)
CH
OH(g)
H
O(l)
2
2
3
2?
?
?
?
?ΔH
49.6kJ
mol
可能用到的相对原子质量:
H-1
Li-7
C-12
O-16
Cl-35.5
Cu-64
Zn-65
B.在恒温恒容的密闭容器中发生反应②,气体压强不变时表明反应达到平衡
Br-80
Ag-108
?1
C.
ΔH
41.2kJ
mol
1
?
?
?
1.“落红不是无情物,化作春泥更护花”表述了花对大地的深情,下列说法错误的是(
)
D.反应③在高温下能自发进行
A.漂白液能使鲜艳的花朵褪色
B.腐烂的花朵能增强土壤的肥力
7.
常温下,
0.1mol/L的三种盐溶液
NaX、
NaY、
NaZ的
pH分别为
7、
8、
9,则下列说法正确的是
C.鲜花产生的果糖能水解为葡萄糖
D.用酒精可提取鲜花中含有的芳香类物质
-
-
-
A.
HX是弱酸
B.
离子浓度
:c(Z)>c(Y)>c(X)
2.
下列电池能实现化学能与电能相互转化的是
(
)
-
-
-
C.
电离常数
:K(HZ)>K(HY)
D.
c(X)=c(Y)+c(HY)=c(Z)+c(HZ)
8
.利用
CO2
和
H2
在
催
化
剂
的
作
用
下
合
成
甲
醇
,
发
生
的
反
应
为
A.
碱性锌锰电池
B.
铅酸蓄电池
CO
(g)
3H
(g)
CH
OH(g)
H
O(g)
H
0
2
2
3
2?
?
?
?
.下列说法正确的是(
)
A.
增大压强提高了甲醇的产率,但对化学平衡常数无影响
B.工业上可采用升高温度来提高
H2的转化率
C.
太阳能电池
D.
锌银纽扣电池
C.催化剂能加快反应速率,使平衡向正反应方向移动
3.
牙齿的表面有一薄层釉质保护着,釉质层的主要成分是难溶的羟基磷灰石
[Ca5(PO4)3OH]。下列
D.
达到平衡后,增加
CO2的浓度,
?H减小
行为不利于牙齿保护的是
(
)
9
.向
2L
的恒容密闭容器中充入
0.2mol
E(g)和
0.2mol
F(g)
,发生反应:
A.
坚持饭后漱口
B.
在牙膏中添加氟化物
E(g)
F(g)
G(g)
H(g)
H?
?
?,该反应的平衡常数(
K)和温度(
T)的关系如表所示.
600℃
C.
大量饮用可乐等碳酸饮料
D.
早晚按时刷牙
??11
4.
已知
2A(g)?3B(g)+C(g)
ΔH>
0,假设
ΔH和
ΔS不随温度而改变,下列说法中正确的是
(
)
时,反应经
2s达到平衡状态,此时间段内平均反应速率
v(E)
0.04mol
L
s?
?
?
.下列说法错误
A.
低温下能自发进行
B.
高温下能自发进行
的是(
)
C.
任何温度下都能自发进行
D.
任何温度下都不能自发进行
温度
/℃
200
400
600
5.
下列各物质的名称正确的是
平衡常数
0.1
1
x
A.
3,
3-二甲基丁烷
B.
2,
3,
3-三甲基丁烷
A.
??H0
C.
2,
2-二甲基-
3-乙基丁烷
D.
2,
3-二甲基-
4-乙基己烷
B.
x
16?
?1
6.
甲醇是可再生的清洁能源,可利用
CO2与
H2合成甲醇,已知:①一定量
CO
(g)2
和
H
(g)2
反
C.
600℃下,平衡时
c(H)为
0.08mol
L?
应生成
CH
OH(g)3
和
H
O(g)
D.
400℃下,该反应达到平衡状态时,
F的转化率为
50%
2
,当消耗
1mol
CO
(g)2
时,放出的能量是
49.6kJ;
10.
具有解热镇痛及抗生素作用的药物
“芬必得
”主要成分的结构简式如图,它属于
(
)
②
CO
(g)
H
(g)
CO(g)
H
O(g)
2
2
2
1??
ΔH
;
①
芳香族化合物
②
脂肪族化合物
③
有机羧酸
④
有机高分子化合物
⑤
芳香烃
A.③⑤
B.②③
C.①③
D.①④
11.
一种利用
LiCl、
Li2CO3制备金属锂的装置如图所示。下列说法正确的是
(
)
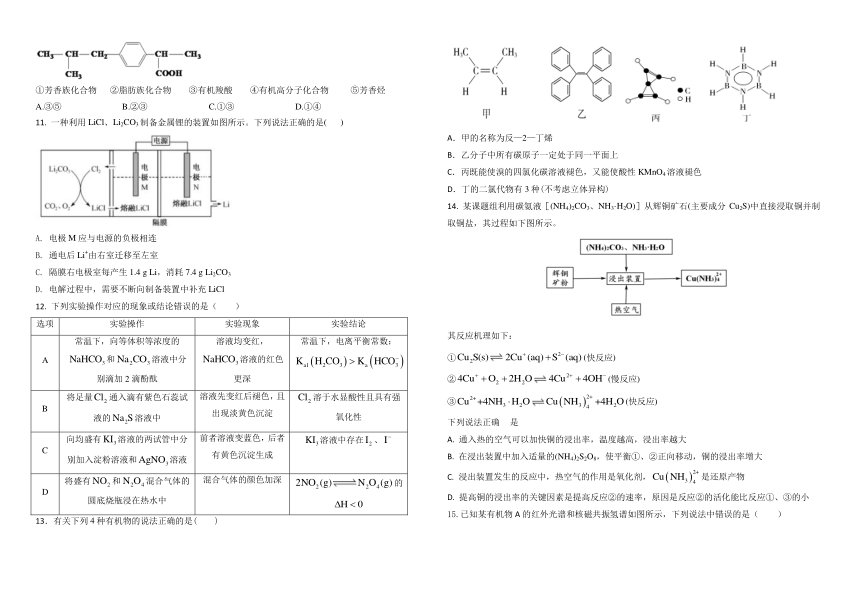
A.
甲的名称为反
—
2—
丁烯
B.
乙分子中所有碳原子一定处于同一平面上
C.
丙既能使溴的四氯化碳溶液褪色,又能使酸性
KMnO4溶液褪色
D.
丁的二氯代物有
3种
(不考虑立体异构
)
14.
某课题组利用碳氨液[
(NH4)2CO3、
NH3·H2O)]从辉铜矿石
(主要成分
Cu2S)中直接浸取铜并制
取铜盐,其过程如下图所示。
A.
电极
M应与电源的负极相连
+
B.
通电后
Li
由右室迁移至左室
C.
隔膜右电极室每产生
1.4
g
Li,消耗
7.4
g
Li2CO3
D.
电解过程中,需要不断向制备装置中补充
LiCl
12.
下列实验操作对应的现象或结论错误的是(
)
选项
实验操作
实验现象
实验结论
其反应机理如下:
常温下,向等体积等浓度的
溶液均变红,
常温下,电离平衡常数:
和
溶液中分
溶液的红色
①
(快反应
)
别滴加
滴酚酞
更深
②
(慢反应
)
将足量
通入滴有紫色石蕊试
溶液先变红后褪色,且
溶于水显酸性且具有强
③
(快反应
)
出现淡黄色沉淀
液的
溶液中
氧化性
下列说法正确
是
向均盛有
溶液的两试管中分
前者溶液变蓝色,后者
溶液中存在
、
A.
通入热的空气可以加快铜的浸出率,温度越高,浸出率越大
有黄色沉淀生成
别加入淀粉溶液和
溶液
B.
在浸出装置中加入适量的
(NH4)2S2O8,使平衡
①
、
②
正向移动,铜的浸出率增大
将盛有
和
混合气体的
混合气体的颜色加深
C.
浸出装置发生的反应中,热空气的作用是氧化剂,
是还原产物
的
圆底烧瓶浸在热水中
D.
提高铜的浸出率的关键因素是提高反应
②
的速率,原因是反应
②
的活化能比反应
①
、
③
的小
15.已知某有机物
A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是(
)
13.
有关下列
4种有机物的说法正确的是
(
)
②
若烃
A
不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则此
烃
A
的结构简式为
______________________________________。
③
若烃
A
能使溴水褪色,在催化剂作用下与
H2
加成,其加成产物分子中含有
4
个甲基,烃
A
可
能的结构简式为
__________________,
__________________,
__________________。
18.(
12分)
已知部分弱酸的电离平衡常数如下表,根据表中数据回答下列问题。
弱酸
HCOOH
HCN
H2CO3
电离平衡常
(25℃
)
Ka=
Ka=
Ka1=
Ka2=
(1)
已知某浓度的
NaCN水溶液
pH=8,原因是
___________(用离子方程式表示
),
pH=8的
NaCN溶
-
液
中,由水电离出的
OH浓度为
___________。
A.由红外光谱可知,该有机物中至少有三种不同的化学键
(2)同浓度
HCOONa、
NaCN、
NaHCO3、
Na2CO3这
4种溶液中碱性由强到弱的顺序是
___________;
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
NaHCO3溶液中各离子浓度由大到小的顺序是
___________。
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
+
(3)体积相同、
c(H
)相同的三种酸溶液
a.HCOOH;
b.HCN;
c.HCl分别与同浓度的
NaOH溶液完全
D.若
A的化学式为
C2H6O,则其结构简式为
CH3—O—CH3
2+
2-
中和,消耗
NaOH溶液的体积由大到小的排列顺序是
(填字母
)___________。
16.
某温度下,难溶物
FeR的水溶液中存在平衡
FeR(s)?Fe
(aq)+R
(aq),其沉淀溶解平衡曲线如
(
4)
电解法转化
CO2可实现
CO2资源化利用。电解
CO2制甲酸
(HCOOH)的原理示意图如下:
(已
图所示。下列说法正确的是
(
)
知
HCOOH
中
C
的化合价为
+2
价
)
A.
可以仅通过升温实现由
d点变到
a点
B.
c点没有沉淀生成
-18
请回答:
C.
a点对应的
Ksp等于
b点对应的
Ksp
D.
该温度下,
Ksp=4.0×10
①
a
端连电源的
___________极。
(以上每空
1分)
-
17.
(
11分)
按要求回答下列问题:
②
甲池中放出的气体是
___________;
电解过程中,产生
HCOO
电极反应式为:
___________;
电路中转移
0.1mol电子,理论上需消耗
CO2___________L(标准状况
)。
(
1)
系统命名的名称为:
。
19(.
17分)
“绿水青山就是金山银山
”。运用化学反应原理研究氮的化合物的反应对缓解能源危机、
(
2)写出
2-丁烯在一定条件下加聚产物的结构简式
__________________________________。
治理环境污染具有重要意义。
(
3)某烃
A
0.2mol
在氧气中完全燃烧后,生成化合物
B、
C
各
1.2mol,试回答:
(1)肼是一种高能燃料。已知各共价键键能如表:
①
烃
A
的分子式为
______________________________________。
N≡N
O=O
N-
N
N-
H
O-
H
化趋势如图所示。
a点后
NO2去除率降低的原因是
___________。
(4)检测烟道气中
NOx含量的步骤如下:
-
1
键能
(kJ·mol
)
946
497
193
391
463
I.将
V
L
气样通入适量酸化的
H2O2
溶液中,使
NOx完全被氧化为
NO
-
1
N2H4(g)+O2(g)?N2(g)+2H2O(l)?H=___________kJ·mol
。
-
1
II.加水稀释至
100.
00
mL,量取
20.
00
mL
该溶液,与
V1
mL
c1
mol·L
FeSO4
标准溶液
(过量
)
(2)
、
在
一
定
条
件
下
可
转
化
为
无
害
气
体
,
其
反
应
为
充分混合;
.
-
1
2+
III.用
c2mol·L
KMnO4
标准溶液滴定剩余的
Fe
,终点时消耗
V2
mL。
某研究小组将
和
充入体积为
的恒容密闭容器中,在不同温度下
随
①
滴定过程中主要使用的玻璃仪器有
___________和锥形瓶等。
反应时间的变化如图所示:
②
判断滴定达到终点的依据是
___________。
2+
+
3+
③
滴定过程中发生下列反应:
3Fe
+NO
+4H
=NO↑+3Fe
+2H2O,
2+
+
2+
3+
MnO
+5Fe
+8H
=Mn
+5Fe
+4H2O
判断下列情况对
NOx含量测定结果的影响
(填
“偏高
”、
“偏低
”或
“无影响
”)
A.锥形瓶用蒸馏水洗净后没有干燥
___________。
B.读取
KMnO4
标准溶液体积时,开始仰视读数,滴定结束时俯视读数
___________。
20.
(
12分)
钨冶炼渣主要含锰、铁、钙、镁、硅的氧化物及少量重金属盐。工业上利用钨冶炼渣
制备电池级硫酸锰
(含
MnSO4的质量分数
98%以上
)的工艺如图所示。
已知:
,
(
、
为速率常数,只与
温度有关).
①该反应的
________0(填“
>”“
<”或“
=”).
②
时,
内用
表示的平均反应速率
_________.
回答下列问题:
③下列措施能使生成
的反应速率增大的是
_________(填序号).
(1)为提高钨冶炼渣的浸出速率,可采用的方法有
___________(写出
2种
)。
“滤渣
1”的主要成分是
A.使用催化剂
B.充入稀有气体
C.降低反应温度
D.将
及时分离出来
___________。
④
时,
__________.
(2)写出
“氧化
”步骤的离子方程式
___________。
(3)“调
pH除铁
”步骤中的最优试剂是
___________。
(3)CaSO3与
Na2SO4
混合浆液可用于脱除
NO2,反应过程为:
A.
H2SO4
B.
CO2
C.
NaOH
D.
MnCO3
I.
CaSO3(s)+SO
(aq)?CaSO4(s)+SO
(aq)
2+
2+
-
(4)为使
Ca
和
Mg
完全沉淀,除去钙镁后的溶液中
c(F)应不低于
___________mol/L。
[已知:
+
-10
-11
II.
SO
(aq)+2NO2(g)+H2O(l)?SO
(aq)+2NO
(aq)+2H
(aq)
Ksp(CaF2)=1.6×10
,
Ksp(MgF2)=9×10
]。
浆液中
CaSO3质量一定时,
Na2SO4的质量与
NO2的去除率变
(5)“沉锰
”步骤的化学方程式为
___________。
④
33.75
横峰中学
2020—
2021
学年度第二学期复学考试
(3).
SO
浓度过高时,以反应
Ⅱ
平衡向逆反应方向移动为主,降低
NO2去除率
化学试卷(统招班)
参考答案
(4).
①
酸式滴定管
1—
5:
C
B
C
B
D
6—
10:
C
D
A
A
C
②
加入最后半滴
KMnO4
标准溶液,溶液恰好变为浅粉红色,且半分钟不变色,则达到滴定终点
11—
15
:
C
A
C
B
D
16.
C
③
无影响
偏高
17.
(
11分)
20.
(
12分,每空
2分)
(
1)
3,6-二甲基
-3-庚烯
2分
(1).
将钨冶炼渣粉碎、适当升高温度、适当提高硫酸浓度、搅拌
(写出任意两种即可
)
SiO2、
CaSO4
(
2)
2分
2+
+
3+
(2).
2Fe
+H2O2+2H
=2Fe
+2H2O
(
3)
①
C6H12
2分
(3).
D
-3
②
2分
(4).
4.0×10
(5).MnSO4+Na2CO3=MnCO3↓+Na2SO4
③
各
1分
18.(
12分)
-
-
-6
(+H2O
HCN+OH
1×10
mol/L
(各
1分)
(2).
Na2CO3、
NaCN、
NaHCO3、
HCOONa
(或
Na2CO3>NaCN>NaHCO3>HCOONa)
+
-
+
c(Na
)>
c(
)>
c(OH)>
c(H
)>
c(
)
(各
1分)
(3).
b>
a>
c
1分
(4).
①
正
1分
②
O2和
CO2
2.24
(每空
2分)
19.(
17分,除备注外每空
2分)
(1).
-
544
(2).
①
<(
1分)
②
(
1分)
③
A(
1分)
③
CO(g)
2H
(g)
CH
OH(g)?
?
?
?ΔH
90.8kJ
mol
.
横峰中学
2020—
2021
学年度第二学期复学考试
2
3
2
下列说法正确的是(
)
化学试卷(统招班)
A.①中反应的热化学方程式为
命题人:
审题人:
考试时间:
90分钟
分值:
100分
?1
CO
(g)
3H
(g)
CH
OH(g)
H
O(l)
2
2
3
2?
?
?
?
?ΔH
49.6kJ
mol
可能用到的相对原子质量:
H-1
Li-7
C-12
O-16
Cl-35.5
Cu-64
Zn-65
B.在恒温恒容的密闭容器中发生反应②,气体压强不变时表明反应达到平衡
Br-80
Ag-108
?1
C.
ΔH
41.2kJ
mol
1
?
?
?
1.“落红不是无情物,化作春泥更护花”表述了花对大地的深情,下列说法错误的是(
)
D.反应③在高温下能自发进行
A.漂白液能使鲜艳的花朵褪色
B.腐烂的花朵能增强土壤的肥力
7.
常温下,
0.1mol/L的三种盐溶液
NaX、
NaY、
NaZ的
pH分别为
7、
8、
9,则下列说法正确的是
C.鲜花产生的果糖能水解为葡萄糖
D.用酒精可提取鲜花中含有的芳香类物质
-
-
-
A.
HX是弱酸
B.
离子浓度
:c(Z)>c(Y)>c(X)
2.
下列电池能实现化学能与电能相互转化的是
(
)
-
-
-
C.
电离常数
:K(HZ)>K(HY)
D.
c(X)=c(Y)+c(HY)=c(Z)+c(HZ)
8
.利用
CO2
和
H2
在
催
化
剂
的
作
用
下
合
成
甲
醇
,
发
生
的
反
应
为
A.
碱性锌锰电池
B.
铅酸蓄电池
CO
(g)
3H
(g)
CH
OH(g)
H
O(g)
H
0
2
2
3
2?
?
?
?
.下列说法正确的是(
)
A.
增大压强提高了甲醇的产率,但对化学平衡常数无影响
B.工业上可采用升高温度来提高
H2的转化率
C.
太阳能电池
D.
锌银纽扣电池
C.催化剂能加快反应速率,使平衡向正反应方向移动
3.
牙齿的表面有一薄层釉质保护着,釉质层的主要成分是难溶的羟基磷灰石
[Ca5(PO4)3OH]。下列
D.
达到平衡后,增加
CO2的浓度,
?H减小
行为不利于牙齿保护的是
(
)
9
.向
2L
的恒容密闭容器中充入
0.2mol
E(g)和
0.2mol
F(g)
,发生反应:
A.
坚持饭后漱口
B.
在牙膏中添加氟化物
E(g)
F(g)
G(g)
H(g)
H?
?
?,该反应的平衡常数(
K)和温度(
T)的关系如表所示.
600℃
C.
大量饮用可乐等碳酸饮料
D.
早晚按时刷牙
??11
4.
已知
2A(g)?3B(g)+C(g)
ΔH>
0,假设
ΔH和
ΔS不随温度而改变,下列说法中正确的是
(
)
时,反应经
2s达到平衡状态,此时间段内平均反应速率
v(E)
0.04mol
L
s?
?
?
.下列说法错误
A.
低温下能自发进行
B.
高温下能自发进行
的是(
)
C.
任何温度下都能自发进行
D.
任何温度下都不能自发进行
温度
/℃
200
400
600
5.
下列各物质的名称正确的是
平衡常数
0.1
1
x
A.
3,
3-二甲基丁烷
B.
2,
3,
3-三甲基丁烷
A.
??H0
C.
2,
2-二甲基-
3-乙基丁烷
D.
2,
3-二甲基-
4-乙基己烷
B.
x
16?
?1
6.
甲醇是可再生的清洁能源,可利用
CO2与
H2合成甲醇,已知:①一定量
CO
(g)2
和
H
(g)2
反
C.
600℃下,平衡时
c(H)为
0.08mol
L?
应生成
CH
OH(g)3
和
H
O(g)
D.
400℃下,该反应达到平衡状态时,
F的转化率为
50%
2
,当消耗
1mol
CO
(g)2
时,放出的能量是
49.6kJ;
10.
具有解热镇痛及抗生素作用的药物
“芬必得
”主要成分的结构简式如图,它属于
(
)
②
CO
(g)
H
(g)
CO(g)
H
O(g)
2
2
2
1??
ΔH
;
①
芳香族化合物
②
脂肪族化合物
③
有机羧酸
④
有机高分子化合物
⑤
芳香烃
A.③⑤
B.②③
C.①③
D.①④
11.
一种利用
LiCl、
Li2CO3制备金属锂的装置如图所示。下列说法正确的是
(
)
A.
甲的名称为反
—
2—
丁烯
B.
乙分子中所有碳原子一定处于同一平面上
C.
丙既能使溴的四氯化碳溶液褪色,又能使酸性
KMnO4溶液褪色
D.
丁的二氯代物有
3种
(不考虑立体异构
)
14.
某课题组利用碳氨液[
(NH4)2CO3、
NH3·H2O)]从辉铜矿石
(主要成分
Cu2S)中直接浸取铜并制
取铜盐,其过程如下图所示。
A.
电极
M应与电源的负极相连
+
B.
通电后
Li
由右室迁移至左室
C.
隔膜右电极室每产生
1.4
g
Li,消耗
7.4
g
Li2CO3
D.
电解过程中,需要不断向制备装置中补充
LiCl
12.
下列实验操作对应的现象或结论错误的是(
)
选项
实验操作
实验现象
实验结论
其反应机理如下:
常温下,向等体积等浓度的
溶液均变红,
常温下,电离平衡常数:
和
溶液中分
溶液的红色
①
(快反应
)
别滴加
滴酚酞
更深
②
(慢反应
)
将足量
通入滴有紫色石蕊试
溶液先变红后褪色,且
溶于水显酸性且具有强
③
(快反应
)
出现淡黄色沉淀
液的
溶液中
氧化性
下列说法正确
是
向均盛有
溶液的两试管中分
前者溶液变蓝色,后者
溶液中存在
、
A.
通入热的空气可以加快铜的浸出率,温度越高,浸出率越大
有黄色沉淀生成
别加入淀粉溶液和
溶液
B.
在浸出装置中加入适量的
(NH4)2S2O8,使平衡
①
、
②
正向移动,铜的浸出率增大
将盛有
和
混合气体的
混合气体的颜色加深
C.
浸出装置发生的反应中,热空气的作用是氧化剂,
是还原产物
的
圆底烧瓶浸在热水中
D.
提高铜的浸出率的关键因素是提高反应
②
的速率,原因是反应
②
的活化能比反应
①
、
③
的小
15.已知某有机物
A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是(
)
13.
有关下列
4种有机物的说法正确的是
(
)
②
若烃
A
不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则此
烃
A
的结构简式为
______________________________________。
③
若烃
A
能使溴水褪色,在催化剂作用下与
H2
加成,其加成产物分子中含有
4
个甲基,烃
A
可
能的结构简式为
__________________,
__________________,
__________________。
18.(
12分)
已知部分弱酸的电离平衡常数如下表,根据表中数据回答下列问题。
弱酸
HCOOH
HCN
H2CO3
电离平衡常
(25℃
)
Ka=
Ka=
Ka1=
Ka2=
(1)
已知某浓度的
NaCN水溶液
pH=8,原因是
___________(用离子方程式表示
),
pH=8的
NaCN溶
-
液
中,由水电离出的
OH浓度为
___________。
A.由红外光谱可知,该有机物中至少有三种不同的化学键
(2)同浓度
HCOONa、
NaCN、
NaHCO3、
Na2CO3这
4种溶液中碱性由强到弱的顺序是
___________;
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
NaHCO3溶液中各离子浓度由大到小的顺序是
___________。
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
+
(3)体积相同、
c(H
)相同的三种酸溶液
a.HCOOH;
b.HCN;
c.HCl分别与同浓度的
NaOH溶液完全
D.若
A的化学式为
C2H6O,则其结构简式为
CH3—O—CH3
2+
2-
中和,消耗
NaOH溶液的体积由大到小的排列顺序是
(填字母
)___________。
16.
某温度下,难溶物
FeR的水溶液中存在平衡
FeR(s)?Fe
(aq)+R
(aq),其沉淀溶解平衡曲线如
(
4)
电解法转化
CO2可实现
CO2资源化利用。电解
CO2制甲酸
(HCOOH)的原理示意图如下:
(已
图所示。下列说法正确的是
(
)
知
HCOOH
中
C
的化合价为
+2
价
)
A.
可以仅通过升温实现由
d点变到
a点
B.
c点没有沉淀生成
-18
请回答:
C.
a点对应的
Ksp等于
b点对应的
Ksp
D.
该温度下,
Ksp=4.0×10
①
a
端连电源的
___________极。
(以上每空
1分)
-
17.
(
11分)
按要求回答下列问题:
②
甲池中放出的气体是
___________;
电解过程中,产生
HCOO
电极反应式为:
___________;
电路中转移
0.1mol电子,理论上需消耗
CO2___________L(标准状况
)。
(
1)
系统命名的名称为:
。
19(.
17分)
“绿水青山就是金山银山
”。运用化学反应原理研究氮的化合物的反应对缓解能源危机、
(
2)写出
2-丁烯在一定条件下加聚产物的结构简式
__________________________________。
治理环境污染具有重要意义。
(
3)某烃
A
0.2mol
在氧气中完全燃烧后,生成化合物
B、
C
各
1.2mol,试回答:
(1)肼是一种高能燃料。已知各共价键键能如表:
①
烃
A
的分子式为
______________________________________。
N≡N
O=O
N-
N
N-
H
O-
H
化趋势如图所示。
a点后
NO2去除率降低的原因是
___________。
(4)检测烟道气中
NOx含量的步骤如下:
-
1
键能
(kJ·mol
)
946
497
193
391
463
I.将
V
L
气样通入适量酸化的
H2O2
溶液中,使
NOx完全被氧化为
NO
-
1
N2H4(g)+O2(g)?N2(g)+2H2O(l)?H=___________kJ·mol
。
-
1
II.加水稀释至
100.
00
mL,量取
20.
00
mL
该溶液,与
V1
mL
c1
mol·L
FeSO4
标准溶液
(过量
)
(2)
、
在
一
定
条
件
下
可
转
化
为
无
害
气
体
,
其
反
应
为
充分混合;
.
-
1
2+
III.用
c2mol·L
KMnO4
标准溶液滴定剩余的
Fe
,终点时消耗
V2
mL。
某研究小组将
和
充入体积为
的恒容密闭容器中,在不同温度下
随
①
滴定过程中主要使用的玻璃仪器有
___________和锥形瓶等。
反应时间的变化如图所示:
②
判断滴定达到终点的依据是
___________。
2+
+
3+
③
滴定过程中发生下列反应:
3Fe
+NO
+4H
=NO↑+3Fe
+2H2O,
2+
+
2+
3+
MnO
+5Fe
+8H
=Mn
+5Fe
+4H2O
判断下列情况对
NOx含量测定结果的影响
(填
“偏高
”、
“偏低
”或
“无影响
”)
A.锥形瓶用蒸馏水洗净后没有干燥
___________。
B.读取
KMnO4
标准溶液体积时,开始仰视读数,滴定结束时俯视读数
___________。
20.
(
12分)
钨冶炼渣主要含锰、铁、钙、镁、硅的氧化物及少量重金属盐。工业上利用钨冶炼渣
制备电池级硫酸锰
(含
MnSO4的质量分数
98%以上
)的工艺如图所示。
已知:
,
(
、
为速率常数,只与
温度有关).
①该反应的
________0(填“
>”“
<”或“
=”).
②
时,
内用
表示的平均反应速率
_________.
回答下列问题:
③下列措施能使生成
的反应速率增大的是
_________(填序号).
(1)为提高钨冶炼渣的浸出速率,可采用的方法有
___________(写出
2种
)。
“滤渣
1”的主要成分是
A.使用催化剂
B.充入稀有气体
C.降低反应温度
D.将
及时分离出来
___________。
④
时,
__________.
(2)写出
“氧化
”步骤的离子方程式
___________。
(3)“调
pH除铁
”步骤中的最优试剂是
___________。
(3)CaSO3与
Na2SO4
混合浆液可用于脱除
NO2,反应过程为:
A.
H2SO4
B.
CO2
C.
NaOH
D.
MnCO3
I.
CaSO3(s)+SO
(aq)?CaSO4(s)+SO
(aq)
2+
2+
-
(4)为使
Ca
和
Mg
完全沉淀,除去钙镁后的溶液中
c(F)应不低于
___________mol/L。
[已知:
+
-10
-11
II.
SO
(aq)+2NO2(g)+H2O(l)?SO
(aq)+2NO
(aq)+2H
(aq)
Ksp(CaF2)=1.6×10
,
Ksp(MgF2)=9×10
]。
浆液中
CaSO3质量一定时,
Na2SO4的质量与
NO2的去除率变
(5)“沉锰
”步骤的化学方程式为
___________。
④
33.75
横峰中学
2020—
2021
学年度第二学期复学考试
(3).
SO
浓度过高时,以反应
Ⅱ
平衡向逆反应方向移动为主,降低
NO2去除率
化学试卷(统招班)
参考答案
(4).
①
酸式滴定管
1—
5:
C
B
C
B
D
6—
10:
C
D
A
A
C
②
加入最后半滴
KMnO4
标准溶液,溶液恰好变为浅粉红色,且半分钟不变色,则达到滴定终点
11—
15
:
C
A
C
B
D
16.
C
③
无影响
偏高
17.
(
11分)
20.
(
12分,每空
2分)
(
1)
3,6-二甲基
-3-庚烯
2分
(1).
将钨冶炼渣粉碎、适当升高温度、适当提高硫酸浓度、搅拌
(写出任意两种即可
)
SiO2、
CaSO4
(
2)
2分
2+
+
3+
(2).
2Fe
+H2O2+2H
=2Fe
+2H2O
(
3)
①
C6H12
2分
(3).
D
-3
②
2分
(4).
4.0×10
(5).MnSO4+Na2CO3=MnCO3↓+Na2SO4
③
各
1分
18.(
12分)
-
-
-6
(+H2O
HCN+OH
1×10
mol/L
(各
1分)
(2).
Na2CO3、
NaCN、
NaHCO3、
HCOONa
(或
Na2CO3>NaCN>NaHCO3>HCOONa)
+
-
+
c(Na
)>
c(
)>
c(OH)>
c(H
)>
c(
)
(各
1分)
(3).
b>
a>
c
1分
(4).
①
正
1分
②
O2和
CO2
2.24
(每空
2分)
19.(
17分,除备注外每空
2分)
(1).
-
544
(2).
①
<(
1分)
②
(
1分)
③
A(
1分)
同课章节目录
