新人教版高一化学必修第二册第八章《化学与可持续发展》单元测试卷 含解析
文档属性
| 名称 | 新人教版高一化学必修第二册第八章《化学与可持续发展》单元测试卷 含解析 |  | |
| 格式 | zip | ||
| 文件大小 | 236.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-01 20:21:47 | ||
图片预览




文档简介
第八章《化学与可持续发展》单元测试卷
可能用到的相对原子质量:C
12 O16 Fe
56
一、选择题(每小题只有1个选项符合题意)
1.下列物质既可以作防腐剂,又可以作增味剂的是(
)。
A.食盐
B.味精
C.柠檬黄
D.苯甲酸钠
2.下列做法中,正确的是(
)。
A.为了使火腿肠的颜色更鲜红,可多加一些着色剂
B.为了使婴儿对食品有浓厚兴趣,可以在婴儿食品中加大量着色剂
C.为保证人体所需足够蛋白质,要多吃肉,少吃蔬菜和水果
D.食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿大
3.下列药物的主要成分能起到解热止痛作用的是(
)。
A.碘酒
B.氢氧化铝
C.青霉素
D.乙酰水杨酸
4.化学与人类生活、社会可持续发展密切相关。下列说法中,不正确的是(
)。
A.“绿色化学”的核心是应用化学原理对环境污染进行治理
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
D.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
5.人类生活、社会的可持续发展与化学密切相关,下列有关叙述中,不正确的是(
)。
A.二氧化硫可以广泛用于食品的增白
B.聚乙烯塑料制品可用于食品的包装
C.次氯酸钠溶液可用于环境的消毒杀菌
D.“地沟油”禁止食用,但可回收再利用
6.“绿色化学实验”已走进课堂,下列做法中符合“绿色化学”的是(
)。
图1
图2
图3
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应的实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④
B.①②③
C.①②④
D.①③④
7.“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符的是(
)。
A.大力研发新型有机溶剂替代水作为溶剂
B.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
C.加强对煤、石油、天然气等的综合利用的研究,提高燃料的利用率
D.甲烷燃烧放出的热量比乙醇少,利用甲烷更“低碳”
8.化肥的作用是补充作物所需的养分,促使作物茁壮成长,从而让作物达到产量高、质量好的目的。下列关于使用化肥的说法中,不正确的是(
)。
A.根据作物所需的营养元素选择化肥品种
B.在保证不烧苗的前提下,化肥应离作物根部愈近效果愈好
C.使用量不宜过多
D.喷施叶面肥料可以完全代替土壤的施肥
9.下列物质都是常见的食品添加剂,其中使用时必须严格控制用量的是(
)。
A.料酒
B.食醋
C.蔗糖
D.亚硝酸钠
10.下列关于化石燃料的综合利用中,正确的是(
)。
A.石油裂化主要得到乙烯
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.用煤制煤气是物理变化,是高效清洁地利用煤的重要途径
11.近几年,国际上提出了“预防污染”这一概念,绿色化学是“预防污染”的根本手段。针对“吸烟”而言,下列活动中,属于实施绿色化学活动的是(
)。
A.减少有毒物:使用过滤嘴、低焦油烟
B.杜绝污染物:禁烟、戒烟
C.处理废弃物:烟灰、烟蒂
D.治理污染点:通风、排除烟雾
12.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中可装入的物质是(
)。
A.生石灰、食盐
B.食盐、硫酸亚铁
C.硅胶、硫酸亚铁
D.无水硫酸铜、蔗糖
13.火法炼铜的原理为Cu2S+O22Cu+SO2,关于该反应,下列说法正确的是(
)。
A.Cu2S只作还原剂
B.O2只作氧化剂
C.Cu2S中的S元素发生还原反应
D.当1
mol
O2参加反应时,共转移4
mol
e-
14.下列有关海水综合利用的说法正确的是(
)。
A.利用电解的方法可以从海水中获取淡水
B.海水蒸发制海盐的过程只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.海水中含有钾元素,只需经过物理变化就可以得到钾单质
15.冶炼金属的4种方法:①热还原法;②活泼金属置换法;③热分解法;④电解法。实际生产:(I)火烧孔雀石炼铜;(II)湿法炼铜;(III)铝热法炼铬;(IV)从光卤石中炼镁。下列实际生产与冶炼方法不相对应的是(
)。
A.(I)①
B.(II)②
C.(III)③
D.(IV)④
二、非选择题(本题共5小题)
16.海水提取镁的主要步骤为:
贝壳
生石灰石灰乳
氢氧化镁氯化镁镁
写出上述步骤中有关反应的化学方程式或离子方程式:
①____________________________________________;
②____________________________________________;
③____________________________________________;
④____________________________________________;
⑤____________________________________________。
17.缺铁性贫血是当机体对铁的需求与供给失衡,导致体内贮存铁耗尽(ID),继之红细胞内铁缺乏(IDE)引起的一种病症。
(1)已知某种硫酸盐可以用来治疗缺铁性贫血,制药厂在药片外包一层特制的糖衣,以防止它在空气中变质而失效。该药品中主要成分的化学式为___________。
①怎样证明该药品中含有亚铁离子?
②请你设计两个实验,以证明该药片是否变质。
(2)已知亚铁离子更容易被人体吸收。服用补铁剂时服用一定量的维生素C(具有还原性)效果更好,其原因是_____________________________________________________。
18.某硫酸厂周围的空气含有较多二氧化硫,为了测定空气中二氧化硫的体积分数完成了如下实验:
在标准状况下,取1
L上述空气(含氮气、氧气、二氧化硫、二氧化碳)慢慢通过足量溴水,之后在所得溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗净,干燥后称重为0.233
g。请回答:
(1)通入足量溴水的目的是________________________________。
(2)加入过量BaCl2溶液的目的是________________________________。
(3)过滤后,若在滤液中加K2SO4溶液,有白色沉淀产生,证明________________。
(4)用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无沉淀出现,证明________________。
(5)空气中二氧化硫的体积分数为________________。(请写出具体计算过程)
19.地球上的金属矿物资源是有限的,应合理开发利用。
(1)下列金属中,通常用电解的方法进行冶炼的是________(填字母)。
A.铝
B.汞
C.铁
D.铜
(2)铝热反应是金属冶炼中的一种重要方法。
①利用下图装置完成铝热反应实验。该铝热反应的化学方程式是________________。实验结束后有熔融物生成,检验该熔融物成分中有铁的实验操作是______________________。
②工业上根据铝热反应的原理,用铝和软锰矿(MnO2)冶炼锰,反应的化学方程式是___________________________________。
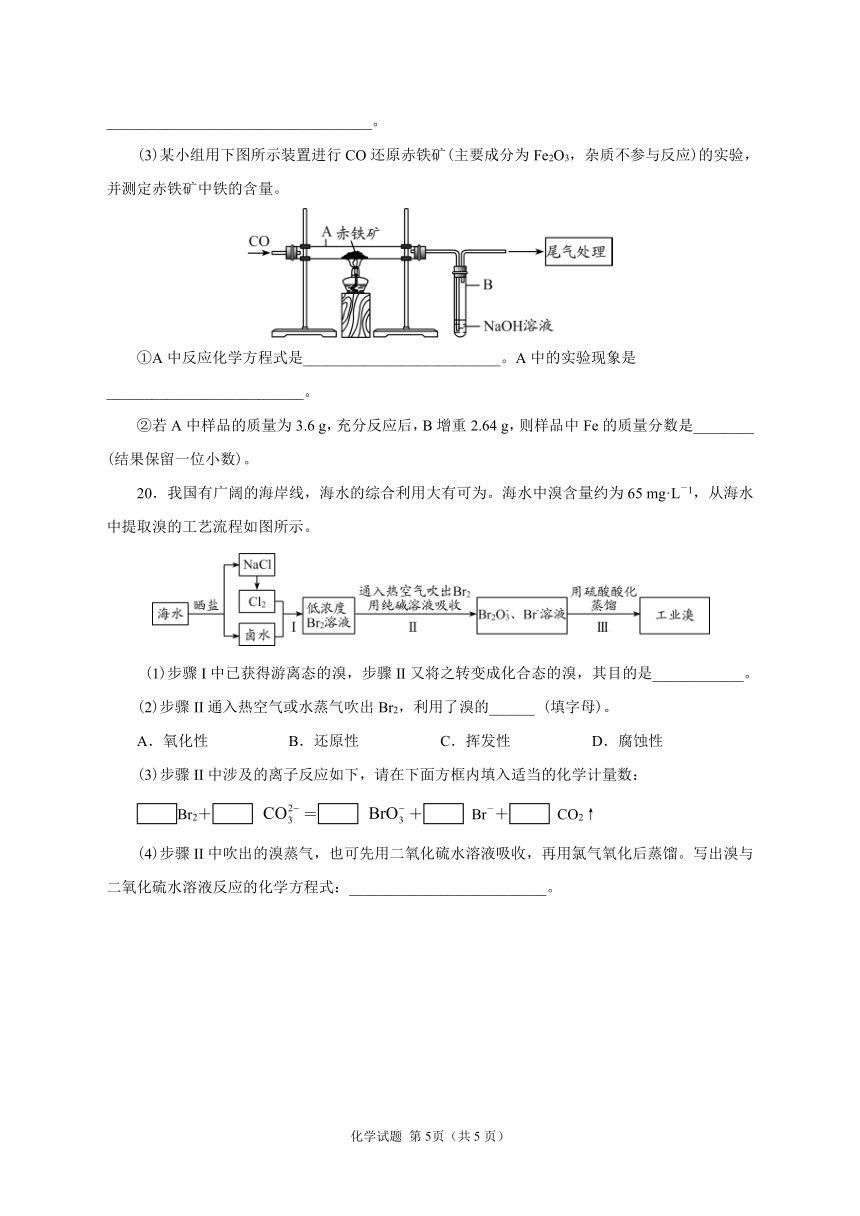
(3)某小组用下图所示装置进行CO还原赤铁矿(主要成分为Fe2O3,杂质不参与反应)的实验,并测定赤铁矿中铁的含量。
①A中反应化学方程式是__________________________。A中的实验现象是__________________________。
②若A中样品的质量为3.6
g,充分反应后,B增重2.64
g,则样品中Fe的质量分数是________
(结果保留一位小数)。
20.我国有广阔的海岸线,海水的综合利用大有可为。海水中溴含量约为65
mg·L-1,从海水中提取溴的工艺流程如图所示。
(1)步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是____________。
(2)步骤II通入热空气或水蒸气吹出Br2,利用了溴的______
(填字母)。
A.氧化性
B.还原性
C.挥发性
D.腐蚀性
(3)步骤II中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
Br2+
=
+
Br-+
CO2↑
(4)步骤II中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________________________。
参考答案
一、选择题
1.A
解析:食盐既可以作防腐剂,又可以作增味剂;味精是增味剂;柠檬黄是着色剂;苯甲酸钠是防腐剂。
考查知识点:食品添加剂
2.D
解析:着色剂应限量使用;婴儿食品中添加大量着色剂有害健康;人体摄入食物时,各种营养成分必须均衡,不能多吃肉,少吃蔬菜和水果;食盐加碘(碘酸钾,KIO3)是为了防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿大。
考查知识点:食品添加剂
3.D
解析:碘酒可以杀菌消毒;氢氧化铝是抗酸药,可以治疗胃酸过多症;青霉素是抗生素类药物,可以起到消炎的作用。
考查知识点:合理使用药物
4.A
解析:“绿色化学”的核心是应用化学原理从源头上控制污染,而不是对污染进行治理;利用二氧化碳制造全降解塑料,不仅能减少白色污染,还可以减少CO2的排放,缓解温室效应;水体富营养化主要是植物营养元素N、P的增多引起的,利用生物方法脱除生活污水中的氮和磷,可以防止水体富营养化;开发高效氢能、太阳能等新型电动汽车,可以减少汽油和柴油的使用量,会解决城市机动车尾气排放问题。
考查知识点:环境保护
5.A
解析:二氧化硫有毒,不能广泛用于食品增白;聚乙烯常温下无毒,可以直接盛放食品,可以做食品的包装;次氯酸钠就是“84消毒液”的主要成分,可以用于环境的消毒杀菌;“地沟油”不卫生,同时含有较多有害物质,禁止食用,但可用来做肥皂等。
考查知识点:人体健康、环境保护、绿色化学综合
6.C
解析:①实验验室收集氨气采用图1所示装置,滴有酚酞的水可吸收多余的氨气防止污染环境,符合“绿色化学”的要求。②实验室中完成氯气与钠的反应实验时采用图2所示装置,用浸有碱液的棉球吸收多余的氯气,可防止污染环境,符合“绿色化学”的要求。③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验,挥发的氯化氢和氨气会污染空气,因此不符合“绿色化学”的要求。④实验室中采用图3所示装置进行铜与稀硝酸的反应,生成的氮氧化物收集在气球里,可以防止污染环境,符合“绿色化学”的要求。
考查知识点:绿色化学、环境保护
7.A
解析:使用有机溶剂会对环境造成污染,不符合“低碳经济”。
考查知识点:能源、环境
8.D
解析:合理使用化肥,要根据作物所需的营养元素来合理的选择化肥品种;合理使用化肥,要注意在一定范围内离作物根部愈近效果愈好,肥料集中,效果显著,故在保证不烧苗的情况下是正确的;要注意施肥的合理数量,不能一次过多,要做到少施勤施,以免烧坏幼苗;必须要明确喷施叶面肥料是辅助施肥的办法,不能完全代替土壤的施肥。
考查知识点:合理使用化肥
9.D
解析:亚硝酸钠作为护色剂,在食品加工工艺中可以使肉和肉制品呈现良好的色泽。它还可以抑制引起肉类变质的微生物的生长。但是,亚硝酸钠也是食品添加剂中毒性较强的物质之一。摄入大量的亚硝酸钠可以使血红蛋白变成高铁血红蛋白,导致组织缺氧。亚硝酸钠还有一定的致癌性。因此,国际上把亚硝酸钠的的用量限制在最低水平。
考查知识点:食品添加剂
10.C
解析:石油裂化是将相对分子质量较大、熔沸点较高的烃转变为相对分子质量较小、熔沸点较低的烃的过程,主要产物是相对分子质量较小的烃的混合物;石油分馏是物理变化,根据沸点不同,分离出汽油、煤油等;用煤制煤气是化学变化。
考查知识点:化石燃料的综合利用
11.B
解析:A是减少有毒物的处理方法,C、D两个选项都是产生污染物后进行处理的方法,只有B符合“预防污染”,使污染物被消灭在源头。
考查知识点:环境保护
12.C
解析:根据“防止食品受潮及富脂食品氧化变质”,需要在包装袋中加入干燥剂和抗氧化剂。硅胶是干燥剂,硫酸亚铁具有还原性,满足题目要求。
考查知识点:油脂的性质、干燥剂
13.B
解析:Cu2S中Cu的化合价从+1价降为0价,体现氧化性,而S的化合价从-2价升高为+4价,发生氧化反应,体现还原性,Cu2S既作还原剂,又作氧化剂;O2中O的化合价从0价降低为-2价,体现氧化性,O2只作氧化剂。当1
mol
O2参加反应时,转移的电子为Cu的2
mol、O的4
mol,共转移6
mol。
考查知识点:金属的冶炼、氧化还原反应
14.C
解析:从海水中获取淡水的方法有蒸馏法、电渗析法、离子交换法,电解法会使得海水中的电解质或水发生化学变化;海水蒸发制海盐的过程只发生了物理变化,没有发生化学变化;从海水中可以得到NaCl,电解熔融NaCl可制备Cl2;海水中含有钾元素,但此时的钾元素是以化合态存在的,要通过化学方法才可得到钾单质。
考查知识点:海水资源的综合利用
15.C
解析:实际生产(I)(II)(III)(IV)中发生的主要反应分别是:(I)Cu2(OH)2CO32CuO
+CO2↑+H2O 2CuO+C2Cu+CO2↑,其炼铜的实质是第二个化学反应,因此(I)①符合;(II)Fe+CuSO4=FeSO4+Cu,铁置换出较不活泼的铜,因此(II)与②符合;(III)Cr2O3+2Al2Cr+Al2O3
,铝置换出较不活泼的铬,因此(III)与②符合(或①);先从光卤石中提取MgCl2,再电解MgCl2,MgCl2(熔融)Mg+Cl2↑,因此(IV)与④符合。
考查知识点:金属的冶炼
二、非选择题
16.①CaCO3CaO+CO2↑
②CaO+H2O=Ca(OH)2
③MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
④Mg(OH)2+2H+=Mg2++H2O
⑤MgCl2(熔融)Mg+Cl2↑
解析:①海滩上贝壳的主要成分为碳酸钙,在高温下分解成生石灰CaO;②向生石灰中加水,制成石灰乳[Ca(OH)2];③把海水引入水渠,加石灰乳,使氢氧化镁沉淀出来;④滤出氢氧化镁沉淀,加盐酸溶解,制成MgCl2溶液;⑤将MgCl2溶液浓缩结晶并制成无水氯化镁,由于镁是较活泼金属,用电解熔融氯化镁的方法制取单质镁。
考查知识点:海水资源的综合利用
17.(1)FeSO4
①取药片溶于水,向所得溶液中个先加入KSCN溶液,然后再滴入氯水,观察溶液是否变红,若变红则证明药品中含有亚铁离子。
②实验1:取药片溶于蒸馏水中,加入KSCN溶液,观察溶液是否变红
实验2:取药片溶于蒸馏水中,加入NaOH溶液,观察有无红褐色沉淀生成
(2)维生素C具有还原性,可将药品放置过程中氧化生成的铁离子还原为亚铁离子。
解析:补铁剂的人体吸收实验证明二价态铁比三价态更有利于人体的吸收,目前补铁剂可分为三种形态:无机态、有机态和生物态。其中无机态补铁剂,如硫酸亚铁价格较低,效果也比较明显。检验铁离子的试剂为KSCN溶液,现象为溶液变成红色。亚铁离子不具有此性质,需将其氧化后再加KSCN溶液。
考查知识点:合理使用药物
18.(1)将SO2全部氧化成SO42-:SO2+Br2+2H2O=H2SO4+2HBr
(2)使SO42-完成生成BaSO4沉淀:Ba2++SO42-=BaSO4↓
(3)所加BaCl2溶液已过量
(4)BaSO4沉淀已洗净
(5)2.24%
n(SO2)=n(BaSO4)=0.233g/233
g.
mol-1=0.001
mol
V(SO2)=n(SO2)×Vm=0.001
mol×22.4
L·mol-1=0.224
L
SO2的体积分数为0.0224
L/1L×100
%=2.24
%
解析:(1)溴水可以氧化二氧化硫,使其转化为硫酸。
(2)氯化钡溶液可沉淀硫酸根离子。
(3)过滤后,若在滤液中加K2SO4溶液,有白色沉淀产生,证明所加BaCl2溶液已过量。
(4)硫酸钡沉淀附着有氯离子,用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无氯化银沉淀出现,证明BaSO4沉淀已洗净。
考查知识点:无机物综合
19.(1)A
(2)①Fe2O3+2AlAl2O3+Fe
用吸铁石接触熔融物
②4Al+3MnO23Mn+2Al2O3
(3)①Fe2O3+CO2Fe+3CO2
固体由红棕色变为黑色
②62.2%
解析:(1)铝的化学性质活泼,工业上采用电解熔融氧化铝的方法冶炼;汞一般采用氧化物热解法;铁和铜往往采用还原剂法冶炼。
(2)铝热反应是工业上采用的一种还原剂法冶炼金属的手段,铝在高温条件下与某些金属氧化物发生置换反应。可依据铁科被磁铁吸引的性质检验铁的熔融物中的铁。
(3)B增重2.64
g,即二氧化碳质量为2.64
g,0.06
mol。根据关系式:
Fe2O3
~
3CO2
0.02
mol
0.06
mol
160
g/mol×0.02
mol=3.2
g
其中含铁2.24
g
2.24g/3.6
g×100%=62.2%
考查知识点:金属的冶炼
20.(1)富集(或浓缩)溴元素
(2)C
(3)3 3 1 5 3
(4)SO2+Br2+2H2O=2HBr+H2SO4
解析:工业生产中要对原料进行富集;溴易挥发,可以采用通入热空气或水蒸气吹出Br2。
考查知识点:海水资源的综合利用
化学试题
第1页(共5页)
可能用到的相对原子质量:C
12 O16 Fe
56
一、选择题(每小题只有1个选项符合题意)
1.下列物质既可以作防腐剂,又可以作增味剂的是(
)。
A.食盐
B.味精
C.柠檬黄
D.苯甲酸钠
2.下列做法中,正确的是(
)。
A.为了使火腿肠的颜色更鲜红,可多加一些着色剂
B.为了使婴儿对食品有浓厚兴趣,可以在婴儿食品中加大量着色剂
C.为保证人体所需足够蛋白质,要多吃肉,少吃蔬菜和水果
D.食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿大
3.下列药物的主要成分能起到解热止痛作用的是(
)。
A.碘酒
B.氢氧化铝
C.青霉素
D.乙酰水杨酸
4.化学与人类生活、社会可持续发展密切相关。下列说法中,不正确的是(
)。
A.“绿色化学”的核心是应用化学原理对环境污染进行治理
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
D.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
5.人类生活、社会的可持续发展与化学密切相关,下列有关叙述中,不正确的是(
)。
A.二氧化硫可以广泛用于食品的增白
B.聚乙烯塑料制品可用于食品的包装
C.次氯酸钠溶液可用于环境的消毒杀菌
D.“地沟油”禁止食用,但可回收再利用
6.“绿色化学实验”已走进课堂,下列做法中符合“绿色化学”的是(
)。
图1
图2
图3
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应的实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④
B.①②③
C.①②④
D.①③④
7.“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式。下列说法与“低碳经济”不符的是(
)。
A.大力研发新型有机溶剂替代水作为溶剂
B.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
C.加强对煤、石油、天然气等的综合利用的研究,提高燃料的利用率
D.甲烷燃烧放出的热量比乙醇少,利用甲烷更“低碳”
8.化肥的作用是补充作物所需的养分,促使作物茁壮成长,从而让作物达到产量高、质量好的目的。下列关于使用化肥的说法中,不正确的是(
)。
A.根据作物所需的营养元素选择化肥品种
B.在保证不烧苗的前提下,化肥应离作物根部愈近效果愈好
C.使用量不宜过多
D.喷施叶面肥料可以完全代替土壤的施肥
9.下列物质都是常见的食品添加剂,其中使用时必须严格控制用量的是(
)。
A.料酒
B.食醋
C.蔗糖
D.亚硝酸钠
10.下列关于化石燃料的综合利用中,正确的是(
)。
A.石油裂化主要得到乙烯
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.用煤制煤气是物理变化,是高效清洁地利用煤的重要途径
11.近几年,国际上提出了“预防污染”这一概念,绿色化学是“预防污染”的根本手段。针对“吸烟”而言,下列活动中,属于实施绿色化学活动的是(
)。
A.减少有毒物:使用过滤嘴、低焦油烟
B.杜绝污染物:禁烟、戒烟
C.处理废弃物:烟灰、烟蒂
D.治理污染点:通风、排除烟雾
12.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中可装入的物质是(
)。
A.生石灰、食盐
B.食盐、硫酸亚铁
C.硅胶、硫酸亚铁
D.无水硫酸铜、蔗糖
13.火法炼铜的原理为Cu2S+O22Cu+SO2,关于该反应,下列说法正确的是(
)。
A.Cu2S只作还原剂
B.O2只作氧化剂
C.Cu2S中的S元素发生还原反应
D.当1
mol
O2参加反应时,共转移4
mol
e-
14.下列有关海水综合利用的说法正确的是(
)。
A.利用电解的方法可以从海水中获取淡水
B.海水蒸发制海盐的过程只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.海水中含有钾元素,只需经过物理变化就可以得到钾单质
15.冶炼金属的4种方法:①热还原法;②活泼金属置换法;③热分解法;④电解法。实际生产:(I)火烧孔雀石炼铜;(II)湿法炼铜;(III)铝热法炼铬;(IV)从光卤石中炼镁。下列实际生产与冶炼方法不相对应的是(
)。
A.(I)①
B.(II)②
C.(III)③
D.(IV)④
二、非选择题(本题共5小题)
16.海水提取镁的主要步骤为:
贝壳
生石灰石灰乳
氢氧化镁氯化镁镁
写出上述步骤中有关反应的化学方程式或离子方程式:
①____________________________________________;
②____________________________________________;
③____________________________________________;
④____________________________________________;
⑤____________________________________________。
17.缺铁性贫血是当机体对铁的需求与供给失衡,导致体内贮存铁耗尽(ID),继之红细胞内铁缺乏(IDE)引起的一种病症。
(1)已知某种硫酸盐可以用来治疗缺铁性贫血,制药厂在药片外包一层特制的糖衣,以防止它在空气中变质而失效。该药品中主要成分的化学式为___________。
①怎样证明该药品中含有亚铁离子?
②请你设计两个实验,以证明该药片是否变质。
(2)已知亚铁离子更容易被人体吸收。服用补铁剂时服用一定量的维生素C(具有还原性)效果更好,其原因是_____________________________________________________。
18.某硫酸厂周围的空气含有较多二氧化硫,为了测定空气中二氧化硫的体积分数完成了如下实验:
在标准状况下,取1
L上述空气(含氮气、氧气、二氧化硫、二氧化碳)慢慢通过足量溴水,之后在所得溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗净,干燥后称重为0.233
g。请回答:
(1)通入足量溴水的目的是________________________________。
(2)加入过量BaCl2溶液的目的是________________________________。
(3)过滤后,若在滤液中加K2SO4溶液,有白色沉淀产生,证明________________。
(4)用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无沉淀出现,证明________________。
(5)空气中二氧化硫的体积分数为________________。(请写出具体计算过程)
19.地球上的金属矿物资源是有限的,应合理开发利用。
(1)下列金属中,通常用电解的方法进行冶炼的是________(填字母)。
A.铝
B.汞
C.铁
D.铜
(2)铝热反应是金属冶炼中的一种重要方法。
①利用下图装置完成铝热反应实验。该铝热反应的化学方程式是________________。实验结束后有熔融物生成,检验该熔融物成分中有铁的实验操作是______________________。
②工业上根据铝热反应的原理,用铝和软锰矿(MnO2)冶炼锰,反应的化学方程式是___________________________________。
(3)某小组用下图所示装置进行CO还原赤铁矿(主要成分为Fe2O3,杂质不参与反应)的实验,并测定赤铁矿中铁的含量。
①A中反应化学方程式是__________________________。A中的实验现象是__________________________。
②若A中样品的质量为3.6
g,充分反应后,B增重2.64
g,则样品中Fe的质量分数是________
(结果保留一位小数)。
20.我国有广阔的海岸线,海水的综合利用大有可为。海水中溴含量约为65
mg·L-1,从海水中提取溴的工艺流程如图所示。
(1)步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是____________。
(2)步骤II通入热空气或水蒸气吹出Br2,利用了溴的______
(填字母)。
A.氧化性
B.还原性
C.挥发性
D.腐蚀性
(3)步骤II中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
Br2+
=
+
Br-+
CO2↑
(4)步骤II中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________________________。
参考答案
一、选择题
1.A
解析:食盐既可以作防腐剂,又可以作增味剂;味精是增味剂;柠檬黄是着色剂;苯甲酸钠是防腐剂。
考查知识点:食品添加剂
2.D
解析:着色剂应限量使用;婴儿食品中添加大量着色剂有害健康;人体摄入食物时,各种营养成分必须均衡,不能多吃肉,少吃蔬菜和水果;食盐加碘(碘酸钾,KIO3)是为了防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿大。
考查知识点:食品添加剂
3.D
解析:碘酒可以杀菌消毒;氢氧化铝是抗酸药,可以治疗胃酸过多症;青霉素是抗生素类药物,可以起到消炎的作用。
考查知识点:合理使用药物
4.A
解析:“绿色化学”的核心是应用化学原理从源头上控制污染,而不是对污染进行治理;利用二氧化碳制造全降解塑料,不仅能减少白色污染,还可以减少CO2的排放,缓解温室效应;水体富营养化主要是植物营养元素N、P的增多引起的,利用生物方法脱除生活污水中的氮和磷,可以防止水体富营养化;开发高效氢能、太阳能等新型电动汽车,可以减少汽油和柴油的使用量,会解决城市机动车尾气排放问题。
考查知识点:环境保护
5.A
解析:二氧化硫有毒,不能广泛用于食品增白;聚乙烯常温下无毒,可以直接盛放食品,可以做食品的包装;次氯酸钠就是“84消毒液”的主要成分,可以用于环境的消毒杀菌;“地沟油”不卫生,同时含有较多有害物质,禁止食用,但可用来做肥皂等。
考查知识点:人体健康、环境保护、绿色化学综合
6.C
解析:①实验验室收集氨气采用图1所示装置,滴有酚酞的水可吸收多余的氨气防止污染环境,符合“绿色化学”的要求。②实验室中完成氯气与钠的反应实验时采用图2所示装置,用浸有碱液的棉球吸收多余的氯气,可防止污染环境,符合“绿色化学”的要求。③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验,挥发的氯化氢和氨气会污染空气,因此不符合“绿色化学”的要求。④实验室中采用图3所示装置进行铜与稀硝酸的反应,生成的氮氧化物收集在气球里,可以防止污染环境,符合“绿色化学”的要求。
考查知识点:绿色化学、环境保护
7.A
解析:使用有机溶剂会对环境造成污染,不符合“低碳经济”。
考查知识点:能源、环境
8.D
解析:合理使用化肥,要根据作物所需的营养元素来合理的选择化肥品种;合理使用化肥,要注意在一定范围内离作物根部愈近效果愈好,肥料集中,效果显著,故在保证不烧苗的情况下是正确的;要注意施肥的合理数量,不能一次过多,要做到少施勤施,以免烧坏幼苗;必须要明确喷施叶面肥料是辅助施肥的办法,不能完全代替土壤的施肥。
考查知识点:合理使用化肥
9.D
解析:亚硝酸钠作为护色剂,在食品加工工艺中可以使肉和肉制品呈现良好的色泽。它还可以抑制引起肉类变质的微生物的生长。但是,亚硝酸钠也是食品添加剂中毒性较强的物质之一。摄入大量的亚硝酸钠可以使血红蛋白变成高铁血红蛋白,导致组织缺氧。亚硝酸钠还有一定的致癌性。因此,国际上把亚硝酸钠的的用量限制在最低水平。
考查知识点:食品添加剂
10.C
解析:石油裂化是将相对分子质量较大、熔沸点较高的烃转变为相对分子质量较小、熔沸点较低的烃的过程,主要产物是相对分子质量较小的烃的混合物;石油分馏是物理变化,根据沸点不同,分离出汽油、煤油等;用煤制煤气是化学变化。
考查知识点:化石燃料的综合利用
11.B
解析:A是减少有毒物的处理方法,C、D两个选项都是产生污染物后进行处理的方法,只有B符合“预防污染”,使污染物被消灭在源头。
考查知识点:环境保护
12.C
解析:根据“防止食品受潮及富脂食品氧化变质”,需要在包装袋中加入干燥剂和抗氧化剂。硅胶是干燥剂,硫酸亚铁具有还原性,满足题目要求。
考查知识点:油脂的性质、干燥剂
13.B
解析:Cu2S中Cu的化合价从+1价降为0价,体现氧化性,而S的化合价从-2价升高为+4价,发生氧化反应,体现还原性,Cu2S既作还原剂,又作氧化剂;O2中O的化合价从0价降低为-2价,体现氧化性,O2只作氧化剂。当1
mol
O2参加反应时,转移的电子为Cu的2
mol、O的4
mol,共转移6
mol。
考查知识点:金属的冶炼、氧化还原反应
14.C
解析:从海水中获取淡水的方法有蒸馏法、电渗析法、离子交换法,电解法会使得海水中的电解质或水发生化学变化;海水蒸发制海盐的过程只发生了物理变化,没有发生化学变化;从海水中可以得到NaCl,电解熔融NaCl可制备Cl2;海水中含有钾元素,但此时的钾元素是以化合态存在的,要通过化学方法才可得到钾单质。
考查知识点:海水资源的综合利用
15.C
解析:实际生产(I)(II)(III)(IV)中发生的主要反应分别是:(I)Cu2(OH)2CO32CuO
+CO2↑+H2O 2CuO+C2Cu+CO2↑,其炼铜的实质是第二个化学反应,因此(I)①符合;(II)Fe+CuSO4=FeSO4+Cu,铁置换出较不活泼的铜,因此(II)与②符合;(III)Cr2O3+2Al2Cr+Al2O3
,铝置换出较不活泼的铬,因此(III)与②符合(或①);先从光卤石中提取MgCl2,再电解MgCl2,MgCl2(熔融)Mg+Cl2↑,因此(IV)与④符合。
考查知识点:金属的冶炼
二、非选择题
16.①CaCO3CaO+CO2↑
②CaO+H2O=Ca(OH)2
③MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
④Mg(OH)2+2H+=Mg2++H2O
⑤MgCl2(熔融)Mg+Cl2↑
解析:①海滩上贝壳的主要成分为碳酸钙,在高温下分解成生石灰CaO;②向生石灰中加水,制成石灰乳[Ca(OH)2];③把海水引入水渠,加石灰乳,使氢氧化镁沉淀出来;④滤出氢氧化镁沉淀,加盐酸溶解,制成MgCl2溶液;⑤将MgCl2溶液浓缩结晶并制成无水氯化镁,由于镁是较活泼金属,用电解熔融氯化镁的方法制取单质镁。
考查知识点:海水资源的综合利用
17.(1)FeSO4
①取药片溶于水,向所得溶液中个先加入KSCN溶液,然后再滴入氯水,观察溶液是否变红,若变红则证明药品中含有亚铁离子。
②实验1:取药片溶于蒸馏水中,加入KSCN溶液,观察溶液是否变红
实验2:取药片溶于蒸馏水中,加入NaOH溶液,观察有无红褐色沉淀生成
(2)维生素C具有还原性,可将药品放置过程中氧化生成的铁离子还原为亚铁离子。
解析:补铁剂的人体吸收实验证明二价态铁比三价态更有利于人体的吸收,目前补铁剂可分为三种形态:无机态、有机态和生物态。其中无机态补铁剂,如硫酸亚铁价格较低,效果也比较明显。检验铁离子的试剂为KSCN溶液,现象为溶液变成红色。亚铁离子不具有此性质,需将其氧化后再加KSCN溶液。
考查知识点:合理使用药物
18.(1)将SO2全部氧化成SO42-:SO2+Br2+2H2O=H2SO4+2HBr
(2)使SO42-完成生成BaSO4沉淀:Ba2++SO42-=BaSO4↓
(3)所加BaCl2溶液已过量
(4)BaSO4沉淀已洗净
(5)2.24%
n(SO2)=n(BaSO4)=0.233g/233
g.
mol-1=0.001
mol
V(SO2)=n(SO2)×Vm=0.001
mol×22.4
L·mol-1=0.224
L
SO2的体积分数为0.0224
L/1L×100
%=2.24
%
解析:(1)溴水可以氧化二氧化硫,使其转化为硫酸。
(2)氯化钡溶液可沉淀硫酸根离子。
(3)过滤后,若在滤液中加K2SO4溶液,有白色沉淀产生,证明所加BaCl2溶液已过量。
(4)硫酸钡沉淀附着有氯离子,用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无氯化银沉淀出现,证明BaSO4沉淀已洗净。
考查知识点:无机物综合
19.(1)A
(2)①Fe2O3+2AlAl2O3+Fe
用吸铁石接触熔融物
②4Al+3MnO23Mn+2Al2O3
(3)①Fe2O3+CO2Fe+3CO2
固体由红棕色变为黑色
②62.2%
解析:(1)铝的化学性质活泼,工业上采用电解熔融氧化铝的方法冶炼;汞一般采用氧化物热解法;铁和铜往往采用还原剂法冶炼。
(2)铝热反应是工业上采用的一种还原剂法冶炼金属的手段,铝在高温条件下与某些金属氧化物发生置换反应。可依据铁科被磁铁吸引的性质检验铁的熔融物中的铁。
(3)B增重2.64
g,即二氧化碳质量为2.64
g,0.06
mol。根据关系式:
Fe2O3
~
3CO2
0.02
mol
0.06
mol
160
g/mol×0.02
mol=3.2
g
其中含铁2.24
g
2.24g/3.6
g×100%=62.2%
考查知识点:金属的冶炼
20.(1)富集(或浓缩)溴元素
(2)C
(3)3 3 1 5 3
(4)SO2+Br2+2H2O=2HBr+H2SO4
解析:工业生产中要对原料进行富集;溴易挥发,可以采用通入热空气或水蒸气吹出Br2。
考查知识点:海水资源的综合利用
化学试题
第1页(共5页)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
