高二化学知能训练(鲁科版选修6):主题4 物质的制备综合检测
文档属性
| 名称 | 高二化学知能训练(鲁科版选修6):主题4 物质的制备综合检测 |

|
|
| 格式 | zip | ||
| 文件大小 | 386.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-29 00:00:00 | ||
图片预览


文档简介
主题综合检测(四)
一、选择题(本题包括15小题,每小题3分,共45分)
1.下列科学家中,为我国化学工业作出重大贡献的是( )
A.邓稼先 B.李四光
C.华罗庚 D.侯德榜
解析:选D。此题考查了化学史知识。邓稼先是核物理学家,李四光为地质学家,华罗庚为数学家,只有侯德榜为化学家,是侯氏制碱法的发明人。
2.下列各图均为检查装置气密性的方法,根据实验现象判断,其中漏气的是( )
解析:选D。由于D中从左端加水后,水进入右端,说明右端的空气可以从其他地方逸出,故D漏气。
3.下列实验不能达到目的的是( )
A.往酸性KMnO4溶液中通入乙烯验证乙烯的还原性
B.加热氯化铵与氢氧化钙固体混合物制取氨气
C.用二氧化锰和稀盐酸反应制取氯气
D.用四氯化碳萃取碘水中的碘
解析:选C。制取氯气,应该用二氧化锰和浓盐酸反应。
4.下列实验室制备有关物质的方法中,合理又实用的是( )
A.用含少量Cu2+的稀硫酸和锌粒反应制氢气
B.煅烧石灰石制备二氧化碳
C.用NH4Cl溶液和Ca(OH)2溶液反应制氨气
D.用FeCl3溶液和NaOH溶液反应制取Fe(OH)3 胶体
解析:选A。A项中锌与Cu2+反应可置换出Cu,Zn—Cu—稀H2SO4形成原电池,可加快化学反应速率;煅烧石灰石需要的温度较高不经济,实验室里用石灰石和稀盐酸反应制取CO2;实验室制NH3是用NH4Cl固体和Ca(OH)2固体混合共热,而不是溶液;将饱和FeCl3溶液滴入沸水中,并不断加热,可制得Fe(OH)3胶体,用D项的方法得到的是Fe(OH)3沉淀而不是胶体。
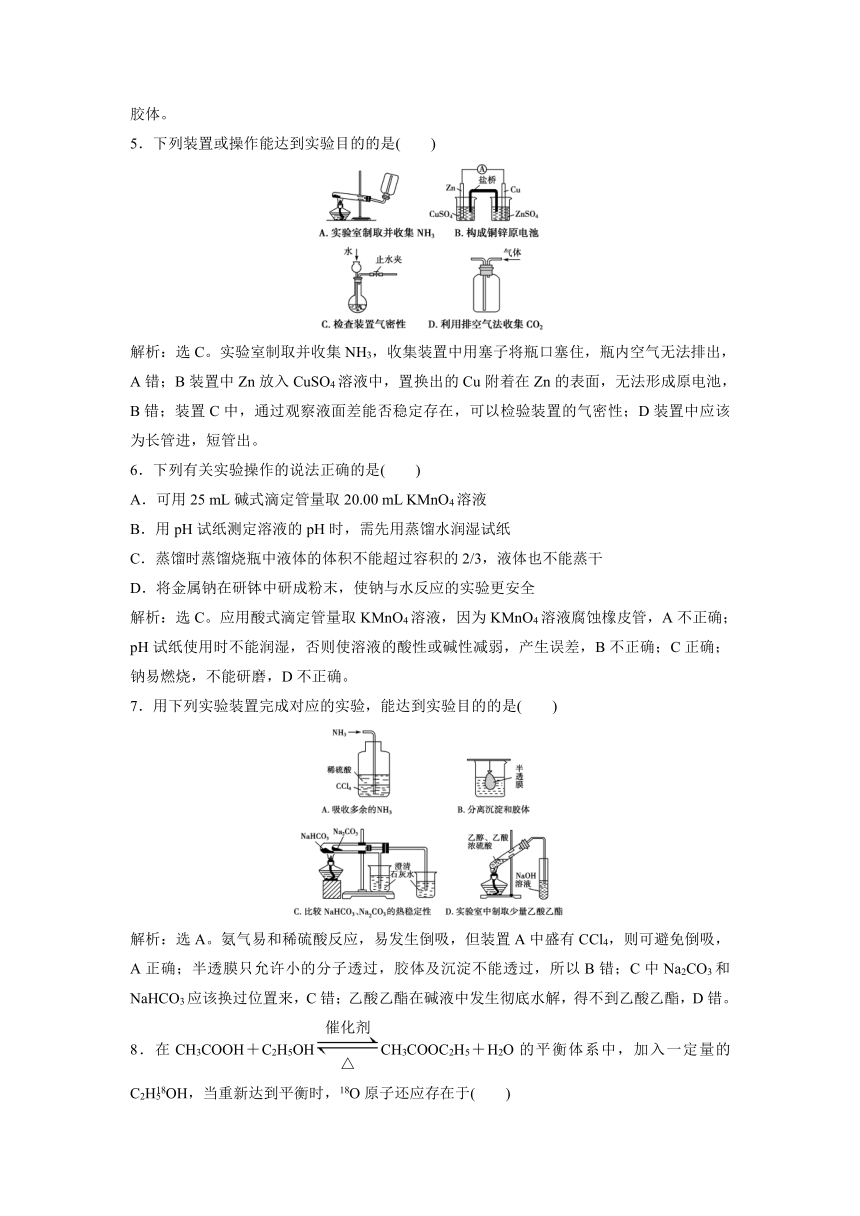
5.下列装置或操作能达到实验目的的是( )
解析:选C。实验室制取并收集NH3,收集装置中用塞子将瓶口塞住,瓶内空气无法排出,A错;B装置中Zn放入CuSO4溶液中,置换出的Cu附着在Zn的表面,无法形成原电池,B错;装置C中,通过观察液面差能否稳定存在,可以检验装置的气密性;D装置中应该为长管进,短管出。
6.下列有关实验操作的说法正确的是( )
A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
解析:选C。应用酸式滴定管量取KMnO4溶液,因为KMnO4溶液腐蚀橡皮管,A不正确;pH试纸使用时不能润湿,否则使溶液的酸性或碱性减弱,产生误差,B不正确;C正确;钠易燃烧,不能研磨,D不正确。
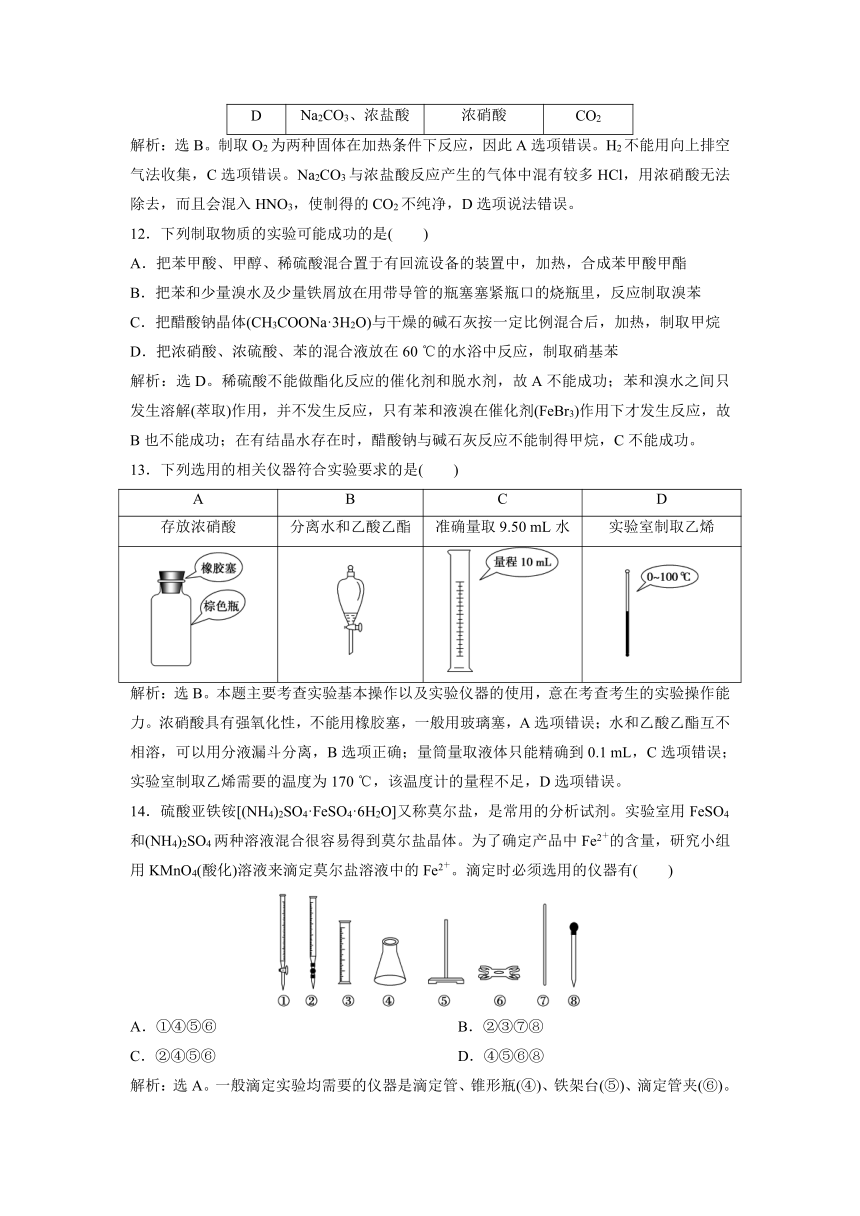
7.用下列实验装置完成对应的实验,能达到实验目的的是( )
解析:选A。氨气易和稀硫酸反应,易发生倒吸,但装置A中盛有CCl4,则可避免倒吸,A正确;半透膜只允许小的分子透过,胶体及沉淀不能透过,所以B错;C中Na2CO3和NaHCO3应该换过位置来,C错;乙酸乙酯在碱液中发生彻底水解,得不到乙酸乙酯,D错。
8.在CH3COOH+C2H5OHCH3COOC2H5+H2O的平衡体系中,加入一定量的C2HOH,当重新达到平衡时,18O原子还应存在于( )
A.乙酸乙酯中 B.乙酸中
C.水中 D.乙酸、乙酸乙酯和水中
解析:选A。羧酸分子中的羟基跟醇分子的羟基中的氢 原子结合成水,其余部分互相结合成酯,所以18O存在于乙酸乙酯中。
9.实验室制乙酸乙酯1 mL后,沿器壁加入紫色石蕊溶液0.5 mL,这时石蕊溶液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡)。对可能出现的现象中,叙述正确的是( )
A.石蕊层仍为紫色,有机层无色
B.石蕊层为三层环,由上而下是红、紫、蓝
C.石蕊层为两层,上层为紫色,下层为蓝色
D.石蕊层为三层环,由上而下是蓝、紫、红
解析:选B。上层酯层中由于混有乙酸而显红色;下层Na2CO3溶液使石蕊溶液显蓝色,由于不振荡,中层仍呈紫色。
10.下列各组物质,只用水不能鉴别的是( )
A.白色粉末:CuSO4、Na2CO3、CaCO3
B.无色液体:乙醇、苯、四氯化碳
C.白色粉末:NaOH、NaCl、NH4NO3
D.无色液体:苯、甲苯、乙醛
解析:选D。A中CuSO4溶于水得到蓝色溶液,Na2CO3溶于水得到无色溶液,CaCO3不溶于水;B中乙醇与水混溶,苯不溶于水浮于水面,CCl4不溶于水沉于水底;C中NaOH溶于水,溶液温度升高;NH4NO3溶于水,溶液温度降低。因此A、B、C三个选项中的物质均可通过水进行鉴别。D中苯和甲苯无法用水鉴别。
11.利用下列装置可以完成的实验组合是( )
选项 制气装置 洗气瓶中试剂 瓶中气体
A 氯酸钾、MnO2 浓硫酸 O2
B 石灰石、稀盐酸 NaHCO3溶液 CO2
C Zn、稀硫酸 浓硫酸 H2
D Na2CO3、浓盐酸 浓硝酸 CO2
解析:选B。制取O2为两种固体在加热条件下反应,因此A选项错误。H2不能用向上排空气法收集,C选项错误。Na2CO3与浓盐酸反应产生的气体中混有较多HCl,用浓硝酸无法除去,而且会混入HNO3,使制得的CO2不纯净,D选项说法错误。
12.下列制取物质的实验可能成功的是( )
A.把苯甲酸、甲醇、稀硫酸混合置于有回流设备的装置中,加热,合成苯甲酸甲酯
B.把苯和少量溴水及少量铁屑放在用带导管的瓶塞塞紧瓶口的烧瓶里,反应制取溴苯
C.把醋酸钠晶体(CH3COONa·3H2O)与干燥的碱石灰按一定比例混合后,加热,制取甲烷
D.把浓硝酸、浓硫酸、苯的混合液放在60 ℃的水浴中反应,制取硝基苯
解析:选D。稀硫酸不能做酯化反应的催化剂和脱水剂,故A不能成功;苯和溴水之间只发生溶解(萃取)作用,并不发生反应,只有苯和液溴在催化剂(FeBr3)作用下才发生反应,故B也不能成功;在有结晶水存在时,醋酸钠与碱石灰反应不能制得甲烷,C不能成功。
13.下列选用的相关仪器符合实验要求的是( )
A B C D
存放浓硝酸 分离水和乙酸乙酯 准确量取9.50 mL水 实验室制取乙烯
解析:选B。本题主要考查实验基本操作以及实验仪器的使用,意在考查考生的实验操作能力。浓硝酸具有强氧化性,不能用橡胶塞,一般用玻璃塞,A选项错误;水和乙酸乙酯互不相溶,可以用分液漏斗分离,B选项正确;量筒量取液体只能精确到0.1 mL,C选项错误;实验室制取乙烯需要的温度为170 ℃,该温度计的量程不足,D选项错误。
14.硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有( )
A.①④⑤⑥ B.②③⑦⑧
C.②④⑤⑥ D.④⑤⑥⑧
解析:选A。一般滴定实验均需要的仪器是滴定管、锥形瓶(④)、铁架台(⑤)、滴定管夹(⑥)。本实验中的KMnO4(酸化)溶液具有强氧化性,必须用酸式滴定管(①)。
15.下列说法正确的是( )
①用25 mL酸式滴定管可以准确放出8.00 mL的稀盐酸
②可用干燥的pH试纸测定氯水的pH ③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大 ④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO存在 ⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液呈碱性时,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ⑥如图是反应物和生成物的能量变化示意图,其可能发生反应的热化学方程式可表示为:2A(g)+B(g)===2C(g) ΔH=Q kJ·mol-1(Q<0)
A.①③⑥ B.②④⑤
C.①③⑤ D.①③⑤⑥
解析:选A。①滴定管的精确度为0.01 mL,因此25 mL酸式滴定管可以准确放出8.00 mL的稀盐酸;②氯水中的HClO具有漂白性,不能用pH试纸测氯水的pH;③使用容量瓶配制溶液,定容时俯视,溶液体积会偏小,溶液的浓度偏大;④含有HCO的溶液中加入盐酸也会放出CO2,因此无法确定是否大量含有CO;⑤溶液呈碱性,则c(OH-)>c(H+),又因电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-),若两者恰好完全反应,溶液的碱性是因CH3COONa水解所致,c(OH-)较小,则会有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),若反应中NaOH过量,则可能会有c(Na+)>c(OH-)>c(CH3COO-)>c(H+);⑥由图示可看出,反应物的总能量高于生成物的总能量,反应放热,ΔH<0。综上所述,A项正确。本题若不能正确分析⑤,则导致错选D项。
二、非选择题(本题包括5小题,共55分)
16.(9分)实验是研究化学的基础,请根据下图回答相关问题:
(1)图①~⑤中所示的实验方法、装置或操作正确的是__________________________。
(2)图⑥所示实验中,两个Fe电极的电极反应式为:
左面:__________________;右面:________________。
(3)图⑦所示实验中,右面试管中盛放的是饱和碳酸钠溶液,其作用为:
________________________________________________________________________
________________________________________________________________________。
(4)由图⑧所示实验可以得出的结论为:
________________________________________________________________________
________________________________________________________________________。
(5)在分液漏斗中加入稀硫酸,锥形瓶中加入NaClO、NaCl的混合溶液,烧杯中加入某种试剂,利用图⑧所示实验装置可验证在酸性条件下,ClO-、Cl2、Fe3+的氧化性强弱。则:
烧杯中加入的试剂为:
________________________________________________________________________;
锥形瓶中发生反应的离子方程式为:
________________________________________________________________________
________________________________________________________________________;
烧杯中的现象为:______________________。
解析:(1)①有危险,②中托盘天平不能读到小数点后两位,④应该用10 mL量筒量取,⑤中若沉淀由白色变为浅黄色,则可证明AgCl的溶度积大于AgBr。
(2)左面Fe电极为正极,H+在该极得电子,发生还原反应;右面Fe电极为负极,铁失电子发生氧化反应。
(3)由于乙醇和乙酸都易挥发,因而有部分混在产品中,可用饱和碳酸钠溶液除去;另外,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小。
(4)根据强酸制弱酸的原理,由锥形瓶中有气泡,烧杯中溶液变浑浊的现象可知:硫酸酸性最强,碳酸次之,硅酸最弱。
(5)NaClO、NaCl在碱性条件下可以共存,但是酸性条件下可以反应生成Cl2,Cl2可将浅绿色的亚铁盐溶液氧化为棕黄色的铁盐溶液。
答案:(1)③⑤
(2)2H++2e-===H2↑ Fe-2e-===Fe2+
(3)①溶解乙醇;②中和乙酸;③降低乙酸乙酯的溶解度
(4)酸性强弱顺序为:硫酸>碳酸>硅酸
(5)FeCl2溶液(或FeSO4溶液)
Cl-+ClO-+2H+===Cl2↑+H2O
溶液由浅绿色变为棕黄色
17.(10分)某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有
A.大理石 B.盐酸
C.氢氧化钠溶液 D.澄清石灰水
三名同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液Na2CO3溶液
乙:NaOH溶液NaHCO3溶液Na2CO3固体Na2CO3溶液
丙:NaOH溶液NaHCO3溶液Na2CO3溶液
请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案________________________________________________________________________。
乙方案________________________________________________________________________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有
________________________________________________________________________。
(3)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3。乙同学选择澄清石灰水测定其中NaHCO3的质量分数,他能否达到实验目的?________(填“能”或“不能”)。若能,请说明计算所需的数据;若不能,请简要说明理由____________________。
解析:设计实验应遵循科学性、安全性、可行性、简约性等原则。NaOH与少量CO2反应生成Na2CO3,与足量CO2反应生成NaHCO3,甲方案不易得到纯Na2CO3溶液。乙方案经过溶液→固体→溶液等过程,过于繁琐。丙方案巧妙利用两等份NaOH溶液,向其中一份中通入过量CO2,使其转化为NaHCO3,再将两份混合,因发生反应:NaOH+NaHCO3===Na2CO3+H2O而生成纯净的Na2CO3溶液。
答案:(1)CO2的通入量不易控制 过程繁琐,操作复杂
(2)反应③应充分进行,反应③与④所用NaOH溶液的体积应相等
(3)能 固体样品的质量和沉淀总质量
18.(11分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4)2S
c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是____________________________________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式)。若实验过程中有氨气逸出,应选用下列________装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________________________________________________________________________,
直到________________________________________________________________________。
用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
解析:本题考查化学实验基础知识,意在考查考生的实验基本操作和技能。
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+,需将Fe2+氧化成Fe3+,再加CuO使其转化为Fe(OH)3沉淀而除去,为了不引入新的杂质,应选用H2O2,即选c;Fe3+与KSCN生成红色溶液,灵敏度高,检验Fe3+的最有效试剂为KSCN,即选d。(2)由CuSO4溶液获得CuSO4·5H2O,需要经过加热蒸发、冷却结晶、过滤而得到;过滤操作除烧杯、漏斗外还用到的另一玻璃仪器为玻璃棒,其作用为引流。(3)向CaCl2溶液中通入二氧化碳不能得到CaCO3,可先向其中通入氨气或加入NH3·H2O,使溶液呈碱性;由于氨气极易溶于水,应防止倒吸,故选b。(4)需要用容量瓶配制某标准溶液,定容时视线应平视凹液面,直到凹液面的最低处与刻度线相平;KMnO4溶液具有很强的氧化性,能腐蚀橡胶,不能选用碱式滴定管,应该选用酸式滴定管。
答案:(1)c d
(2)冷却结晶 引流
(3)NH3·H2O b
(4)平视凹液面(或平视刻度线)
凹液面的最低点与刻度线相切 酸式
19.(12分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OHCH3COOC2H5+H2O。
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有____________、________等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________________________________________________________________________等。
(3)此反应以浓硫酸为催化剂,可能会造成____________________________、
______________________________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合):
同一反应时间 同一反应温度
反应温度/℃ 转化率(%) ★选择性(%) 反应时间/h 转化率(%) ★选择性(%)
40 77.8 100 2 80.2 100
60 92.3 100 3 87.8 100
80 92.6 100 4 92.3 100
120 94.5 98.7 6 93.0 100
★选择性100%表示反应生成的产物是乙酸乙酯和水
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为______________。
解析:本题围绕乙酸乙酯的制备原理设计问题,解题时要运用平衡移动原理分析问题,答案的开放性和数据的分析处理给试题增加了一定难度。
(1)酯化反应是可逆反应,增大乙醇的浓度或者移去乙酸乙酯,都可以使平衡正向移动,从而提高乙酸的转化率。
(2)乙酸、乙醇、乙酸乙酯和水的沸点分别为117.9 ℃、78.5 ℃、77.1 ℃和100 ℃。加热温度偏低时,不但反应进行缓慢,而且不能将生成的乙酸乙酯蒸馏出去;加热温度偏高时,会使乙醇、乙酸未经反应就过多地脱离反应体系,还会使乙醇与浓硫酸之间发生反应生成乙醚等物质。装置中烧瓶上方的导管也太短,不能很好地起到冷凝回流乙醇和乙酸的效果。
(3)浓硫酸有吸水性、脱水性和强氧化性,会使乙醇脱水炭化或生成乙醚,也会导致环境污染,这两点容易想到。
(4)分析表中数据可以看出,采用60 ℃的温度和4 h的时间较好,此时的转化率较高,选择性达100%。不选80 ℃,因为温度升高20 ℃时,转化率仅提高0.3%,不经济。
答案:(1)增大乙醇的浓度 移去生成物
(2)原料来不及反应就被蒸出;温度过高,发生了副反应;冷凝效果不好,部分产物挥发了(任填两种)
(3)产生大量的酸性废液(或造成环境污染) 部分原料炭化 催化剂重复使用困难 催化效果不理想(任填两种)
(4)①C ②乙醇脱水生成了乙醚
20.(13分)(2011年高考天津卷)某研究性学习小组为合成1 丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2CH3CH2CH2CHO CH3CH2CH2CH2OH;
CO的制备原理:HCOOHCO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2 丙醇,从中选择合适的试剂制备氢气,丙烯,写出化学反应方程式:______________________,
________________________________________________________________________。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是________,__________;c和d中盛装的试剂分别是________,________。若用以上装置制备H2, 气体发生装置中必需的玻璃仪器名称是______________;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2 及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1 丁醇粗品。为纯化1 丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1 丁醇118 ℃,并设计出如下提纯路线:
试剂1为________,操作1为________,操作2为________,操作3为________。
解析:(1)实验室利用锌粒和稀盐酸反应制备氢气:Zn+2HCl===ZnCl2+H2↑,利用2 丙醇在浓硫酸催化作用下发生消去反应制备丙烯:CH3CHCH3OHCH3CH===CH2↑+H2O。
(2)制备干燥纯净的CO时,a管的作用是保持分液漏斗的压强平衡,使液体能够顺利流下。装置b为安全瓶,防止倒吸。c瓶盛有NaOH溶液,以除去挥发出的HCOOH;d瓶盛有浓硫酸除去CO中的H2O(g)。制备H2时,可在分液漏斗中装有稀盐酸在蒸馏烧瓶中装有锌粒,通过控制稀盐酸的滴加速度来控制反应的速度。
(3)气体通过各种溶液时,均可带出H2O(g),故应先用无水CuSO4检验H2O(g)(由白色变成蓝色),再用品红溶液检验SO2(品红褪色),SO2和丙烯均可使酸性KMnO4溶液褪色,故应用饱和Na2SO3溶液除去SO2,再用酸性KMnO4溶液检验丙烯(紫红色变浅或褪去)。用石灰水检验CO2气体(产生白色浑浊),故混合物通过试剂的顺序为④⑤①③②或④⑤①②③。
(4)合成正丁醛的反应为正向气体化学计量数减小且放热的可逆反应,升高温度、增大压强和使用催化剂均可增大反应速率。欲提高原料气的转化率,应在不增加反应物用量的情况下,使平衡正向移动,可增大压强或降低温度,综合分析可知,b项符合要求。
(5)由题给信息①可知,向粗品中加入饱和NaHSO3,溶液,使正丁醛转化为CH3CH2CH2CH(OH)SO3Na沉淀,通过过滤的方法除去沉淀,滤液中加入乙醚萃取1 丁醇,分液得到有机层。1 丁醇和乙醚的沸点相差较大,可通过蒸馏的方法除去乙醚,获得较纯净的1 丁醇。
答案:(1)Zn+2HCl===ZnCl2+H2↑
CH3CHCH3OHCH3CH===CH2↑+H2O
(2)恒压 防倒吸 NaOH溶液 浓H2SO4 分液漏斗、蒸馏烧瓶
(3)④⑤①②③(或④⑤①③②) (4)b
(5)饱和NaHSO3溶液 过滤 萃取 蒸馏
一、选择题(本题包括15小题,每小题3分,共45分)
1.下列科学家中,为我国化学工业作出重大贡献的是( )
A.邓稼先 B.李四光
C.华罗庚 D.侯德榜
解析:选D。此题考查了化学史知识。邓稼先是核物理学家,李四光为地质学家,华罗庚为数学家,只有侯德榜为化学家,是侯氏制碱法的发明人。
2.下列各图均为检查装置气密性的方法,根据实验现象判断,其中漏气的是( )
解析:选D。由于D中从左端加水后,水进入右端,说明右端的空气可以从其他地方逸出,故D漏气。
3.下列实验不能达到目的的是( )
A.往酸性KMnO4溶液中通入乙烯验证乙烯的还原性
B.加热氯化铵与氢氧化钙固体混合物制取氨气
C.用二氧化锰和稀盐酸反应制取氯气
D.用四氯化碳萃取碘水中的碘
解析:选C。制取氯气,应该用二氧化锰和浓盐酸反应。
4.下列实验室制备有关物质的方法中,合理又实用的是( )
A.用含少量Cu2+的稀硫酸和锌粒反应制氢气
B.煅烧石灰石制备二氧化碳
C.用NH4Cl溶液和Ca(OH)2溶液反应制氨气
D.用FeCl3溶液和NaOH溶液反应制取Fe(OH)3 胶体
解析:选A。A项中锌与Cu2+反应可置换出Cu,Zn—Cu—稀H2SO4形成原电池,可加快化学反应速率;煅烧石灰石需要的温度较高不经济,实验室里用石灰石和稀盐酸反应制取CO2;实验室制NH3是用NH4Cl固体和Ca(OH)2固体混合共热,而不是溶液;将饱和FeCl3溶液滴入沸水中,并不断加热,可制得Fe(OH)3胶体,用D项的方法得到的是Fe(OH)3沉淀而不是胶体。
5.下列装置或操作能达到实验目的的是( )
解析:选C。实验室制取并收集NH3,收集装置中用塞子将瓶口塞住,瓶内空气无法排出,A错;B装置中Zn放入CuSO4溶液中,置换出的Cu附着在Zn的表面,无法形成原电池,B错;装置C中,通过观察液面差能否稳定存在,可以检验装置的气密性;D装置中应该为长管进,短管出。
6.下列有关实验操作的说法正确的是( )
A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
解析:选C。应用酸式滴定管量取KMnO4溶液,因为KMnO4溶液腐蚀橡皮管,A不正确;pH试纸使用时不能润湿,否则使溶液的酸性或碱性减弱,产生误差,B不正确;C正确;钠易燃烧,不能研磨,D不正确。
7.用下列实验装置完成对应的实验,能达到实验目的的是( )
解析:选A。氨气易和稀硫酸反应,易发生倒吸,但装置A中盛有CCl4,则可避免倒吸,A正确;半透膜只允许小的分子透过,胶体及沉淀不能透过,所以B错;C中Na2CO3和NaHCO3应该换过位置来,C错;乙酸乙酯在碱液中发生彻底水解,得不到乙酸乙酯,D错。
8.在CH3COOH+C2H5OHCH3COOC2H5+H2O的平衡体系中,加入一定量的C2HOH,当重新达到平衡时,18O原子还应存在于( )
A.乙酸乙酯中 B.乙酸中
C.水中 D.乙酸、乙酸乙酯和水中
解析:选A。羧酸分子中的羟基跟醇分子的羟基中的氢 原子结合成水,其余部分互相结合成酯,所以18O存在于乙酸乙酯中。
9.实验室制乙酸乙酯1 mL后,沿器壁加入紫色石蕊溶液0.5 mL,这时石蕊溶液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡)。对可能出现的现象中,叙述正确的是( )
A.石蕊层仍为紫色,有机层无色
B.石蕊层为三层环,由上而下是红、紫、蓝
C.石蕊层为两层,上层为紫色,下层为蓝色
D.石蕊层为三层环,由上而下是蓝、紫、红
解析:选B。上层酯层中由于混有乙酸而显红色;下层Na2CO3溶液使石蕊溶液显蓝色,由于不振荡,中层仍呈紫色。
10.下列各组物质,只用水不能鉴别的是( )
A.白色粉末:CuSO4、Na2CO3、CaCO3
B.无色液体:乙醇、苯、四氯化碳
C.白色粉末:NaOH、NaCl、NH4NO3
D.无色液体:苯、甲苯、乙醛
解析:选D。A中CuSO4溶于水得到蓝色溶液,Na2CO3溶于水得到无色溶液,CaCO3不溶于水;B中乙醇与水混溶,苯不溶于水浮于水面,CCl4不溶于水沉于水底;C中NaOH溶于水,溶液温度升高;NH4NO3溶于水,溶液温度降低。因此A、B、C三个选项中的物质均可通过水进行鉴别。D中苯和甲苯无法用水鉴别。
11.利用下列装置可以完成的实验组合是( )
选项 制气装置 洗气瓶中试剂 瓶中气体
A 氯酸钾、MnO2 浓硫酸 O2
B 石灰石、稀盐酸 NaHCO3溶液 CO2
C Zn、稀硫酸 浓硫酸 H2
D Na2CO3、浓盐酸 浓硝酸 CO2
解析:选B。制取O2为两种固体在加热条件下反应,因此A选项错误。H2不能用向上排空气法收集,C选项错误。Na2CO3与浓盐酸反应产生的气体中混有较多HCl,用浓硝酸无法除去,而且会混入HNO3,使制得的CO2不纯净,D选项说法错误。
12.下列制取物质的实验可能成功的是( )
A.把苯甲酸、甲醇、稀硫酸混合置于有回流设备的装置中,加热,合成苯甲酸甲酯
B.把苯和少量溴水及少量铁屑放在用带导管的瓶塞塞紧瓶口的烧瓶里,反应制取溴苯
C.把醋酸钠晶体(CH3COONa·3H2O)与干燥的碱石灰按一定比例混合后,加热,制取甲烷
D.把浓硝酸、浓硫酸、苯的混合液放在60 ℃的水浴中反应,制取硝基苯
解析:选D。稀硫酸不能做酯化反应的催化剂和脱水剂,故A不能成功;苯和溴水之间只发生溶解(萃取)作用,并不发生反应,只有苯和液溴在催化剂(FeBr3)作用下才发生反应,故B也不能成功;在有结晶水存在时,醋酸钠与碱石灰反应不能制得甲烷,C不能成功。
13.下列选用的相关仪器符合实验要求的是( )
A B C D
存放浓硝酸 分离水和乙酸乙酯 准确量取9.50 mL水 实验室制取乙烯
解析:选B。本题主要考查实验基本操作以及实验仪器的使用,意在考查考生的实验操作能力。浓硝酸具有强氧化性,不能用橡胶塞,一般用玻璃塞,A选项错误;水和乙酸乙酯互不相溶,可以用分液漏斗分离,B选项正确;量筒量取液体只能精确到0.1 mL,C选项错误;实验室制取乙烯需要的温度为170 ℃,该温度计的量程不足,D选项错误。
14.硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有( )
A.①④⑤⑥ B.②③⑦⑧
C.②④⑤⑥ D.④⑤⑥⑧
解析:选A。一般滴定实验均需要的仪器是滴定管、锥形瓶(④)、铁架台(⑤)、滴定管夹(⑥)。本实验中的KMnO4(酸化)溶液具有强氧化性,必须用酸式滴定管(①)。
15.下列说法正确的是( )
①用25 mL酸式滴定管可以准确放出8.00 mL的稀盐酸
②可用干燥的pH试纸测定氯水的pH ③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大 ④加入盐酸有能使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO存在 ⑤在某温度下,一定量的醋酸与氢氧化钠溶液充分混合,若溶液呈碱性时,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ⑥如图是反应物和生成物的能量变化示意图,其可能发生反应的热化学方程式可表示为:2A(g)+B(g)===2C(g) ΔH=Q kJ·mol-1(Q<0)
A.①③⑥ B.②④⑤
C.①③⑤ D.①③⑤⑥
解析:选A。①滴定管的精确度为0.01 mL,因此25 mL酸式滴定管可以准确放出8.00 mL的稀盐酸;②氯水中的HClO具有漂白性,不能用pH试纸测氯水的pH;③使用容量瓶配制溶液,定容时俯视,溶液体积会偏小,溶液的浓度偏大;④含有HCO的溶液中加入盐酸也会放出CO2,因此无法确定是否大量含有CO;⑤溶液呈碱性,则c(OH-)>c(H+),又因电荷守恒c(H+)+c(Na+)=c(CH3COO-)+c(OH-),若两者恰好完全反应,溶液的碱性是因CH3COONa水解所致,c(OH-)较小,则会有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),若反应中NaOH过量,则可能会有c(Na+)>c(OH-)>c(CH3COO-)>c(H+);⑥由图示可看出,反应物的总能量高于生成物的总能量,反应放热,ΔH<0。综上所述,A项正确。本题若不能正确分析⑤,则导致错选D项。
二、非选择题(本题包括5小题,共55分)
16.(9分)实验是研究化学的基础,请根据下图回答相关问题:
(1)图①~⑤中所示的实验方法、装置或操作正确的是__________________________。
(2)图⑥所示实验中,两个Fe电极的电极反应式为:
左面:__________________;右面:________________。
(3)图⑦所示实验中,右面试管中盛放的是饱和碳酸钠溶液,其作用为:
________________________________________________________________________
________________________________________________________________________。
(4)由图⑧所示实验可以得出的结论为:
________________________________________________________________________
________________________________________________________________________。
(5)在分液漏斗中加入稀硫酸,锥形瓶中加入NaClO、NaCl的混合溶液,烧杯中加入某种试剂,利用图⑧所示实验装置可验证在酸性条件下,ClO-、Cl2、Fe3+的氧化性强弱。则:
烧杯中加入的试剂为:
________________________________________________________________________;
锥形瓶中发生反应的离子方程式为:
________________________________________________________________________
________________________________________________________________________;
烧杯中的现象为:______________________。
解析:(1)①有危险,②中托盘天平不能读到小数点后两位,④应该用10 mL量筒量取,⑤中若沉淀由白色变为浅黄色,则可证明AgCl的溶度积大于AgBr。
(2)左面Fe电极为正极,H+在该极得电子,发生还原反应;右面Fe电极为负极,铁失电子发生氧化反应。
(3)由于乙醇和乙酸都易挥发,因而有部分混在产品中,可用饱和碳酸钠溶液除去;另外,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小。
(4)根据强酸制弱酸的原理,由锥形瓶中有气泡,烧杯中溶液变浑浊的现象可知:硫酸酸性最强,碳酸次之,硅酸最弱。
(5)NaClO、NaCl在碱性条件下可以共存,但是酸性条件下可以反应生成Cl2,Cl2可将浅绿色的亚铁盐溶液氧化为棕黄色的铁盐溶液。
答案:(1)③⑤
(2)2H++2e-===H2↑ Fe-2e-===Fe2+
(3)①溶解乙醇;②中和乙酸;③降低乙酸乙酯的溶解度
(4)酸性强弱顺序为:硫酸>碳酸>硅酸
(5)FeCl2溶液(或FeSO4溶液)
Cl-+ClO-+2H+===Cl2↑+H2O
溶液由浅绿色变为棕黄色
17.(10分)某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有
A.大理石 B.盐酸
C.氢氧化钠溶液 D.澄清石灰水
三名同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液Na2CO3溶液
乙:NaOH溶液NaHCO3溶液Na2CO3固体Na2CO3溶液
丙:NaOH溶液NaHCO3溶液Na2CO3溶液
请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案________________________________________________________________________。
乙方案________________________________________________________________________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有
________________________________________________________________________。
(3)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3。乙同学选择澄清石灰水测定其中NaHCO3的质量分数,他能否达到实验目的?________(填“能”或“不能”)。若能,请说明计算所需的数据;若不能,请简要说明理由____________________。
解析:设计实验应遵循科学性、安全性、可行性、简约性等原则。NaOH与少量CO2反应生成Na2CO3,与足量CO2反应生成NaHCO3,甲方案不易得到纯Na2CO3溶液。乙方案经过溶液→固体→溶液等过程,过于繁琐。丙方案巧妙利用两等份NaOH溶液,向其中一份中通入过量CO2,使其转化为NaHCO3,再将两份混合,因发生反应:NaOH+NaHCO3===Na2CO3+H2O而生成纯净的Na2CO3溶液。
答案:(1)CO2的通入量不易控制 过程繁琐,操作复杂
(2)反应③应充分进行,反应③与④所用NaOH溶液的体积应相等
(3)能 固体样品的质量和沉淀总质量
18.(11分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4)2S
c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是____________________________________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式)。若实验过程中有氨气逸出,应选用下列________装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________________________________________________________________________,
直到________________________________________________________________________。
用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
解析:本题考查化学实验基础知识,意在考查考生的实验基本操作和技能。
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+,需将Fe2+氧化成Fe3+,再加CuO使其转化为Fe(OH)3沉淀而除去,为了不引入新的杂质,应选用H2O2,即选c;Fe3+与KSCN生成红色溶液,灵敏度高,检验Fe3+的最有效试剂为KSCN,即选d。(2)由CuSO4溶液获得CuSO4·5H2O,需要经过加热蒸发、冷却结晶、过滤而得到;过滤操作除烧杯、漏斗外还用到的另一玻璃仪器为玻璃棒,其作用为引流。(3)向CaCl2溶液中通入二氧化碳不能得到CaCO3,可先向其中通入氨气或加入NH3·H2O,使溶液呈碱性;由于氨气极易溶于水,应防止倒吸,故选b。(4)需要用容量瓶配制某标准溶液,定容时视线应平视凹液面,直到凹液面的最低处与刻度线相平;KMnO4溶液具有很强的氧化性,能腐蚀橡胶,不能选用碱式滴定管,应该选用酸式滴定管。
答案:(1)c d
(2)冷却结晶 引流
(3)NH3·H2O b
(4)平视凹液面(或平视刻度线)
凹液面的最低点与刻度线相切 酸式
19.(12分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OHCH3COOC2H5+H2O。
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有____________、________等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________________________________________________________________________等。
(3)此反应以浓硫酸为催化剂,可能会造成____________________________、
______________________________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合):
同一反应时间 同一反应温度
反应温度/℃ 转化率(%) ★选择性(%) 反应时间/h 转化率(%) ★选择性(%)
40 77.8 100 2 80.2 100
60 92.3 100 3 87.8 100
80 92.6 100 4 92.3 100
120 94.5 98.7 6 93.0 100
★选择性100%表示反应生成的产物是乙酸乙酯和水
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为______________。
解析:本题围绕乙酸乙酯的制备原理设计问题,解题时要运用平衡移动原理分析问题,答案的开放性和数据的分析处理给试题增加了一定难度。
(1)酯化反应是可逆反应,增大乙醇的浓度或者移去乙酸乙酯,都可以使平衡正向移动,从而提高乙酸的转化率。
(2)乙酸、乙醇、乙酸乙酯和水的沸点分别为117.9 ℃、78.5 ℃、77.1 ℃和100 ℃。加热温度偏低时,不但反应进行缓慢,而且不能将生成的乙酸乙酯蒸馏出去;加热温度偏高时,会使乙醇、乙酸未经反应就过多地脱离反应体系,还会使乙醇与浓硫酸之间发生反应生成乙醚等物质。装置中烧瓶上方的导管也太短,不能很好地起到冷凝回流乙醇和乙酸的效果。
(3)浓硫酸有吸水性、脱水性和强氧化性,会使乙醇脱水炭化或生成乙醚,也会导致环境污染,这两点容易想到。
(4)分析表中数据可以看出,采用60 ℃的温度和4 h的时间较好,此时的转化率较高,选择性达100%。不选80 ℃,因为温度升高20 ℃时,转化率仅提高0.3%,不经济。
答案:(1)增大乙醇的浓度 移去生成物
(2)原料来不及反应就被蒸出;温度过高,发生了副反应;冷凝效果不好,部分产物挥发了(任填两种)
(3)产生大量的酸性废液(或造成环境污染) 部分原料炭化 催化剂重复使用困难 催化效果不理想(任填两种)
(4)①C ②乙醇脱水生成了乙醚
20.(13分)(2011年高考天津卷)某研究性学习小组为合成1 丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2CH3CH2CH2CHO CH3CH2CH2CH2OH;
CO的制备原理:HCOOHCO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2 丙醇,从中选择合适的试剂制备氢气,丙烯,写出化学反应方程式:______________________,
________________________________________________________________________。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是________,__________;c和d中盛装的试剂分别是________,________。若用以上装置制备H2, 气体发生装置中必需的玻璃仪器名称是______________;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2 及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1 丁醇粗品。为纯化1 丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1 丁醇118 ℃,并设计出如下提纯路线:
试剂1为________,操作1为________,操作2为________,操作3为________。
解析:(1)实验室利用锌粒和稀盐酸反应制备氢气:Zn+2HCl===ZnCl2+H2↑,利用2 丙醇在浓硫酸催化作用下发生消去反应制备丙烯:CH3CHCH3OHCH3CH===CH2↑+H2O。
(2)制备干燥纯净的CO时,a管的作用是保持分液漏斗的压强平衡,使液体能够顺利流下。装置b为安全瓶,防止倒吸。c瓶盛有NaOH溶液,以除去挥发出的HCOOH;d瓶盛有浓硫酸除去CO中的H2O(g)。制备H2时,可在分液漏斗中装有稀盐酸在蒸馏烧瓶中装有锌粒,通过控制稀盐酸的滴加速度来控制反应的速度。
(3)气体通过各种溶液时,均可带出H2O(g),故应先用无水CuSO4检验H2O(g)(由白色变成蓝色),再用品红溶液检验SO2(品红褪色),SO2和丙烯均可使酸性KMnO4溶液褪色,故应用饱和Na2SO3溶液除去SO2,再用酸性KMnO4溶液检验丙烯(紫红色变浅或褪去)。用石灰水检验CO2气体(产生白色浑浊),故混合物通过试剂的顺序为④⑤①③②或④⑤①②③。
(4)合成正丁醛的反应为正向气体化学计量数减小且放热的可逆反应,升高温度、增大压强和使用催化剂均可增大反应速率。欲提高原料气的转化率,应在不增加反应物用量的情况下,使平衡正向移动,可增大压强或降低温度,综合分析可知,b项符合要求。
(5)由题给信息①可知,向粗品中加入饱和NaHSO3,溶液,使正丁醛转化为CH3CH2CH2CH(OH)SO3Na沉淀,通过过滤的方法除去沉淀,滤液中加入乙醚萃取1 丁醇,分液得到有机层。1 丁醇和乙醚的沸点相差较大,可通过蒸馏的方法除去乙醚,获得较纯净的1 丁醇。
答案:(1)Zn+2HCl===ZnCl2+H2↑
CH3CHCH3OHCH3CH===CH2↑+H2O
(2)恒压 防倒吸 NaOH溶液 浓H2SO4 分液漏斗、蒸馏烧瓶
(3)④⑤①②③(或④⑤①③②) (4)b
(5)饱和NaHSO3溶液 过滤 萃取 蒸馏
