2020--2021人教化学九下第九单元 溶液同步题含答案
文档属性
| 名称 | 2020--2021人教化学九下第九单元 溶液同步题含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 387.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-28 20:56:14 | ||
图片预览


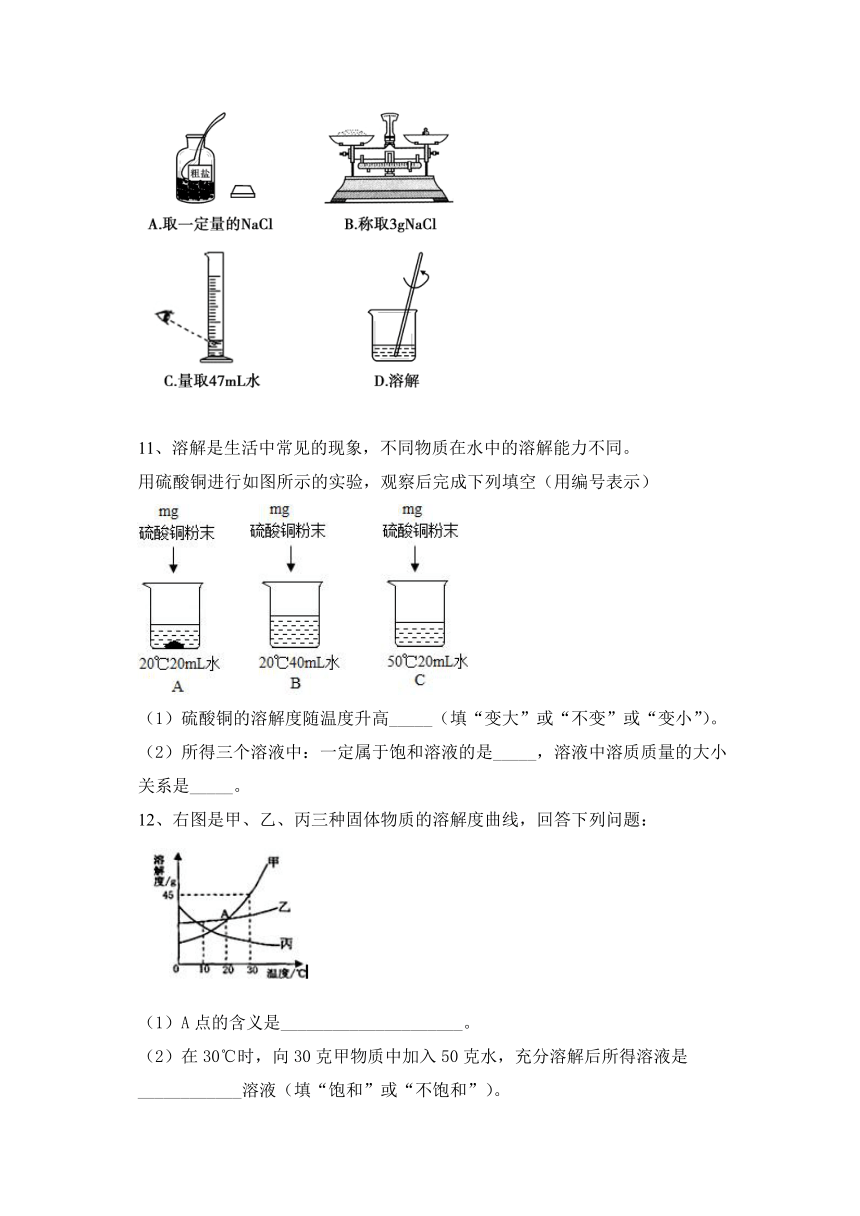

文档简介
2020--2021人教化学九下第九单元 溶液同步题含答案
第九单元 溶液*
1、下列有关溶液的说法中不正确的是( )
A.?硝酸铵溶于水,使溶液温度降低??
B.?外界条件不改变,溶质不会从溶液中分离出来
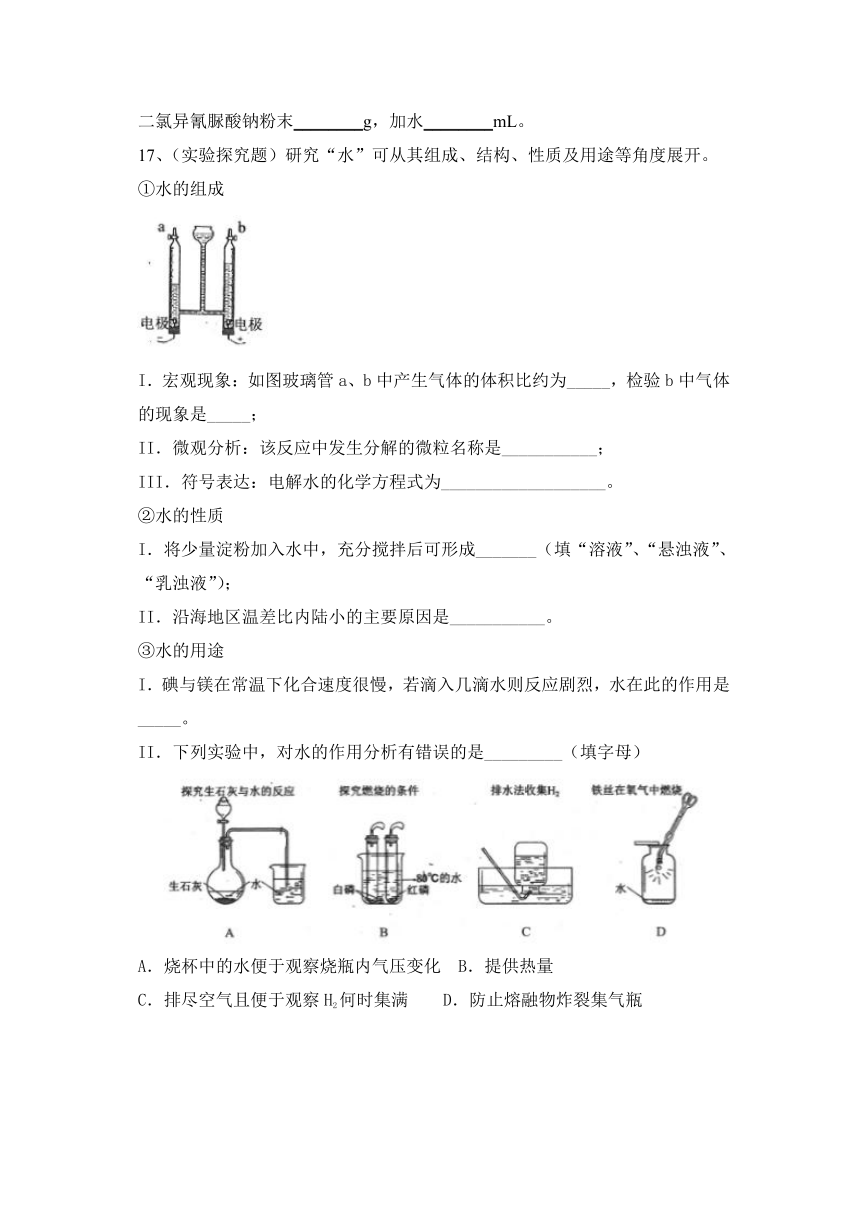
C.?氯化钾饱和溶液中可以溶解少量硫酸铜晶体
D.?食用油加入含有洗洁精的水中,振荡后,可形成溶液
2、餐桌上的饮品种类丰富,下列饮品中属于溶液的是( )
A.酸奶 B.玉米糊 C.冰水 D.可乐
3、喝了汽水以后常常会打嗝。下列图示能正确解释这一现象的是( )
A. B.
C. D.
4、20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是??? (?????? )
②中所得溶液是饱和溶液
B.?③④溶液的溶质质量分数相等
C.?20℃时10g水最多能溶解4g NaCl?
?D.?①所得溶液的溶质质量分数为20%
5、将50g 20%的氯化钾溶液稀释到5%,需要加水的质量为( )
A.50g B.100g C.150g D.200g
6、下列关于溶液的说法正确的是( )
A.能溶解其他物质的物质叫做溶剂
B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的
D.饱和溶液一定是浓溶液
7、进行如下实验:①在室温下,向盛有20 mL水的烧杯中,加入5 g氯化钠,搅拌,氯化钠全部溶解;②再取5 g氯化钠,先从中取出少量放入烧杯中,搅拌,氯化钠全部溶解;③将剩余氯化钠全部倒入烧杯中,搅拌,发现烧杯中溶液底部有未溶解的固体;④继续向该烧杯中加入15 mL水,烧杯中形成无色溶液。据此判断下列说法错误的是 ( )
A.一定温度下,一定量水中不能无限制地溶解氯化钠
B.实验①中得到的是氯化钠的不饱和溶液
C.实验③中得到的是氯化钠的饱和溶液
D.实验④中继续向该烧杯中加入15 mL水,未溶解的固体不会减少
8、20 ℃时,在100 g水中最多能溶解5 g某物质,则该物质的溶解性属于( )
A.易溶 B.可溶
C.微溶 D.难溶
9、下列有关溶液的说法正确的是(?? )
A.?不饱和溶液转化为饱和溶液溶质的质量分数一定变大
B.?同种溶质的饱和溶液一定比它的不饱和溶液溶质的质量分数大
C.?饱和溶液转化为不饱和溶液溶液的质量一定增大
D.?饱和溶液恒温蒸发部分溶剂后溶质的质量分数一定不变
10、某同学在实验室配制50g 6%的氯化钠溶液,如图所示为部分操作,其中错误的是( )
11、溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
用硫酸铜进行如图所示的实验,观察后完成下列填空(用编号表示)
(1)硫酸铜的溶解度随温度升高_____(填“变大”或“不变”或“变小”)。
(2)所得三个溶液中:一定属于饱和溶液的是_____,溶液中溶质质量的大小关系是_____。
12、右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
13、一瓶体积为250mL,质量为250g的葡萄糖注射液中含葡萄糖12.5克,则该葡萄糖注射液的密度为________克/厘米3 , 葡萄糖的质量分数为________.
14、用托盘天平称取NaCl时,首先要调节__ __,然后两盘分别放一张大小相同的纸,称量时,左盘放__ __,右盘放__ __。
15、t2℃时,将甲、乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一,甲和乙的溶解度曲线如图二。请结合图示回答下列问题:
(1)固体甲对应的溶解度曲线是_______(填“a”或“b”)。
(2)M点的含义_____________________。
(3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体析出,你认为“全部溶解”的原因是________________________。
(4)将t2℃等质量的甲、乙饱和溶液分别降温到t1℃时,所得溶液的有关说法正确的是______(填字母)。
a. 甲溶液仍为饱和溶液 b. 两溶液质量甲<乙
c. 两溶液中溶剂质量甲=乙 d. 两溶液溶质质量分数甲>乙
16、为预防“禽流感”,某蛋鸡厂每周对鸡舍用5%的二氯异氰脲酸钠溶液喷洒消毒一次。现需要配制溶质质量分数为5%的二氯异氰脲酸钠消毒液1500g,需要二氯异氰脲酸钠粉末________g,加水________mL。
17、(实验探究题)研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
2020--2021人教化学九下第九单元 溶液同步题含答案
第九单元 溶液*
1、下列有关溶液的说法中不正确的是( )
A.?硝酸铵溶于水,使溶液温度降低??
B.?外界条件不改变,溶质不会从溶液中分离出来
C.?氯化钾饱和溶液中可以溶解少量硫酸铜晶体
D.?食用油加入含有洗洁精的水中,振荡后,可形成溶液
【答案】D
2、餐桌上的饮品种类丰富,下列饮品中属于溶液的是( )
A.酸奶 B.玉米糊 C.冰水 D.可乐
【答案】D
3、喝了汽水以后常常会打嗝。下列图示能正确解释这一现象的是( )
A. B.
C. D.
【答案】B。
4、20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是??? (?????? )
A.?②中所得溶液是饱和溶液???????????????????????????B.?③④溶液的溶质质量分数相等
C.?20℃时10g水最多能溶解4g NaCl????????????D.?①所得溶液的溶质质量分数为20%
【答案】 B
5、将50g 20%的氯化钾溶液稀释到5%,需要加水的质量为( )
A.50g B.100g C.150g D.200g
【答案】C
6、下列关于溶液的说法正确的是( )
A.能溶解其他物质的物质叫做溶剂
B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的
D.饱和溶液一定是浓溶液
【答案】A
7、进行如下实验:①在室温下,向盛有20 mL水的烧杯中,加入5 g氯化钠,搅拌,氯化钠全部溶解;②再取5 g氯化钠,先从中取出少量放入烧杯中,搅拌,氯化钠全部溶解;③将剩余氯化钠全部倒入烧杯中,搅拌,发现烧杯中溶液底部有未溶解的固体;④继续向该烧杯中加入15 mL水,烧杯中形成无色溶液。据此判断下列说法错误的是 ( )
A.一定温度下,一定量水中不能无限制地溶解氯化钠
B.实验①中得到的是氯化钠的不饱和溶液
C.实验③中得到的是氯化钠的饱和溶液
D.实验④中继续向该烧杯中加入15 mL水,未溶解的固体不会减少
【答案】D
8、20 ℃时,在100 g水中最多能溶解5 g某物质,则该物质的溶解性属于( )
A.易溶 B.可溶
C.微溶 D.难溶
【答案】B
9、下列有关溶液的说法正确的是(?? )
A.?不饱和溶液转化为饱和溶液溶质的质量分数一定变大
B.?同种溶质的饱和溶液一定比它的不饱和溶液溶质的质量分数大
C.?饱和溶液转化为不饱和溶液溶液的质量一定增大
D.?饱和溶液恒温蒸发部分溶剂后溶质的质量分数一定不变
【答案】D
10、某同学在实验室配制50g 6%的氯化钠溶液,如图所示为部分操作,其中错误的是( )
【答案】C
11、溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
用硫酸铜进行如图所示的实验,观察后完成下列填空(用编号表示)
(1)硫酸铜的溶解度随温度升高_____(填“变大”或“不变”或“变小”)。
(2)所得三个溶液中:一定属于饱和溶液的是_____,溶液中溶质质量的大小关系是_____。
【答案】变大 A B=C>A
12、右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
【答案】(1)20℃时,曱乙两种物质的溶解度相等(2)饱和
(3)蒸发结晶(4)丙
13、一瓶体积为250mL,质量为250g的葡萄糖注射液中含葡萄糖12.5克,则该葡萄糖注射液的密度为________克/厘米3 , 葡萄糖的质量分数为________.
【答案】1;5%
14、用托盘天平称取NaCl时,首先要调节__ __,然后两盘分别放一张大小相同的纸,称量时,左盘放__ __,右盘放__ __。
【答案】天平平衡 NaCl 砝码
15、t2℃时,将甲、乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一,甲和乙的溶解度曲线如图二。请结合图示回答下列问题:
(1)固体甲对应的溶解度曲线是_______(填“a”或“b”)。
(2)M点的含义_____________________。
(3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体析出,你认为“全部溶解”的原因是________________________。
(4)将t2℃等质量的甲、乙饱和溶液分别降温到t1℃时,所得溶液的有关说法正确的是______(填字母)。
a. 甲溶液仍为饱和溶液 b. 两溶液质量甲<乙
c. 两溶液中溶剂质量甲=乙 d. 两溶液溶质质量分数甲>乙
【答案】(1)a;(2)t1℃时,甲乙两物质的溶解度相等;
(3)甲物质溶解时放热,溶液温度升高,溶解度增大 (4)abd
16、为预防“禽流感”,某蛋鸡厂每周对鸡舍用5%的二氯异氰脲酸钠溶液喷洒消毒一次。现需要配制溶质质量分数为5%的二氯异氰脲酸钠消毒液1500g,需要二氯异氰脲酸钠粉末________g,加水________mL。
【答案】 75;1425
17、(实验探究题)研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
【答案】2:1 打开活塞,带火星的木条靠近管口,木条复燃 水分子 2H2O2H2↑+ O2↑ 悬浊液 水的比热容大 加快化学反应速率 B
第九单元 溶液*
1、下列有关溶液的说法中不正确的是( )
A.?硝酸铵溶于水,使溶液温度降低??
B.?外界条件不改变,溶质不会从溶液中分离出来
C.?氯化钾饱和溶液中可以溶解少量硫酸铜晶体
D.?食用油加入含有洗洁精的水中,振荡后,可形成溶液
2、餐桌上的饮品种类丰富,下列饮品中属于溶液的是( )
A.酸奶 B.玉米糊 C.冰水 D.可乐
3、喝了汽水以后常常会打嗝。下列图示能正确解释这一现象的是( )
A. B.
C. D.
4、20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是??? (?????? )
②中所得溶液是饱和溶液
B.?③④溶液的溶质质量分数相等
C.?20℃时10g水最多能溶解4g NaCl?
?D.?①所得溶液的溶质质量分数为20%
5、将50g 20%的氯化钾溶液稀释到5%,需要加水的质量为( )
A.50g B.100g C.150g D.200g
6、下列关于溶液的说法正确的是( )
A.能溶解其他物质的物质叫做溶剂
B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的
D.饱和溶液一定是浓溶液
7、进行如下实验:①在室温下,向盛有20 mL水的烧杯中,加入5 g氯化钠,搅拌,氯化钠全部溶解;②再取5 g氯化钠,先从中取出少量放入烧杯中,搅拌,氯化钠全部溶解;③将剩余氯化钠全部倒入烧杯中,搅拌,发现烧杯中溶液底部有未溶解的固体;④继续向该烧杯中加入15 mL水,烧杯中形成无色溶液。据此判断下列说法错误的是 ( )
A.一定温度下,一定量水中不能无限制地溶解氯化钠
B.实验①中得到的是氯化钠的不饱和溶液
C.实验③中得到的是氯化钠的饱和溶液
D.实验④中继续向该烧杯中加入15 mL水,未溶解的固体不会减少
8、20 ℃时,在100 g水中最多能溶解5 g某物质,则该物质的溶解性属于( )
A.易溶 B.可溶
C.微溶 D.难溶
9、下列有关溶液的说法正确的是(?? )
A.?不饱和溶液转化为饱和溶液溶质的质量分数一定变大
B.?同种溶质的饱和溶液一定比它的不饱和溶液溶质的质量分数大
C.?饱和溶液转化为不饱和溶液溶液的质量一定增大
D.?饱和溶液恒温蒸发部分溶剂后溶质的质量分数一定不变
10、某同学在实验室配制50g 6%的氯化钠溶液,如图所示为部分操作,其中错误的是( )
11、溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
用硫酸铜进行如图所示的实验,观察后完成下列填空(用编号表示)
(1)硫酸铜的溶解度随温度升高_____(填“变大”或“不变”或“变小”)。
(2)所得三个溶液中:一定属于饱和溶液的是_____,溶液中溶质质量的大小关系是_____。
12、右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
13、一瓶体积为250mL,质量为250g的葡萄糖注射液中含葡萄糖12.5克,则该葡萄糖注射液的密度为________克/厘米3 , 葡萄糖的质量分数为________.
14、用托盘天平称取NaCl时,首先要调节__ __,然后两盘分别放一张大小相同的纸,称量时,左盘放__ __,右盘放__ __。
15、t2℃时,将甲、乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一,甲和乙的溶解度曲线如图二。请结合图示回答下列问题:
(1)固体甲对应的溶解度曲线是_______(填“a”或“b”)。
(2)M点的含义_____________________。
(3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体析出,你认为“全部溶解”的原因是________________________。
(4)将t2℃等质量的甲、乙饱和溶液分别降温到t1℃时,所得溶液的有关说法正确的是______(填字母)。
a. 甲溶液仍为饱和溶液 b. 两溶液质量甲<乙
c. 两溶液中溶剂质量甲=乙 d. 两溶液溶质质量分数甲>乙
16、为预防“禽流感”,某蛋鸡厂每周对鸡舍用5%的二氯异氰脲酸钠溶液喷洒消毒一次。现需要配制溶质质量分数为5%的二氯异氰脲酸钠消毒液1500g,需要二氯异氰脲酸钠粉末________g,加水________mL。
17、(实验探究题)研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
2020--2021人教化学九下第九单元 溶液同步题含答案
第九单元 溶液*
1、下列有关溶液的说法中不正确的是( )
A.?硝酸铵溶于水,使溶液温度降低??
B.?外界条件不改变,溶质不会从溶液中分离出来
C.?氯化钾饱和溶液中可以溶解少量硫酸铜晶体
D.?食用油加入含有洗洁精的水中,振荡后,可形成溶液
【答案】D
2、餐桌上的饮品种类丰富,下列饮品中属于溶液的是( )
A.酸奶 B.玉米糊 C.冰水 D.可乐
【答案】D
3、喝了汽水以后常常会打嗝。下列图示能正确解释这一现象的是( )
A. B.
C. D.
【答案】B。
4、20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是??? (?????? )
A.?②中所得溶液是饱和溶液???????????????????????????B.?③④溶液的溶质质量分数相等
C.?20℃时10g水最多能溶解4g NaCl????????????D.?①所得溶液的溶质质量分数为20%
【答案】 B
5、将50g 20%的氯化钾溶液稀释到5%,需要加水的质量为( )
A.50g B.100g C.150g D.200g
【答案】C
6、下列关于溶液的说法正确的是( )
A.能溶解其他物质的物质叫做溶剂
B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的
D.饱和溶液一定是浓溶液
【答案】A
7、进行如下实验:①在室温下,向盛有20 mL水的烧杯中,加入5 g氯化钠,搅拌,氯化钠全部溶解;②再取5 g氯化钠,先从中取出少量放入烧杯中,搅拌,氯化钠全部溶解;③将剩余氯化钠全部倒入烧杯中,搅拌,发现烧杯中溶液底部有未溶解的固体;④继续向该烧杯中加入15 mL水,烧杯中形成无色溶液。据此判断下列说法错误的是 ( )
A.一定温度下,一定量水中不能无限制地溶解氯化钠
B.实验①中得到的是氯化钠的不饱和溶液
C.实验③中得到的是氯化钠的饱和溶液
D.实验④中继续向该烧杯中加入15 mL水,未溶解的固体不会减少
【答案】D
8、20 ℃时,在100 g水中最多能溶解5 g某物质,则该物质的溶解性属于( )
A.易溶 B.可溶
C.微溶 D.难溶
【答案】B
9、下列有关溶液的说法正确的是(?? )
A.?不饱和溶液转化为饱和溶液溶质的质量分数一定变大
B.?同种溶质的饱和溶液一定比它的不饱和溶液溶质的质量分数大
C.?饱和溶液转化为不饱和溶液溶液的质量一定增大
D.?饱和溶液恒温蒸发部分溶剂后溶质的质量分数一定不变
【答案】D
10、某同学在实验室配制50g 6%的氯化钠溶液,如图所示为部分操作,其中错误的是( )
【答案】C
11、溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
用硫酸铜进行如图所示的实验,观察后完成下列填空(用编号表示)
(1)硫酸铜的溶解度随温度升高_____(填“变大”或“不变”或“变小”)。
(2)所得三个溶液中:一定属于饱和溶液的是_____,溶液中溶质质量的大小关系是_____。
【答案】变大 A B=C>A
12、右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
【答案】(1)20℃时,曱乙两种物质的溶解度相等(2)饱和
(3)蒸发结晶(4)丙
13、一瓶体积为250mL,质量为250g的葡萄糖注射液中含葡萄糖12.5克,则该葡萄糖注射液的密度为________克/厘米3 , 葡萄糖的质量分数为________.
【答案】1;5%
14、用托盘天平称取NaCl时,首先要调节__ __,然后两盘分别放一张大小相同的纸,称量时,左盘放__ __,右盘放__ __。
【答案】天平平衡 NaCl 砝码
15、t2℃时,将甲、乙各80g分别放到盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一,甲和乙的溶解度曲线如图二。请结合图示回答下列问题:
(1)固体甲对应的溶解度曲线是_______(填“a”或“b”)。
(2)M点的含义_____________________。
(3)向烧杯①的溶液中继续加入15g甲物质,充分搅拌,发现固体先全部溶解,一段时间后又有部分固体析出,你认为“全部溶解”的原因是________________________。
(4)将t2℃等质量的甲、乙饱和溶液分别降温到t1℃时,所得溶液的有关说法正确的是______(填字母)。
a. 甲溶液仍为饱和溶液 b. 两溶液质量甲<乙
c. 两溶液中溶剂质量甲=乙 d. 两溶液溶质质量分数甲>乙
【答案】(1)a;(2)t1℃时,甲乙两物质的溶解度相等;
(3)甲物质溶解时放热,溶液温度升高,溶解度增大 (4)abd
16、为预防“禽流感”,某蛋鸡厂每周对鸡舍用5%的二氯异氰脲酸钠溶液喷洒消毒一次。现需要配制溶质质量分数为5%的二氯异氰脲酸钠消毒液1500g,需要二氯异氰脲酸钠粉末________g,加水________mL。
【答案】 75;1425
17、(实验探究题)研究“水”可从其组成、结构、性质及用途等角度展开。
①水的组成
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为_____,检验b中气体的现象是_____;
II.微观分析:该反应中发生分解的微粒名称是___________;
III.符号表达:电解水的化学方程式为___________________。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成_______(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是___________。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
II.下列实验中,对水的作用分析有错误的是_________(填字母)
A.烧杯中的水便于观察烧瓶内气压变化 B.提供热量
C.排尽空气且便于观察H2何时集满 D.防止熔融物炸裂集气瓶
【答案】2:1 打开活塞,带火星的木条靠近管口,木条复燃 水分子 2H2O2H2↑+ O2↑ 悬浊液 水的比热容大 加快化学反应速率 B
同课章节目录
