2020-2021学年初中化学鲁教版九年级上册第一单元步入化学殿堂同步练习
文档属性
| 名称 | 2020-2021学年初中化学鲁教版九年级上册第一单元步入化学殿堂同步练习 |

|
|
| 格式 | docx | ||
| 文件大小 | 75.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-02-28 00:00:00 | ||
图片预览




文档简介
初中化学鲁教版九年级上册第一单元步入化学殿堂同步练习
一、单选题
1.下列变化中属于物理变化的是(
)
A.菜刀生锈
B.食品发霉
C.蜡烛熔化
D.石油制成布料
2.某同学取8
mL水并加热,提供的仪器有:①10
mL量筒;②100
mL量筒;③酒精灯;④容积20
mL的试管;⑤容积30
mL的试管;⑥试管夹,所选用仪器组合正确的一组是( )
A.②③④⑥
B.①③⑤⑥
C.①③④⑥
D.①②③④
3.下
列对科学家在化学上的贡献叙述错误的是()
A.拉瓦锡发现空气的主要成分
B.卢瑟福发现电子
C.道尔顿建立了原子学说
D.张青莲主持测定了几种元素相对原子质量的新值
4.中华文化博大精深,下列成语中一定包含化学变化的是( )
A.木已成舟
B.水果榨果汁
C.风吹草动
D.钻木取火
5.春节将至,下列春节习俗中蕴含化学变化的是
A.贴春联
B.发红包
C.扭秧歌
D.放鞭炮
6.“嫦娥四号”卫星成功登月,开启人类首次在月球背面软着陆探测之旅下列关于“嫦娥四号”卫星所担负的任务属于化学研究范畴的是
A.开展月球地质特征调查
B.深空测控通信与遥控技术
C.月球背面着陆
D.月球表面矿物的组成和化学成分探测
7.下列仪器中,能直接在酒精灯火焰上加热的是( )
①试管
②烧杯
③试剂瓶
④蒸发皿
⑤锥形瓶
⑥燃烧匙
⑦量筒
A.①②⑥
B.③④⑦
C.①④⑥
D.②③⑤
8.关于蜡烛在空气中燃烧,下列叙述不正确的是
A.有氧气参加的反应
B.只发生化学变化
C.既发生物理变化又发生化学变化
D.生成两种新物质
9.某同学欲量取一定体积的液体,量筒放平稳,先俯视读数为15ml,倾倒部分体积之后再仰视读数为6ml,则实际倒出水的体积( )
A.大于9ml
B.等于9ml
C.小于9ml
D.无法判断
10.下列仪器,能够用来加热大量液体的是(
)
A.试管
B.量筒
C.烧杯
D.广口瓶
11.要准确量取95mL液体,选用的量筒规格最好是(
)
A.10mL
B.50mL
C.100mL
D.200mL
12.酒精灯火焰温度最高的部位是(
)
A.焰心
B.内焰
C.外焰
D.一样高
13.我国古代的悠久历史和灿烂文化是举世瞩目的,以下的技术成就中与化学无关的是(
)
A.烧制陶瓷
B.发明指南针
C.使用火药
D.冶炼钢铁
14.奠定近代化学基础的是(
)
A.火的发现和利用
B.原子论和分子学说的创立
C.门捷列夫元素周期律的发现
D.发现和合成的物质超过3000万种以上
15.一位同学需要用已调节平衡的托盘天平称量12.5g药品,在称量中他发现天平指针稍微向右偏移,这时,他应该进行的操作是
A.移动游码
B.用药匙取出少量药品
C.添加砝码
D.用药匙添加少量药品
二、填空题
16.道尔顿和阿伏加德罗提出的原子和分子学说,奠定了近代化学的基础,其主要内容是:物质是由_____和____________构成的,分子中原子的重新组合是化学变化的基础;1869年,俄国化学家___________发现了元素周期律和元素周期表。
17.酒精灯火焰分为_____、_____、_____三个部分,其中_____温度最高,应用_____加热.
18.现有如下仪器:a.量筒;b.蒸发皿;c.药匙;d.胶头滴管.请回答(填序号):
(1)用于给液体加热的是_____;
(2)用于吸取和滴加少量液体的是_____.
19.某同学在做完加热液体的试验后,发现试管破裂了,请分析原因
____________、__________、__________(三条即可)
20.吸取和滴加少量的液体用________________;量取一定体积的液体所有仪器是________;对试管内的液体进行加热是液体量不超过试管容积的
____________;取用块状固体的用具是___________;用来收集气体的仪器是________________。
三、综合应用题
21.化学兴趣小组的同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生,是不是拿错了药品?经检验确认没有拿错药品,而是氢氧化钠溶液变质了。
【分析】氢氧化钠变质的原因是_______________________________________(用化学方程式表示)。
【提出问题1】该氢氧化钠溶液是全部变质还是部分变质?
【查阅资料】①已知反应:BaCl2+Na2CO3==2NaCl+BaCO3↓(白色)
②氯化钡溶液呈中性。
【设计实验】依据查阅的资料设计实验步骤,并进行实验,根据实验现象推断相应实验结论。
实验步骤
实验现象
实验结论
(1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡。
有白色沉淀产生。
?
说明原溶液中一定含有
_____________。
(2)取(1)试管中的上层清液滴加酚酞试液。
溶液变红色。
则溶液中一定含有__________。
【实验结论】同学得出的结论是:氢氧化钠溶液_______________变质(填“部分”或“全部”)。
【进一步实验】该小组同学用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验。请你帮助他们解决下列问题:
(1)除去氢氧化钠溶液中存在的上述杂质可加入适量的______________________。
(2)借助于_____________________可判断盐酸和氢氧化钠溶液恰好完全反应。
[提出问题2]该溶液的变质程度如何呢?
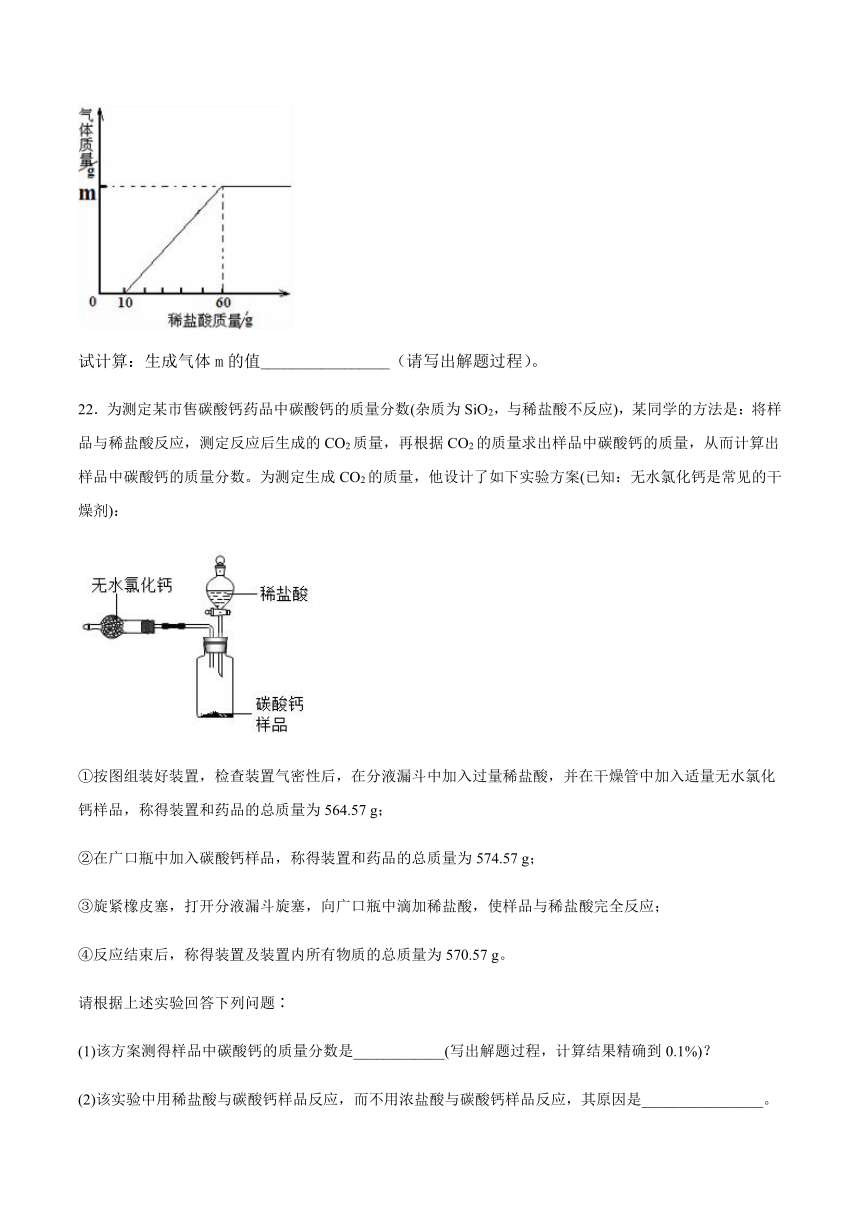
实验步骤:取该溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,所加盐酸质量与产生气体质量关系如图:
试计算:生成气体m的值_________________(请写出解题过程)。
22.为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数。为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
①按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57
g;
②在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57
g;
③旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
④反应结束后,称得装置及装置内所有物质的总质量为570.57
g。
请根据上述实验回答下列问题∶
(1)该方案测得样品中碳酸钙的质量分数是____________(写出解题过程,计算结果精确到0.1%)?
(2)该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是________________。若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比__________(选填“偏小”或“不变”或“偏大”)。
23.实验室有一瓶长期露置于空气中的氢氧化钠溶液,确认已变质.某学习小组展开如下探究,确定该溶液的成分,并进一步从变质的溶液中回收氢氧化钠.
(问题1)久置的氢氧化钠溶液是全部变质?还是部分变质?
(探究1)确定该溶液中溶质的成分.
实验操作
实验现象
实验结论
(1)取少量溶液于试管中,向溶液中滴加过量__________
溶液,并不断振荡.方程式为______________________。
白色沉淀产生
该溶液部分变质,含有
碳酸钠和氢氧化钠.
(2)将步骤(1)反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液.
__________
(反思)氢氧化钠溶液变质的原因___________________(用化学方程式表示),因此氢氧化钠溶液必须密封保存.
(问题2)如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体.
(探究2)回收纯净的氢氧化钠固体.(已知:氢氧化钠溶解度随温度升高增大明显)
请回答下列问题:
(3)试剂X是________________,反应的方程式___________________________________。
(4)系列操作z中步骤②的名称是________________,它与操作y是相同的。
(5)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,请说明本质的不同是什么
_____________________________________.
参考答案
1.C2.B3.B4.D5.D6.D7.C8.B9.C10.C11.C12.C13.B14.B15.D
16.分子
原子
门捷列夫
17.外焰
内焰
焰心
外焰
外焰
18.b
d
19.加热前,试管外壁有水渍
一开始加热时,没有均匀加热
加热过程中,试管始终触及灯芯
20.胶头滴管
量筒和胶头滴管
三分之一
镊子
集气瓶
21.
2NaOH+CO2=Na2CO3+H2O
Na2CO3
NaOH
部分
Ca(OH)2或Ba(OH)2
酚酞溶液
解:
与Na2CO3反应消耗盐酸溶质质量为
(60g-10g)×7.3%=3.65g
设生成二氧化碳的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73
44
3.65g
x
=
X=2.2g
答:生成二氧化碳的质量为2.2g
22.样品的质量为574.57
g-564.57
g=10
g,生成二氧化碳的质量为574.57
g-570.57
g=4
g。
设参加反应的碳酸钙的质量为x,
CaCO3+2HClCaCl2+H2O+CO2↑
100
44
x
4
g
x=9.09
g
所以碳酸钙样品中碳酸钙的质量分数为×100%=90.9%
浓盐酸具有挥发性,会带来测量误差
偏大
氯化钙(CaCl2)
CaCl2+
Na2
CO3
==
Ca
CO3↓
+
2
NaCl
变红
2NaOH+
CO2
==
Na2
CO3
+
H2O
石灰水(或
Ca(OH)2
)
Ca(OH)2
+
Na2
CO3
==
Ca
CO3↓
+
2NaOH
过滤
前者是检验并除去碳酸钠,以免干扰氢氧化钠的检验,后者是除杂碳酸钠,使反应生成氢氧化钠
一、单选题
1.下列变化中属于物理变化的是(
)
A.菜刀生锈
B.食品发霉
C.蜡烛熔化
D.石油制成布料
2.某同学取8
mL水并加热,提供的仪器有:①10
mL量筒;②100
mL量筒;③酒精灯;④容积20
mL的试管;⑤容积30
mL的试管;⑥试管夹,所选用仪器组合正确的一组是( )
A.②③④⑥
B.①③⑤⑥
C.①③④⑥
D.①②③④
3.下
列对科学家在化学上的贡献叙述错误的是()
A.拉瓦锡发现空气的主要成分
B.卢瑟福发现电子
C.道尔顿建立了原子学说
D.张青莲主持测定了几种元素相对原子质量的新值
4.中华文化博大精深,下列成语中一定包含化学变化的是( )
A.木已成舟
B.水果榨果汁
C.风吹草动
D.钻木取火
5.春节将至,下列春节习俗中蕴含化学变化的是
A.贴春联
B.发红包
C.扭秧歌
D.放鞭炮
6.“嫦娥四号”卫星成功登月,开启人类首次在月球背面软着陆探测之旅下列关于“嫦娥四号”卫星所担负的任务属于化学研究范畴的是
A.开展月球地质特征调查
B.深空测控通信与遥控技术
C.月球背面着陆
D.月球表面矿物的组成和化学成分探测
7.下列仪器中,能直接在酒精灯火焰上加热的是( )
①试管
②烧杯
③试剂瓶
④蒸发皿
⑤锥形瓶
⑥燃烧匙
⑦量筒
A.①②⑥
B.③④⑦
C.①④⑥
D.②③⑤
8.关于蜡烛在空气中燃烧,下列叙述不正确的是
A.有氧气参加的反应
B.只发生化学变化
C.既发生物理变化又发生化学变化
D.生成两种新物质
9.某同学欲量取一定体积的液体,量筒放平稳,先俯视读数为15ml,倾倒部分体积之后再仰视读数为6ml,则实际倒出水的体积( )
A.大于9ml
B.等于9ml
C.小于9ml
D.无法判断
10.下列仪器,能够用来加热大量液体的是(
)
A.试管
B.量筒
C.烧杯
D.广口瓶
11.要准确量取95mL液体,选用的量筒规格最好是(
)
A.10mL
B.50mL
C.100mL
D.200mL
12.酒精灯火焰温度最高的部位是(
)
A.焰心
B.内焰
C.外焰
D.一样高
13.我国古代的悠久历史和灿烂文化是举世瞩目的,以下的技术成就中与化学无关的是(
)
A.烧制陶瓷
B.发明指南针
C.使用火药
D.冶炼钢铁
14.奠定近代化学基础的是(
)
A.火的发现和利用
B.原子论和分子学说的创立
C.门捷列夫元素周期律的发现
D.发现和合成的物质超过3000万种以上
15.一位同学需要用已调节平衡的托盘天平称量12.5g药品,在称量中他发现天平指针稍微向右偏移,这时,他应该进行的操作是
A.移动游码
B.用药匙取出少量药品
C.添加砝码
D.用药匙添加少量药品
二、填空题
16.道尔顿和阿伏加德罗提出的原子和分子学说,奠定了近代化学的基础,其主要内容是:物质是由_____和____________构成的,分子中原子的重新组合是化学变化的基础;1869年,俄国化学家___________发现了元素周期律和元素周期表。
17.酒精灯火焰分为_____、_____、_____三个部分,其中_____温度最高,应用_____加热.
18.现有如下仪器:a.量筒;b.蒸发皿;c.药匙;d.胶头滴管.请回答(填序号):
(1)用于给液体加热的是_____;
(2)用于吸取和滴加少量液体的是_____.
19.某同学在做完加热液体的试验后,发现试管破裂了,请分析原因
____________、__________、__________(三条即可)
20.吸取和滴加少量的液体用________________;量取一定体积的液体所有仪器是________;对试管内的液体进行加热是液体量不超过试管容积的
____________;取用块状固体的用具是___________;用来收集气体的仪器是________________。
三、综合应用题
21.化学兴趣小组的同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生,是不是拿错了药品?经检验确认没有拿错药品,而是氢氧化钠溶液变质了。
【分析】氢氧化钠变质的原因是_______________________________________(用化学方程式表示)。
【提出问题1】该氢氧化钠溶液是全部变质还是部分变质?
【查阅资料】①已知反应:BaCl2+Na2CO3==2NaCl+BaCO3↓(白色)
②氯化钡溶液呈中性。
【设计实验】依据查阅的资料设计实验步骤,并进行实验,根据实验现象推断相应实验结论。
实验步骤
实验现象
实验结论
(1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡。
有白色沉淀产生。
?
说明原溶液中一定含有
_____________。
(2)取(1)试管中的上层清液滴加酚酞试液。
溶液变红色。
则溶液中一定含有__________。
【实验结论】同学得出的结论是:氢氧化钠溶液_______________变质(填“部分”或“全部”)。
【进一步实验】该小组同学用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验。请你帮助他们解决下列问题:
(1)除去氢氧化钠溶液中存在的上述杂质可加入适量的______________________。
(2)借助于_____________________可判断盐酸和氢氧化钠溶液恰好完全反应。
[提出问题2]该溶液的变质程度如何呢?
实验步骤:取该溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,所加盐酸质量与产生气体质量关系如图:
试计算:生成气体m的值_________________(请写出解题过程)。
22.为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数。为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
①按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57
g;
②在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57
g;
③旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
④反应结束后,称得装置及装置内所有物质的总质量为570.57
g。
请根据上述实验回答下列问题∶
(1)该方案测得样品中碳酸钙的质量分数是____________(写出解题过程,计算结果精确到0.1%)?
(2)该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是________________。若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比__________(选填“偏小”或“不变”或“偏大”)。
23.实验室有一瓶长期露置于空气中的氢氧化钠溶液,确认已变质.某学习小组展开如下探究,确定该溶液的成分,并进一步从变质的溶液中回收氢氧化钠.
(问题1)久置的氢氧化钠溶液是全部变质?还是部分变质?
(探究1)确定该溶液中溶质的成分.
实验操作
实验现象
实验结论
(1)取少量溶液于试管中,向溶液中滴加过量__________
溶液,并不断振荡.方程式为______________________。
白色沉淀产生
该溶液部分变质,含有
碳酸钠和氢氧化钠.
(2)将步骤(1)反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液.
__________
(反思)氢氧化钠溶液变质的原因___________________(用化学方程式表示),因此氢氧化钠溶液必须密封保存.
(问题2)如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体.
(探究2)回收纯净的氢氧化钠固体.(已知:氢氧化钠溶解度随温度升高增大明显)
请回答下列问题:
(3)试剂X是________________,反应的方程式___________________________________。
(4)系列操作z中步骤②的名称是________________,它与操作y是相同的。
(5)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,请说明本质的不同是什么
_____________________________________.
参考答案
1.C2.B3.B4.D5.D6.D7.C8.B9.C10.C11.C12.C13.B14.B15.D
16.分子
原子
门捷列夫
17.外焰
内焰
焰心
外焰
外焰
18.b
d
19.加热前,试管外壁有水渍
一开始加热时,没有均匀加热
加热过程中,试管始终触及灯芯
20.胶头滴管
量筒和胶头滴管
三分之一
镊子
集气瓶
21.
2NaOH+CO2=Na2CO3+H2O
Na2CO3
NaOH
部分
Ca(OH)2或Ba(OH)2
酚酞溶液
解:
与Na2CO3反应消耗盐酸溶质质量为
(60g-10g)×7.3%=3.65g
设生成二氧化碳的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73
44
3.65g
x
=
X=2.2g
答:生成二氧化碳的质量为2.2g
22.样品的质量为574.57
g-564.57
g=10
g,生成二氧化碳的质量为574.57
g-570.57
g=4
g。
设参加反应的碳酸钙的质量为x,
CaCO3+2HClCaCl2+H2O+CO2↑
100
44
x
4
g
x=9.09
g
所以碳酸钙样品中碳酸钙的质量分数为×100%=90.9%
浓盐酸具有挥发性,会带来测量误差
偏大
氯化钙(CaCl2)
CaCl2+
Na2
CO3
==
Ca
CO3↓
+
2
NaCl
变红
2NaOH+
CO2
==
Na2
CO3
+
H2O
石灰水(或
Ca(OH)2
)
Ca(OH)2
+
Na2
CO3
==
Ca
CO3↓
+
2NaOH
过滤
前者是检验并除去碳酸钠,以免干扰氢氧化钠的检验,后者是除杂碳酸钠,使反应生成氢氧化钠
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
