1.4 配制溶液 —华东师大版七年级科学下册预习讲义(含答案)
文档属性
| 名称 | 1.4 配制溶液 —华东师大版七年级科学下册预习讲义(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 62.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-03-02 08:01:52 | ||
图片预览



文档简介
1.4配制溶液
一、学习目标
1.了解溶质的质量分数的定义
2.复的使用
3.了解配置溶液的几个步骤
4.学会配制溶液的一些简单的计算
二、知识点默写
我们可以根据
判断糖水的浓稀,可以根据
判断硫酸铜溶液的浓稀,但是都是比较粗略,不能准确地表明一定量溶液中究竟含有多少的
。
使用农药的时候,药液
会伤害农作物,药液
又不能有效杀虫除菌。
用固体溶液配制步骤:
、
、
。
溶质的质量分数:
与
之比。稀释前后,
的质量保持不变。
除了质量分数,用
也可以表示溶液组成,比如70体积的酒精和30体积的水配制成的溶液,酒精的体积分数就是
配制固定体积溶液时,当溶液即将到达目的容量,改用
滴加,保证精确。
例题解析
1、加减溶质、溶剂和溶液的数据计算
[例题1]今有60g溶质的质量分数为10%的食盐溶液,欲将其溶质的质量分数增大一倍,应采用的方法是(???
)
?把溶剂蒸发掉一半???????B.?加入6g食盐晶体????
???C.?把溶剂蒸发掉30g???????D.?加入20%的食盐溶液30g
[解析]根据蒸发溶剂溶质量不变,溶液质量减小,加入溶质,溶质质量和溶液质量都增加及溶质质量分数=溶质质量/溶液质量分析。
60g溶质的质量分数为10%的食盐溶液中溶质为6克,溶剂为54克;
A、
把溶剂蒸发掉一半
,所得溶质质量分数为60g×10%60g-27g×100%=18.2%
,
不符合题意;
B、加入
6g食盐晶体
,所得溶液溶质质量分数为6g+6g66g×100%=18.2%
,
不符合题意;
C、
把溶剂蒸发掉30g
,所得溶液溶质质量分数为6g60g-30g×100%=20%
,
符合题意;
D、
加入20%的食盐溶液30g
,所得溶液溶质质量分数为6g+30g×20%60g+30g×100%=13.3%
,
不符合题意;
[答案]
C
2、通过溶液是否饱和的过程分析与质量分数判断
[例题2]甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析正确的是(?
??)
A.?甲可能是不饱和溶液,丙和丁一定是饱和溶液?????????B.?丙的溶液质量和乙的相同
C.?在甲→丙的过程中,蔗糖的溶解度先增大后减小?????D.?乙的溶质质量分数比甲大
[解析](1)如果溶液中有晶体析出,那么肯定是饱和溶液;如果没有晶体,那么溶液可能饱和,也可能不饱和;
(2)注意丙中有晶体析出;
(3)物质的溶解度的大小与温度有关;
(4)根据公式溶质质量溶液质量×100%比较溶质质量分数的大小。
A.甲溶液恒温蒸发20g水后,仍然没有晶体析出,那么甲肯定是不饱和溶液;丙和丁中,由于已经出现未溶的晶体,所以是饱和溶液,故A错误;
B.丙和乙中溶剂的质量相同,但是丙中溶质的质量小,所以丙的溶液质量小于乙,故B错误;
C.在从甲→丙的过程中,溶液的温度先不变再降低,所以蔗糖的溶解度先不变后减小,故C错误;
D.在甲和乙中,溶质的质量相同,而溶剂的质量减小,根据公式溶质质量溶液质量×100%可知,乙的溶质质量分数比甲大,故D正确。
[答案]D
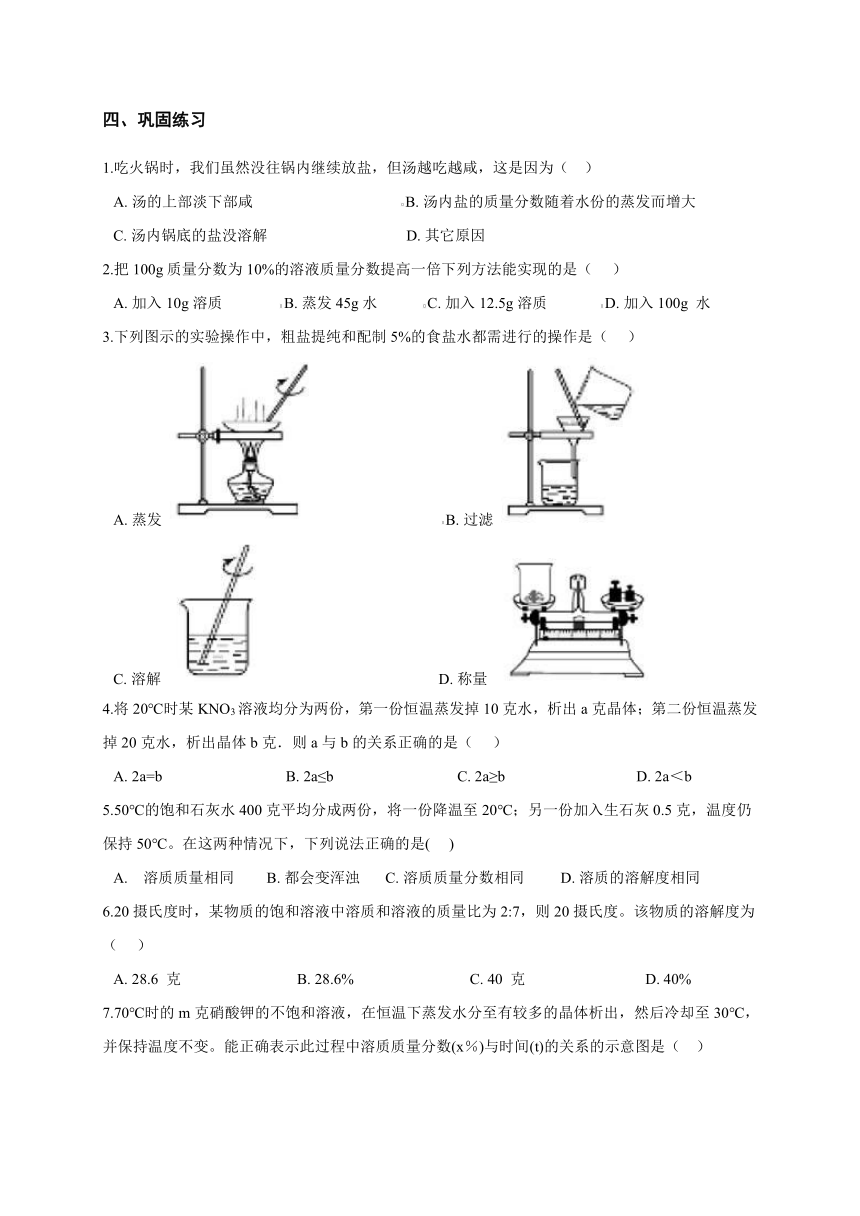
四、巩固练习
1.吃火锅时,我们虽然没往锅内继续放盐,但汤越吃越咸,这是因为(??
)
A.?汤的上部淡下部咸???????????????????????????????????????B.?汤内盐的质量分数随着水份的蒸发而增大
C.?汤内锅底的盐没溶解????????????????????????????????????D.?其它原因
2.把100g质量分数为10%的溶液质量分数提高一倍下列方法能实现的是(???
)
A.?加入10g溶质???????????????B.?蒸发45g水????????????C.?加入12.5g溶质??????????????D.?加入100g
水
3.下列图示的实验操作中,粗盐提纯和配制5%的食盐水都需进行的操作是(???
)
A.?蒸发
???????????????????????????????B.?过滤
C.?溶解
??????????????????????????????????????????D.?称量
4.将20℃时某KNO3溶液均分为两份,第一份恒温蒸发掉10克水,析出a克晶体;第二份恒温蒸发掉20克水,析出晶体b克.则a与b的关系正确的是(???
)
A.?2a=b????????????????????????????????B.?2a≤b????????????????????????????????C.?2a≥b??????????????????????????????????D.?2a<b
5.50℃的饱和石灰水400克平均分成两份,将一份降温至20℃;另一份加入生石灰0.5克,温度仍保持50℃。在这两种情况下,下列说法正确的是(???
)
A.??
溶质质量相同????????B.?都会变浑浊??????C.?溶质质量分数相同?????????D.?溶质的溶解度相同
6.20摄氏度时,某物质的饱和溶液中溶质和溶液的质量比为2:7,则20摄氏度。该物质的溶解度为(???
)
A.?28.6
克??????????????????????????????B.?28.6%??????????????????????????????C.?40
克???????????????????????????????D.?40%
7.70℃时的m克硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃,并保持温度不变。能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是(??
)
???????B.??????
?C.???????D.?
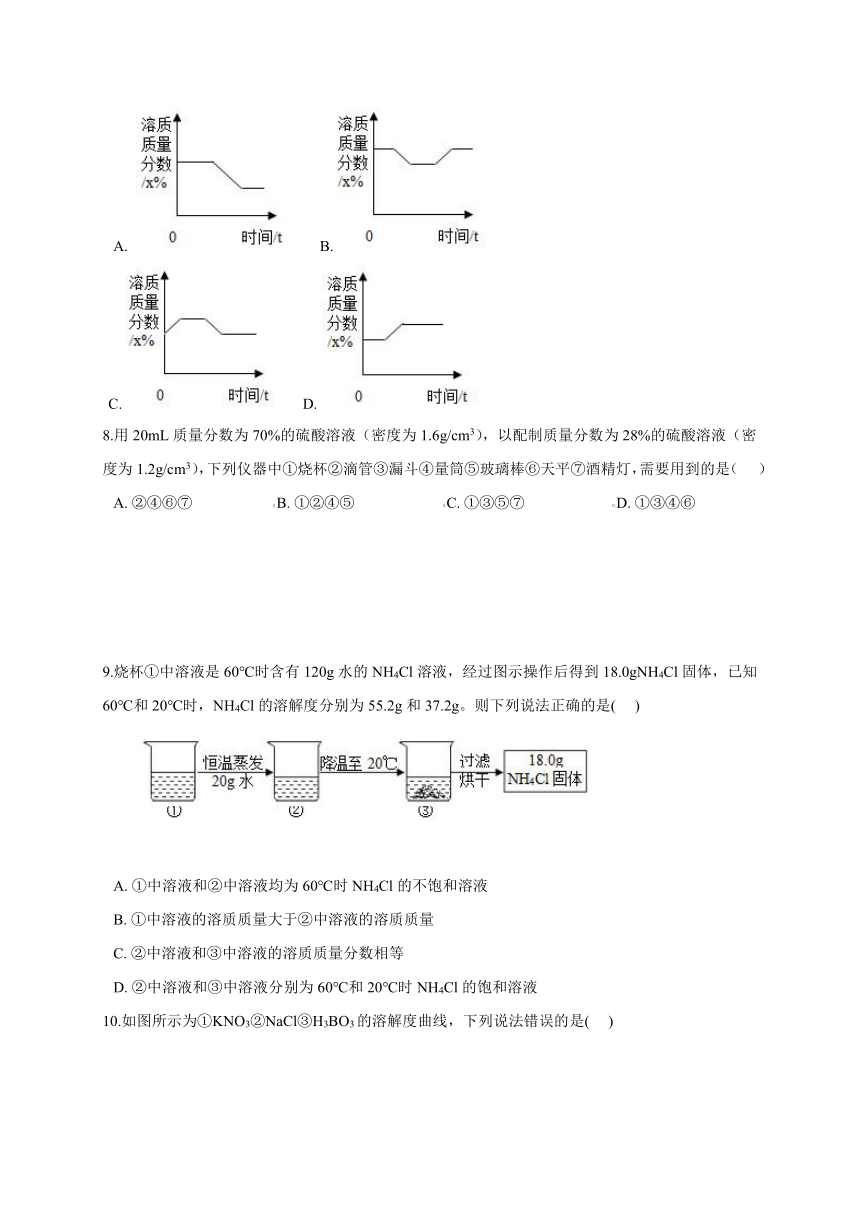
8.用20mL质量分数为70%的硫酸溶液(密度为1.6g/cm3),以配制质量分数为28%的硫酸溶液(密度为1.2g/cm3),下列仪器中①烧杯②滴管③漏斗④量筒⑤玻璃棒⑥天平⑦酒精灯,需要用到的是(
???)
A.?②④⑥⑦?????????????????????B.?①②④⑤???????????????????????C.?①③⑤⑦???????????????????????D.?①③④⑥
9.烧杯①中溶液是60℃时含有120g水的NH4Cl溶液,经过图示操作后得到18.0gNH4Cl固体,已知60℃和20℃时,NH4Cl的溶解度分别为55.2g和37.2g。则下列说法正确的是(???
)
?
A.?①中溶液和②中溶液均为60℃时NH4Cl的不饱和溶液
B.?①中溶液的溶质质量大于②中溶液的溶质质量
C.?②中溶液和③中溶液的溶质质量分数相等
D.?②中溶液和③中溶液分别为60℃和20℃时NH4Cl的饱和溶液
10.如图所示为①KNO3②NaCl③H3BO3的溶解度曲线,下列说法错误的是(???
)
A.?在10℃时,三种物质溶解度的大小顺序为②>①>③
B.?在t℃时,三种物质饱和溶液中溶质质量分数的大小顺序为①=②>③
C.?将P点处的KNO3溶液蒸发适量水可变成饱和溶液
D.?将P点处的KNO3溶液降温一定会析出KNO3晶体
答案
知识点默写
甜味
颜色
溶质
太浓
太稀
计算
称量
溶解
溶质质量
溶液质量
溶质
体积分数
70%
胶头滴管
巩固练习
1.
B
2.
C
3.
C
4.
B
5.
C
6.
C
7.
C
8.
B
9.
D
10.
D
巩固练习解析
1.
B
【解析】注意分析加热过程中水的质量变化对汤的溶质质量分数的影响,进而得到汤越来越咸的原因。吃火锅时,由于不断的加热,水越来越少,而其中溶质盐的质量保持不变,根据溶质质量分数=溶质质量溶液质量×100%可知,汤内盐的质量分数不断增大,故B正确,而A、C、D错误。
2.
C
【解析】根据溶质质量分数=溶质质量溶液质量×100%分析计算。
100g质量分数为10%的溶液中,溶质的质量为:100g×10%=10g;设加入溶质的质量为x,
那么:10g+x100g+x×100%=20%;
解得:x=12.5g,
故C正确,而A错误;
设蒸发水的质量为y,
10g100g-y×100%=20%;
解得:y=50g。
故B、C错误。
3.
C
【解析】(1)粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程。
(2)配制溶质的质量分数为5%
的食盐水过程如下:①计算
:配制此溶液需要氯化钠和水的量;②称量和量取:用托盘天平称取所需的氯化钠,放入烧杯中。用量筒量取所需的水;③溶解:将用量筒量取的水,倒入盛有氯化钠的烧杯里,用玻璃棒搅拌。待氯化钠完全溶解时,5%
的氯化钠溶液就配制好了。
粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程。配制5%的食盐水,首先计算配制溶液所需食盐和水的质量,再称量所需的食盐和量取水,最后进行溶解。故粗盐提纯和配制5%的食盐水都需进行的操作是溶解。
4.
B
【解析】当饱和溶液析出晶体时,析出晶体的质量与溶剂减少的质量正正比,据此分析判断。
根据“饱和溶液析出晶体质量与溶剂减少质量成正比”的规律可知,如果原来的硝酸钾溶液是饱和的,那么蒸发掉20g水析出的晶体质量肯定是10g水析出晶体的2倍,即2a=b;如果原来的硝酸钾溶液不是饱和的,那么当水蒸发时,开始不会析出晶体,当溶液达到饱和时才会析出晶体。因此第一次蒸发10g水析出的晶体质量a肯定小于溶液饱和后蒸发10g水析出的晶体质量c,即a5.
C
【解析】(1)氢氧化钙的溶解度随温度的升高而减小,随温度的降低而增大;
(2)当温度不变时,同种物质饱和溶液的溶质质量分数相同。
?50℃时将等质量的两份饱和石灰水?,其中一份冷却到20℃,由于氢氧化钙的溶解度增大,所以不会析出,即溶质和溶剂的质量保持不变,也就是溶质的质量分数不变;
另一份加入生石灰0.5g,生石灰与水反应生成氢氧化钙,由于溶剂减少,因此氢氧化钙会析出,从而导致溶质质量减小,溶液的质量也会减小。由于温度仍然保持50℃,而石灰水又是饱和溶液,所以溶质的质量分数保持不变。
A.前一份石灰水的溶质质量不变,后一份石灰水的溶质质量减小,故A错误;
B.前一份石灰水为不饱和溶液,没有氢氧化钙析出;而后一份则为饱和溶液,有氢氧化钙析出,会变浑浊,故B错误;
C.两份溶液的溶质质量分数相同,故C正确;
D.两份溶液的温度不变,因此溶质的溶解度不同,故D错误。
6.
C
【解析】根据溶质质量分数=溶质质量溶液质量×100%计算即可。
设该物质的溶解度为x,
那么:x100g+x=27;
解得:x=40g。
7.
C
【解析】(1)同种物质,温度不变时,饱和溶液的溶质质量分数肯定大于不饱和溶液;
(2)当物质的溶解度改变时,溶解度越大,饱和溶液的溶质质量分数越大,据此分析判断。
①70℃的硝酸钾的不饱和溶液,蒸发水分,先变成70℃的饱和溶液,在这段时间内,溶质质量分数不断增大;
②70℃的硝酸钾饱和溶液恒温蒸发水分时,它始终处于饱和状态;因为溶解度不变,所以溶质质量分数不变;
③硝酸钾的饱和溶液从70℃降低到30℃的过程中,溶解度不断减小,因此溶质质量分数不断减小;
④30℃的硝酸钾的饱和溶液温度不变,恒温蒸发,那么溶质质量分数保持不变。
故C正确,A、B、D错误。
8.
B
【解析】根据配置一定质量分数的溶液的实验步骤选择实验器材。
首先根据m=ρV计算出20ml70%硫酸溶液的质量,再根据溶液质量×溶质质量分数计算出其中溶质的质量。在稀释的过程中,硫酸溶液溶质的质量保持不变,接下来根据溶质质量÷溶质质量分数计算出28%硫酸溶液的质量,前后两个溶液质量的差就是需要加水的质量,最后根据V水=m水ρ水计算出需要加水的体积即可。在实验过程中,需要烧杯盛放和稀释溶液,需要量筒和滴管测量液体的体积,在溶解的过程中需要玻璃棒搅拌,因此需要用到的器材是①②④⑤。
9.
D
【解析】③溶液中由于出现了氯化铵晶体,所以③肯定为20℃时的饱和溶液,计算出此时水的质量,根据溶解度计算出此时溶液中溶质的质量,再加上烘干后得到氯化铵的质量,就是实验最初溶液中氯化铵的质量;
(1)确定溶液②中溶剂水的质量和氯化铵的质量,与60℃氯化铵的溶解度比较,判断是否饱和;再判断①是否饱和即可;
(2)①和②中都没有氯化铵晶体析出;
(3)如果温度相同,那么同种物质的饱和溶液的质量分数相同;
(4)根据前面的分析判断即可。
③溶液中由于出现了氯化铵晶体,所以③肯定为20℃时的饱和溶液,此时氯化铵的溶解度为37.2g。③中水的质量为:120g-20g=100g,因此③中氯化铵的质量为37.2g。由于最后烘干后得到氯化铵固体18g,那么最初溶液中氯化铵的质量为:37.2g+18g=55.2g。
②溶液的温度为60℃,此时氯化铵的溶解度为55.2g;②中水的质量为100g,氯化铵的质量为55.2g,那么虽然没有晶体出现,但②为20℃的饱和溶液。在溶液①中,温度为60℃,水的质量为120g,氯化铵的质量为55.2g,肯定是不饱和溶液,故A错误,而D正确;
①和②溶液中的溶质都没有析出,因此溶质质量相同,故B错误;
②和③都是饱和溶液,但是温度不同,所以溶质的质量分数不同,故C错误。
10.
D
【解析】(1)根据图像确定10℃时三种物质溶解度的大小关系;
(2)物质的溶解度越大,那么在这个温度下它的饱和溶液溶质的质量分数越大;
(3)不饱和溶液变为饱和溶液的方法:增加溶质,蒸发溶剂或改变温度;
(4)当溶质的质量大于该种物质的溶解度时,才可能会有晶体析出。
A.在10℃时,三种物质溶解度的大小顺序依次为②>①>③,故A正确不合题意;
B.在t℃时,三种物质溶解度的大小顺序依次为①=②>③,因此它们饱和溶液中溶质质量分数的大小顺序为①=②>③,故B正确不合题意;
C.P点在硝酸钾溶解度图像的下方,说明这时溶液不饱和,只要蒸发适量水,减小溶剂的质量,肯定能够达到饱和,故C正确不合题意;
D.硝酸钾溶液降温,它的溶解度肯定会减小,但是如果温度下降的不够,那么可能溶液没有达到饱和,故D错误符合题意。
一、学习目标
1.了解溶质的质量分数的定义
2.复的使用
3.了解配置溶液的几个步骤
4.学会配制溶液的一些简单的计算
二、知识点默写
我们可以根据
判断糖水的浓稀,可以根据
判断硫酸铜溶液的浓稀,但是都是比较粗略,不能准确地表明一定量溶液中究竟含有多少的
。
使用农药的时候,药液
会伤害农作物,药液
又不能有效杀虫除菌。
用固体溶液配制步骤:
、
、
。
溶质的质量分数:
与
之比。稀释前后,
的质量保持不变。
除了质量分数,用
也可以表示溶液组成,比如70体积的酒精和30体积的水配制成的溶液,酒精的体积分数就是
配制固定体积溶液时,当溶液即将到达目的容量,改用
滴加,保证精确。
例题解析
1、加减溶质、溶剂和溶液的数据计算
[例题1]今有60g溶质的质量分数为10%的食盐溶液,欲将其溶质的质量分数增大一倍,应采用的方法是(???
)
?把溶剂蒸发掉一半???????B.?加入6g食盐晶体????
???C.?把溶剂蒸发掉30g???????D.?加入20%的食盐溶液30g
[解析]根据蒸发溶剂溶质量不变,溶液质量减小,加入溶质,溶质质量和溶液质量都增加及溶质质量分数=溶质质量/溶液质量分析。
60g溶质的质量分数为10%的食盐溶液中溶质为6克,溶剂为54克;
A、
把溶剂蒸发掉一半
,所得溶质质量分数为60g×10%60g-27g×100%=18.2%
,
不符合题意;
B、加入
6g食盐晶体
,所得溶液溶质质量分数为6g+6g66g×100%=18.2%
,
不符合题意;
C、
把溶剂蒸发掉30g
,所得溶液溶质质量分数为6g60g-30g×100%=20%
,
符合题意;
D、
加入20%的食盐溶液30g
,所得溶液溶质质量分数为6g+30g×20%60g+30g×100%=13.3%
,
不符合题意;
[答案]
C
2、通过溶液是否饱和的过程分析与质量分数判断
[例题2]甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析正确的是(?
??)
A.?甲可能是不饱和溶液,丙和丁一定是饱和溶液?????????B.?丙的溶液质量和乙的相同
C.?在甲→丙的过程中,蔗糖的溶解度先增大后减小?????D.?乙的溶质质量分数比甲大
[解析](1)如果溶液中有晶体析出,那么肯定是饱和溶液;如果没有晶体,那么溶液可能饱和,也可能不饱和;
(2)注意丙中有晶体析出;
(3)物质的溶解度的大小与温度有关;
(4)根据公式溶质质量溶液质量×100%比较溶质质量分数的大小。
A.甲溶液恒温蒸发20g水后,仍然没有晶体析出,那么甲肯定是不饱和溶液;丙和丁中,由于已经出现未溶的晶体,所以是饱和溶液,故A错误;
B.丙和乙中溶剂的质量相同,但是丙中溶质的质量小,所以丙的溶液质量小于乙,故B错误;
C.在从甲→丙的过程中,溶液的温度先不变再降低,所以蔗糖的溶解度先不变后减小,故C错误;
D.在甲和乙中,溶质的质量相同,而溶剂的质量减小,根据公式溶质质量溶液质量×100%可知,乙的溶质质量分数比甲大,故D正确。
[答案]D
四、巩固练习
1.吃火锅时,我们虽然没往锅内继续放盐,但汤越吃越咸,这是因为(??
)
A.?汤的上部淡下部咸???????????????????????????????????????B.?汤内盐的质量分数随着水份的蒸发而增大
C.?汤内锅底的盐没溶解????????????????????????????????????D.?其它原因
2.把100g质量分数为10%的溶液质量分数提高一倍下列方法能实现的是(???
)
A.?加入10g溶质???????????????B.?蒸发45g水????????????C.?加入12.5g溶质??????????????D.?加入100g
水
3.下列图示的实验操作中,粗盐提纯和配制5%的食盐水都需进行的操作是(???
)
A.?蒸发
???????????????????????????????B.?过滤
C.?溶解
??????????????????????????????????????????D.?称量
4.将20℃时某KNO3溶液均分为两份,第一份恒温蒸发掉10克水,析出a克晶体;第二份恒温蒸发掉20克水,析出晶体b克.则a与b的关系正确的是(???
)
A.?2a=b????????????????????????????????B.?2a≤b????????????????????????????????C.?2a≥b??????????????????????????????????D.?2a<b
5.50℃的饱和石灰水400克平均分成两份,将一份降温至20℃;另一份加入生石灰0.5克,温度仍保持50℃。在这两种情况下,下列说法正确的是(???
)
A.??
溶质质量相同????????B.?都会变浑浊??????C.?溶质质量分数相同?????????D.?溶质的溶解度相同
6.20摄氏度时,某物质的饱和溶液中溶质和溶液的质量比为2:7,则20摄氏度。该物质的溶解度为(???
)
A.?28.6
克??????????????????????????????B.?28.6%??????????????????????????????C.?40
克???????????????????????????????D.?40%
7.70℃时的m克硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃,并保持温度不变。能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是(??
)
???????B.??????
?C.???????D.?
8.用20mL质量分数为70%的硫酸溶液(密度为1.6g/cm3),以配制质量分数为28%的硫酸溶液(密度为1.2g/cm3),下列仪器中①烧杯②滴管③漏斗④量筒⑤玻璃棒⑥天平⑦酒精灯,需要用到的是(
???)
A.?②④⑥⑦?????????????????????B.?①②④⑤???????????????????????C.?①③⑤⑦???????????????????????D.?①③④⑥
9.烧杯①中溶液是60℃时含有120g水的NH4Cl溶液,经过图示操作后得到18.0gNH4Cl固体,已知60℃和20℃时,NH4Cl的溶解度分别为55.2g和37.2g。则下列说法正确的是(???
)
?
A.?①中溶液和②中溶液均为60℃时NH4Cl的不饱和溶液
B.?①中溶液的溶质质量大于②中溶液的溶质质量
C.?②中溶液和③中溶液的溶质质量分数相等
D.?②中溶液和③中溶液分别为60℃和20℃时NH4Cl的饱和溶液
10.如图所示为①KNO3②NaCl③H3BO3的溶解度曲线,下列说法错误的是(???
)
A.?在10℃时,三种物质溶解度的大小顺序为②>①>③
B.?在t℃时,三种物质饱和溶液中溶质质量分数的大小顺序为①=②>③
C.?将P点处的KNO3溶液蒸发适量水可变成饱和溶液
D.?将P点处的KNO3溶液降温一定会析出KNO3晶体
答案
知识点默写
甜味
颜色
溶质
太浓
太稀
计算
称量
溶解
溶质质量
溶液质量
溶质
体积分数
70%
胶头滴管
巩固练习
1.
B
2.
C
3.
C
4.
B
5.
C
6.
C
7.
C
8.
B
9.
D
10.
D
巩固练习解析
1.
B
【解析】注意分析加热过程中水的质量变化对汤的溶质质量分数的影响,进而得到汤越来越咸的原因。吃火锅时,由于不断的加热,水越来越少,而其中溶质盐的质量保持不变,根据溶质质量分数=溶质质量溶液质量×100%可知,汤内盐的质量分数不断增大,故B正确,而A、C、D错误。
2.
C
【解析】根据溶质质量分数=溶质质量溶液质量×100%分析计算。
100g质量分数为10%的溶液中,溶质的质量为:100g×10%=10g;设加入溶质的质量为x,
那么:10g+x100g+x×100%=20%;
解得:x=12.5g,
故C正确,而A错误;
设蒸发水的质量为y,
10g100g-y×100%=20%;
解得:y=50g。
故B、C错误。
3.
C
【解析】(1)粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程。
(2)配制溶质的质量分数为5%
的食盐水过程如下:①计算
:配制此溶液需要氯化钠和水的量;②称量和量取:用托盘天平称取所需的氯化钠,放入烧杯中。用量筒量取所需的水;③溶解:将用量筒量取的水,倒入盛有氯化钠的烧杯里,用玻璃棒搅拌。待氯化钠完全溶解时,5%
的氯化钠溶液就配制好了。
粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程。配制5%的食盐水,首先计算配制溶液所需食盐和水的质量,再称量所需的食盐和量取水,最后进行溶解。故粗盐提纯和配制5%的食盐水都需进行的操作是溶解。
4.
B
【解析】当饱和溶液析出晶体时,析出晶体的质量与溶剂减少的质量正正比,据此分析判断。
根据“饱和溶液析出晶体质量与溶剂减少质量成正比”的规律可知,如果原来的硝酸钾溶液是饱和的,那么蒸发掉20g水析出的晶体质量肯定是10g水析出晶体的2倍,即2a=b;如果原来的硝酸钾溶液不是饱和的,那么当水蒸发时,开始不会析出晶体,当溶液达到饱和时才会析出晶体。因此第一次蒸发10g水析出的晶体质量a肯定小于溶液饱和后蒸发10g水析出的晶体质量c,即a
C
【解析】(1)氢氧化钙的溶解度随温度的升高而减小,随温度的降低而增大;
(2)当温度不变时,同种物质饱和溶液的溶质质量分数相同。
?50℃时将等质量的两份饱和石灰水?,其中一份冷却到20℃,由于氢氧化钙的溶解度增大,所以不会析出,即溶质和溶剂的质量保持不变,也就是溶质的质量分数不变;
另一份加入生石灰0.5g,生石灰与水反应生成氢氧化钙,由于溶剂减少,因此氢氧化钙会析出,从而导致溶质质量减小,溶液的质量也会减小。由于温度仍然保持50℃,而石灰水又是饱和溶液,所以溶质的质量分数保持不变。
A.前一份石灰水的溶质质量不变,后一份石灰水的溶质质量减小,故A错误;
B.前一份石灰水为不饱和溶液,没有氢氧化钙析出;而后一份则为饱和溶液,有氢氧化钙析出,会变浑浊,故B错误;
C.两份溶液的溶质质量分数相同,故C正确;
D.两份溶液的温度不变,因此溶质的溶解度不同,故D错误。
6.
C
【解析】根据溶质质量分数=溶质质量溶液质量×100%计算即可。
设该物质的溶解度为x,
那么:x100g+x=27;
解得:x=40g。
7.
C
【解析】(1)同种物质,温度不变时,饱和溶液的溶质质量分数肯定大于不饱和溶液;
(2)当物质的溶解度改变时,溶解度越大,饱和溶液的溶质质量分数越大,据此分析判断。
①70℃的硝酸钾的不饱和溶液,蒸发水分,先变成70℃的饱和溶液,在这段时间内,溶质质量分数不断增大;
②70℃的硝酸钾饱和溶液恒温蒸发水分时,它始终处于饱和状态;因为溶解度不变,所以溶质质量分数不变;
③硝酸钾的饱和溶液从70℃降低到30℃的过程中,溶解度不断减小,因此溶质质量分数不断减小;
④30℃的硝酸钾的饱和溶液温度不变,恒温蒸发,那么溶质质量分数保持不变。
故C正确,A、B、D错误。
8.
B
【解析】根据配置一定质量分数的溶液的实验步骤选择实验器材。
首先根据m=ρV计算出20ml70%硫酸溶液的质量,再根据溶液质量×溶质质量分数计算出其中溶质的质量。在稀释的过程中,硫酸溶液溶质的质量保持不变,接下来根据溶质质量÷溶质质量分数计算出28%硫酸溶液的质量,前后两个溶液质量的差就是需要加水的质量,最后根据V水=m水ρ水计算出需要加水的体积即可。在实验过程中,需要烧杯盛放和稀释溶液,需要量筒和滴管测量液体的体积,在溶解的过程中需要玻璃棒搅拌,因此需要用到的器材是①②④⑤。
9.
D
【解析】③溶液中由于出现了氯化铵晶体,所以③肯定为20℃时的饱和溶液,计算出此时水的质量,根据溶解度计算出此时溶液中溶质的质量,再加上烘干后得到氯化铵的质量,就是实验最初溶液中氯化铵的质量;
(1)确定溶液②中溶剂水的质量和氯化铵的质量,与60℃氯化铵的溶解度比较,判断是否饱和;再判断①是否饱和即可;
(2)①和②中都没有氯化铵晶体析出;
(3)如果温度相同,那么同种物质的饱和溶液的质量分数相同;
(4)根据前面的分析判断即可。
③溶液中由于出现了氯化铵晶体,所以③肯定为20℃时的饱和溶液,此时氯化铵的溶解度为37.2g。③中水的质量为:120g-20g=100g,因此③中氯化铵的质量为37.2g。由于最后烘干后得到氯化铵固体18g,那么最初溶液中氯化铵的质量为:37.2g+18g=55.2g。
②溶液的温度为60℃,此时氯化铵的溶解度为55.2g;②中水的质量为100g,氯化铵的质量为55.2g,那么虽然没有晶体出现,但②为20℃的饱和溶液。在溶液①中,温度为60℃,水的质量为120g,氯化铵的质量为55.2g,肯定是不饱和溶液,故A错误,而D正确;
①和②溶液中的溶质都没有析出,因此溶质质量相同,故B错误;
②和③都是饱和溶液,但是温度不同,所以溶质的质量分数不同,故C错误。
10.
D
【解析】(1)根据图像确定10℃时三种物质溶解度的大小关系;
(2)物质的溶解度越大,那么在这个温度下它的饱和溶液溶质的质量分数越大;
(3)不饱和溶液变为饱和溶液的方法:增加溶质,蒸发溶剂或改变温度;
(4)当溶质的质量大于该种物质的溶解度时,才可能会有晶体析出。
A.在10℃时,三种物质溶解度的大小顺序依次为②>①>③,故A正确不合题意;
B.在t℃时,三种物质溶解度的大小顺序依次为①=②>③,因此它们饱和溶液中溶质质量分数的大小顺序为①=②>③,故B正确不合题意;
C.P点在硝酸钾溶解度图像的下方,说明这时溶液不饱和,只要蒸发适量水,减小溶剂的质量,肯定能够达到饱和,故C正确不合题意;
D.硝酸钾溶液降温,它的溶解度肯定会减小,但是如果温度下降的不够,那么可能溶液没有达到饱和,故D错误符合题意。
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
