2020-2021学年人教版九年级化学下册第九单元《溶液》专项练习题(含答案)
文档属性
| 名称 | 2020-2021学年人教版九年级化学下册第九单元《溶液》专项练习题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 145.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-02 10:43:53 | ||
图片预览



文档简介
人教版九年级化学下册第九单元《溶液》专项练习题(含答案)
一、单选题
1.下列关于金属材料的说法中,正确的是
A.生铁、硬铝、焊锡、铁矿石都属于合金
B.真金不怕火炼主要是因为黄金的化学性质稳定
C.将生锈的菜刀浸泡在食盐水中,可除去其表面的铁锈
D.通过相互刻画的方法,发现铜片的硬度比黄铜片大
2.下列对一些事实解释错误的是
A.墙内开花墙外香,是因为分子在不断运动
B.用洗涤剂除去油污,是因为洗涤剂能将油污溶解形成溶液
C.把铅加入锡中制成合金焊锡,结果是降低了熔点
D.铵盐与某物质混合施用,会降低肥效,该物质可能是熟石灰
3.今有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液,向其中加入一定量的铁粉充分反应后过滤,向滤液中加入一枚铁钉,表面析出银白色物质,滤纸上的物质是
A.Fe和Cu B.Ag 和Fe C.Ag和Cu D.Ag
4.某化学兴趣小组将一定质量的镁粉加入到硝酸银和硝酸亚铁的混合溶液中,充分反应后过滤,得到滤液和滤渣,向滤渣中滴加稀盐酸有气泡产生。则该小组同学的下列判断中,正确的是( )
A.滤液中一定不含硝酸银和硝酸亚铁 B.滤液中一定含有硝酸银和硝酸亚铁
C.滤渣中一定含有铁和银,可能含有镁 D.滤渣中一定含有镁、铁和银
5.在一定量AgNO3和Cu(NO3)2混合溶液中加入铁粉,充分反应,下列相关变化曲线一定不正确的是()
A. B.
C. D.
6.下列金属中,活动性最弱的是( )
A.镁 B.铜 C.铁 D.铝
7.用数轴表示某些化学知识更加直观、简明、易记。下列表示错误的是( )
A.等质量金属与足量盐酸反应放出氢气:
B.含硫物质中硫元素的化合价:
C.元素在地壳里的含量:
D.铁、铜、银的金属活动性:
8.现将X、Y两种金属片分别插入硫酸铜溶液中,X无明显变化,Y表面有铜析出,则X、Y、Cu三种金属的活动性由强到弱的顺序是
A.X > Y > Cu B.Cu > X > Y
C.Y > Cu > X D.X > Cu > Y
9.将质量相等的铝粉和铁粉分别与同体积、同浓度的两份稀硫酸反应,反应情况如图所示。有关叙述中正确的是( )
A.铝粉、铁粉和硫酸均有剩余
B.铝粉、铁粉均反应完,硫酸有剩余
C.硫酸、铝粉均反应完,铁粉有剩余
D.铁粉、硫酸均反应完,铝粉有剩余
10.下列生活用品,主要利用金属具有良好导热性的是( )
A.铸铁炊具 B.金属细丝
C.铜制电缆 D.铁锤
11.如图,将等质量的铁和锌分别加入左、右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余,(U型管内为水,初始液面相平,反应过程中装置气密性良好)下列说法正确的是
A.右边试管中,反应后的溶液为浅绿色
B.两试管中所得溶液的质量相等
C.U型管中液面左降右升
D.U型管中液面仍相平
12.在AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中加入一些铁粉,待反应完成后再过滤,下列情况中不可能存在的是( )
A.滤渣中只有Ag、Fe
B.滤渣中有Ag、Cu,滤液中有Mg2+、Fe2+
C.滤渣中有Ag、Cu、Fe,滤液中有Mg2+、Fe2+
D.滤渣中只有Ag
13.将铁粉加入到一定量AgNO3、Cu(NO3)2的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸发现有气体逸出,则滤渣的组成为
A.铁 B.铁和铜 C.铁和银 D.铁、铜、银
14.把金属X放入硝酸铜溶液中,X表面有红色固体析出;若将Y放入硝酸铜溶液中,无明显现象。则X、Y、Cu三种金属活动性由强到弱的顺序是 ( )
A.X、Cu、Y B.Cu、X、Y C.X、Y、Cu D.Y、X、Cu
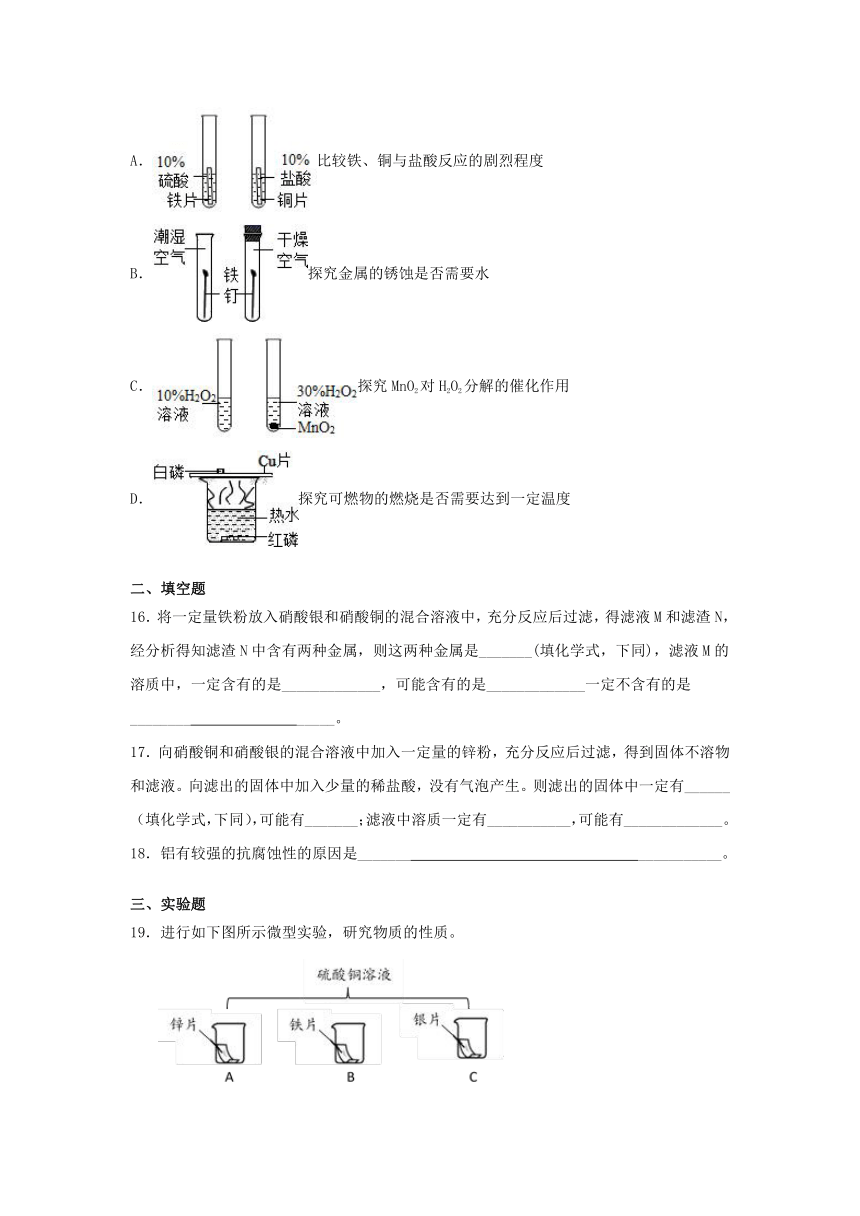
15.控制变量法是实验探究的重要方法,下列如图实验方法的设计中,能达到实验目的是( )
A.比较铁、铜与盐酸反应的剧烈程度
B.探究金属的锈蚀是否需要水
C.探究MnO2对H2O2分解的催化作用
D.探究可燃物的燃烧是否需要达到一定温度
二、填空题
16.将一定量铁粉放入硝酸银和硝酸铜的混合溶液中,充分反应后过滤,得滤液M和滤渣N,经分析得知滤渣N中含有两种金属,则这两种金属是_______(填化学式,下同),滤液M的溶质中,一定含有的是_____________,可能含有的是_____________一定不含有的是________ _____。
17.向硝酸铜和硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤,得到固体不溶物和滤液。向滤出的固体中加入少量的稀盐酸,没有气泡产生。则滤出的固体中一定有______(填化学式,下同),可能有_______;滤液中溶质一定有___________,可能有_____________。
18.铝有较强的抗腐蚀性的原因是_______ ___________。
三、实验题
19.进行如下图所示微型实验,研究物质的性质。
(1)能发生反应的是_______(填字母序号)。
(2)若要验证铁、铜、银的金属活动性顺序,依据的现象是__ __,反应的化学方程式为__ ___。
(3)在锌、铁、铜、银中,通过该实验,无法比较金属活动性顺序的两种金属是______。
20.碳酸氢钠(NaHCO3)俗称“小苏打”,在生活中用途广泛.某化学实验小组的同学对碳酸氢钠的性质进行探究.
(探究实验1)碳酸氢钠溶液的酸碱性
用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色.结论:____________.
(探究实验2)能与酸反应
取适量碳酸氢钠加入试管中,滴加稀盐酸,再把燃着的木条迅速伸入试管,木条熄灭,碳酸氢钠和盐酸的化学反应方程式:______________________________________________.
(探究实验3)能与碱反应
查阅资料:NaHCO3+NaOH═Na2CO3+H2O;氢氧化钙微溶于水.用试管取适量碳酸氢钠溶液,滴加氢氧化钠溶液,无明显现象.(提示:可以选择CaCl2溶液做试剂,通过证明有Na2CO3生成,从而证明二者发生了反应)如图,两位同学分别进行了甲、乙两个实验.回答下列问题:
比较甲、乙两个实验的目的性区别是_________________________________________;
有同学提出两个实验都不足以证明有Na2CO3生成,其理由______________________________________;要证明有Na2CO3生成,还需要进行的操作是______________________________________________________________.
四、计算题
21.生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品放在烧杯中,并向其中逐滴加入稀硫酸至恰好完全反应,实验数据如下表所示:
烧杯质量 样品的质量 稀硫酸的质量 烧杯+剩余物的总质量
50g 5.8g 94.6g 150.2g
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为多少g。
(2)样品中碳的质量分数(计算结果保留到0.1%);
(3)反应后得到的溶液中溶质的质量分数(计算结果保留到0.1%)。
22.将6.5g锌放入盛有50g稀硫酸溶液的烧杯中,恰好完全反应后,称得烧杯内的物质的总质量为56.3g。请计算:
(1)生成氢气的质量是多少g。
(2)该稀硫酸溶液中的硫酸是多少g?
23.向盛有100克稀硫酸的烧杯中逐渐加入10g锌粒,充分反应,产 生气体的质量与锌粒质量的关系如图所示。请根据关系图分析并计算:
(1)稀硫酸反应完时,产生氢气的质量为多少g。
(2)求反应消耗的锌粒的质量。
(3)生成的硫酸锌的质量。
(4)反应后所得溶液的质量。
参考答案
1.B2.B3.D4.C5.B6.B7.A8.C9.D10.A11.D12.A13.D14.A15.B
16. Ag、Cu Fe(NO3)2 Cu(NO3)2 AgNO3
17.Ag; Cu , Zn(NO3)2 Cu(NO3)2和AgNO3
18.铝与空气中的氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
19.AB B中铁片表面有红色固体析出,溶液由蓝色逐渐变为浅绿色,C中无明显现象 Fe+CuSO4=FeSO4+Cu 锌、铁
20.碳酸氢钠溶液显碱性 NaHCO3+HCl=NaCl+CO2↑+H2O 实验1通过检验反应物证明反应发生,而实验2通过检验产物证明反应发生 氯化钙与氢氧化钠反应生成氢氧化钙,氢氧化钙微溶于水,在溶液中也产生沉淀 取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有
21.(1)0.2;(2)3.4;(3)15.2%
22.(1)0.2g;(2)9.8g
23.(1)0.2
根据图像可知,反应生成氢气的质量为0.2g。
(2)6.5g
解:设消耗Zn质量为x,生成ZnSO4质量为y。
x=6.5g,反应消耗的锌粒的质量为6.5g。
(3)16.1g
解:设生成ZnSO4质量为y。
y=16.1g,生成的硫酸锌的质量为16.1g。
(4)106.3g
根据质量守恒定律,反应后所得溶液的质量为:100g+6.5g-0.2g=106.3g。
一、单选题
1.下列关于金属材料的说法中,正确的是
A.生铁、硬铝、焊锡、铁矿石都属于合金
B.真金不怕火炼主要是因为黄金的化学性质稳定
C.将生锈的菜刀浸泡在食盐水中,可除去其表面的铁锈
D.通过相互刻画的方法,发现铜片的硬度比黄铜片大
2.下列对一些事实解释错误的是
A.墙内开花墙外香,是因为分子在不断运动
B.用洗涤剂除去油污,是因为洗涤剂能将油污溶解形成溶液
C.把铅加入锡中制成合金焊锡,结果是降低了熔点
D.铵盐与某物质混合施用,会降低肥效,该物质可能是熟石灰
3.今有AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液,向其中加入一定量的铁粉充分反应后过滤,向滤液中加入一枚铁钉,表面析出银白色物质,滤纸上的物质是
A.Fe和Cu B.Ag 和Fe C.Ag和Cu D.Ag
4.某化学兴趣小组将一定质量的镁粉加入到硝酸银和硝酸亚铁的混合溶液中,充分反应后过滤,得到滤液和滤渣,向滤渣中滴加稀盐酸有气泡产生。则该小组同学的下列判断中,正确的是( )
A.滤液中一定不含硝酸银和硝酸亚铁 B.滤液中一定含有硝酸银和硝酸亚铁
C.滤渣中一定含有铁和银,可能含有镁 D.滤渣中一定含有镁、铁和银
5.在一定量AgNO3和Cu(NO3)2混合溶液中加入铁粉,充分反应,下列相关变化曲线一定不正确的是()
A. B.
C. D.
6.下列金属中,活动性最弱的是( )
A.镁 B.铜 C.铁 D.铝
7.用数轴表示某些化学知识更加直观、简明、易记。下列表示错误的是( )
A.等质量金属与足量盐酸反应放出氢气:
B.含硫物质中硫元素的化合价:
C.元素在地壳里的含量:
D.铁、铜、银的金属活动性:
8.现将X、Y两种金属片分别插入硫酸铜溶液中,X无明显变化,Y表面有铜析出,则X、Y、Cu三种金属的活动性由强到弱的顺序是
A.X > Y > Cu B.Cu > X > Y
C.Y > Cu > X D.X > Cu > Y
9.将质量相等的铝粉和铁粉分别与同体积、同浓度的两份稀硫酸反应,反应情况如图所示。有关叙述中正确的是( )
A.铝粉、铁粉和硫酸均有剩余
B.铝粉、铁粉均反应完,硫酸有剩余
C.硫酸、铝粉均反应完,铁粉有剩余
D.铁粉、硫酸均反应完,铝粉有剩余
10.下列生活用品,主要利用金属具有良好导热性的是( )
A.铸铁炊具 B.金属细丝
C.铜制电缆 D.铁锤
11.如图,将等质量的铁和锌分别加入左、右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余,(U型管内为水,初始液面相平,反应过程中装置气密性良好)下列说法正确的是
A.右边试管中,反应后的溶液为浅绿色
B.两试管中所得溶液的质量相等
C.U型管中液面左降右升
D.U型管中液面仍相平
12.在AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中加入一些铁粉,待反应完成后再过滤,下列情况中不可能存在的是( )
A.滤渣中只有Ag、Fe
B.滤渣中有Ag、Cu,滤液中有Mg2+、Fe2+
C.滤渣中有Ag、Cu、Fe,滤液中有Mg2+、Fe2+
D.滤渣中只有Ag
13.将铁粉加入到一定量AgNO3、Cu(NO3)2的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸发现有气体逸出,则滤渣的组成为
A.铁 B.铁和铜 C.铁和银 D.铁、铜、银
14.把金属X放入硝酸铜溶液中,X表面有红色固体析出;若将Y放入硝酸铜溶液中,无明显现象。则X、Y、Cu三种金属活动性由强到弱的顺序是 ( )
A.X、Cu、Y B.Cu、X、Y C.X、Y、Cu D.Y、X、Cu
15.控制变量法是实验探究的重要方法,下列如图实验方法的设计中,能达到实验目的是( )
A.比较铁、铜与盐酸反应的剧烈程度
B.探究金属的锈蚀是否需要水
C.探究MnO2对H2O2分解的催化作用
D.探究可燃物的燃烧是否需要达到一定温度
二、填空题
16.将一定量铁粉放入硝酸银和硝酸铜的混合溶液中,充分反应后过滤,得滤液M和滤渣N,经分析得知滤渣N中含有两种金属,则这两种金属是_______(填化学式,下同),滤液M的溶质中,一定含有的是_____________,可能含有的是_____________一定不含有的是________ _____。
17.向硝酸铜和硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤,得到固体不溶物和滤液。向滤出的固体中加入少量的稀盐酸,没有气泡产生。则滤出的固体中一定有______(填化学式,下同),可能有_______;滤液中溶质一定有___________,可能有_____________。
18.铝有较强的抗腐蚀性的原因是_______ ___________。
三、实验题
19.进行如下图所示微型实验,研究物质的性质。
(1)能发生反应的是_______(填字母序号)。
(2)若要验证铁、铜、银的金属活动性顺序,依据的现象是__ __,反应的化学方程式为__ ___。
(3)在锌、铁、铜、银中,通过该实验,无法比较金属活动性顺序的两种金属是______。
20.碳酸氢钠(NaHCO3)俗称“小苏打”,在生活中用途广泛.某化学实验小组的同学对碳酸氢钠的性质进行探究.
(探究实验1)碳酸氢钠溶液的酸碱性
用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色.结论:____________.
(探究实验2)能与酸反应
取适量碳酸氢钠加入试管中,滴加稀盐酸,再把燃着的木条迅速伸入试管,木条熄灭,碳酸氢钠和盐酸的化学反应方程式:______________________________________________.
(探究实验3)能与碱反应
查阅资料:NaHCO3+NaOH═Na2CO3+H2O;氢氧化钙微溶于水.用试管取适量碳酸氢钠溶液,滴加氢氧化钠溶液,无明显现象.(提示:可以选择CaCl2溶液做试剂,通过证明有Na2CO3生成,从而证明二者发生了反应)如图,两位同学分别进行了甲、乙两个实验.回答下列问题:
比较甲、乙两个实验的目的性区别是_________________________________________;
有同学提出两个实验都不足以证明有Na2CO3生成,其理由______________________________________;要证明有Na2CO3生成,还需要进行的操作是______________________________________________________________.
四、计算题
21.生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品放在烧杯中,并向其中逐滴加入稀硫酸至恰好完全反应,实验数据如下表所示:
烧杯质量 样品的质量 稀硫酸的质量 烧杯+剩余物的总质量
50g 5.8g 94.6g 150.2g
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为多少g。
(2)样品中碳的质量分数(计算结果保留到0.1%);
(3)反应后得到的溶液中溶质的质量分数(计算结果保留到0.1%)。
22.将6.5g锌放入盛有50g稀硫酸溶液的烧杯中,恰好完全反应后,称得烧杯内的物质的总质量为56.3g。请计算:
(1)生成氢气的质量是多少g。
(2)该稀硫酸溶液中的硫酸是多少g?
23.向盛有100克稀硫酸的烧杯中逐渐加入10g锌粒,充分反应,产 生气体的质量与锌粒质量的关系如图所示。请根据关系图分析并计算:
(1)稀硫酸反应完时,产生氢气的质量为多少g。
(2)求反应消耗的锌粒的质量。
(3)生成的硫酸锌的质量。
(4)反应后所得溶液的质量。
参考答案
1.B2.B3.D4.C5.B6.B7.A8.C9.D10.A11.D12.A13.D14.A15.B
16. Ag、Cu Fe(NO3)2 Cu(NO3)2 AgNO3
17.Ag; Cu , Zn(NO3)2 Cu(NO3)2和AgNO3
18.铝与空气中的氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
19.AB B中铁片表面有红色固体析出,溶液由蓝色逐渐变为浅绿色,C中无明显现象 Fe+CuSO4=FeSO4+Cu 锌、铁
20.碳酸氢钠溶液显碱性 NaHCO3+HCl=NaCl+CO2↑+H2O 实验1通过检验反应物证明反应发生,而实验2通过检验产物证明反应发生 氯化钙与氢氧化钠反应生成氢氧化钙,氢氧化钙微溶于水,在溶液中也产生沉淀 取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有
21.(1)0.2;(2)3.4;(3)15.2%
22.(1)0.2g;(2)9.8g
23.(1)0.2
根据图像可知,反应生成氢气的质量为0.2g。
(2)6.5g
解:设消耗Zn质量为x,生成ZnSO4质量为y。
x=6.5g,反应消耗的锌粒的质量为6.5g。
(3)16.1g
解:设生成ZnSO4质量为y。
y=16.1g,生成的硫酸锌的质量为16.1g。
(4)106.3g
根据质量守恒定律,反应后所得溶液的质量为:100g+6.5g-0.2g=106.3g。
同课章节目录
