2020-2021学年人教版九年级化学下册第十单元实验活动6 酸、碱的化学性质(20张PPT)
文档属性
| 名称 | 2020-2021学年人教版九年级化学下册第十单元实验活动6 酸、碱的化学性质(20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 773.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-03 21:08:36 | ||
图片预览






文档简介
第十单元 酸和碱
实验活动6 酸、碱的化学性质
一、目标要求
1.通过本实验活动,加深对酸和碱的主要性质的认识;
2.培养学生的实验操作能力和实验安全意识;
3.通过实验解释生活中的一些现象。
性质归纳
性质规律或化学方程式
(1)酸、碱都能与酸碱指示剂作用
紫色石蕊溶液遇酸溶液变为______色,遇碱溶液变为______色;
无色酚酞溶液遇酸溶液________色,遇碱溶液变为______色
(2)酸能与多种活泼金属反应,生成盐和氢气
Zn+HCl
?
Al+H2SO4
?
(3)酸能与某些金属氧化物反应,生成盐和水
CuO+HCl
?
Fe2O3+
H2SO4
?
【知识回顾】已经学习过的酸和碱的化学性质,完成下表:
实验导学
【实验目的】
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
【实验用品】
试管、药匙、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、火柴。
稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
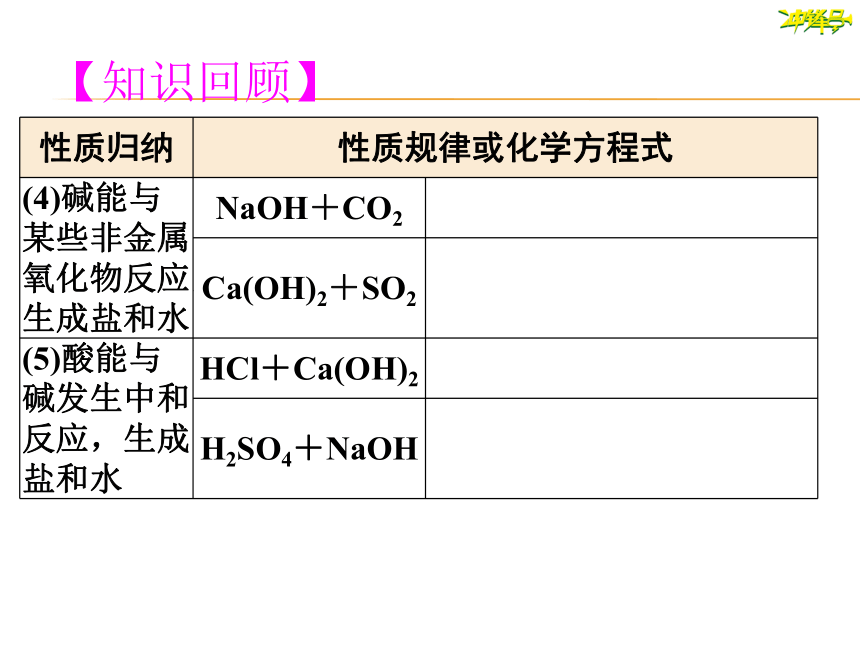
性质归纳
性质规律或化学方程式
(4)碱能与某些非金属氧化物反应,生成盐和水
NaOH+CO2
?
Ca(OH)2+SO2
?
(5)酸能与碱发生中和反应,生成盐和水
HCl+Ca(OH)2
?
H2SO4+NaOH
?
【知识回顾】
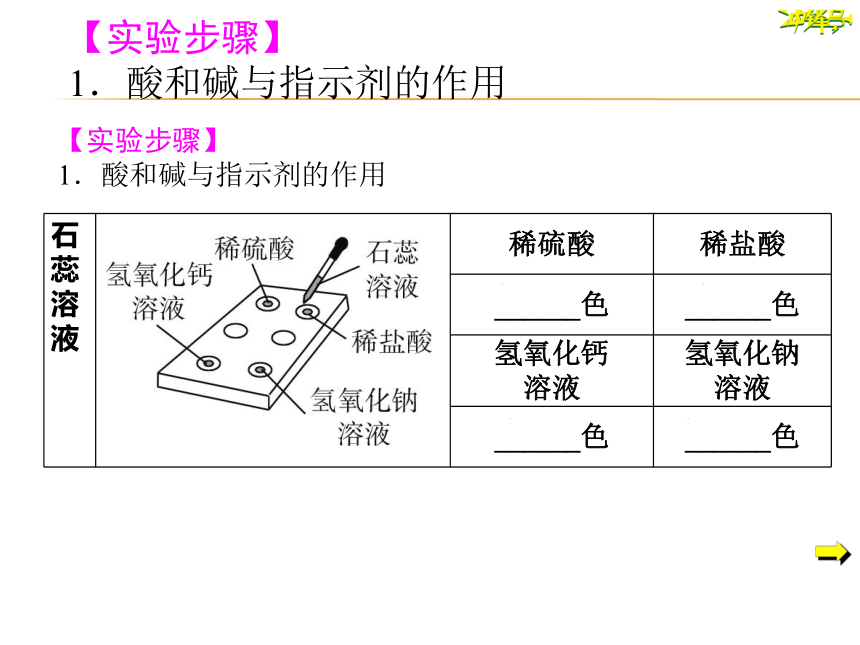
【实验步骤】
1.酸和碱与指示剂的作用
{2D5ABB26-0587-4C30-8999-92F81FD0307C}石蕊溶液
稀硫酸
稀盐酸
______色
______色
氢氧化钙
溶液
氢氧化钠
溶液
______色
______色
红
红
蓝
蓝
【实验步骤】
1.酸和碱与指示剂的作用
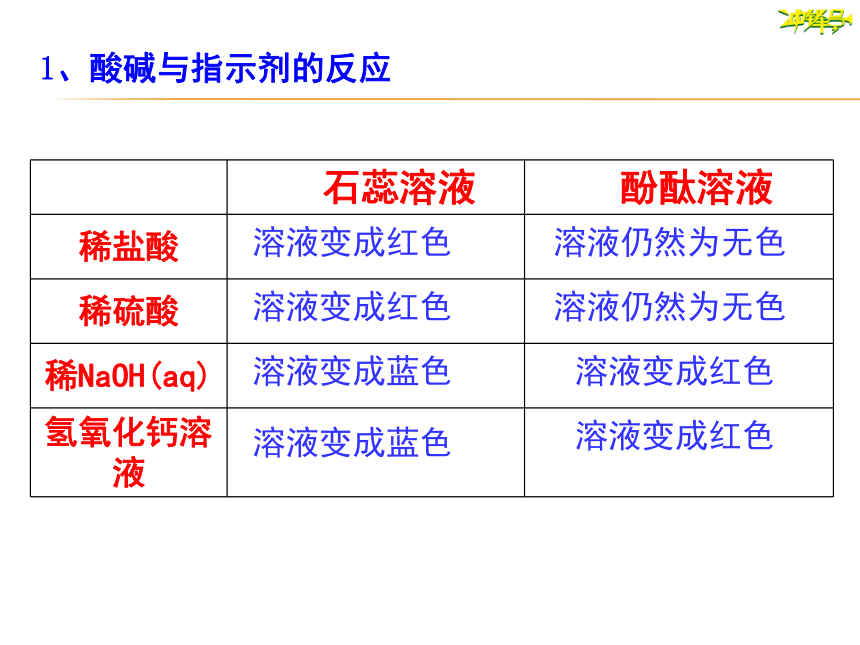
1、酸碱与指示剂的反应
石蕊溶液
酚酞溶液
稀盐酸
稀硫酸
稀NaOH(aq)
氢氧化钙溶液
溶液变成红色
溶液变成红色
溶液变成蓝色
溶液变成蓝色
溶液仍然为无色
溶液仍然为无色
溶液变成红色
溶液变成红色
结论:
1.酸溶液
能使紫色石蕊溶液变成红色
2.碱溶液
(1)能使紫色石蕊溶液变成蓝色;
(2)能使无色酚酞溶液变成红色。
反应的现象
结论(化学方程式)
稀盐酸和生锈铁钉的反应
①铁锈消失,铁钉变
得光亮,溶液由无色
变成黄色
②光亮的铁钉表面有
气泡冒出,溶液由黄色
变成绿色
①Fe2O3 + 6HCl = FeCl3 + H2O
② Fe + 2HCl = FeCl2 + H2
光亮的铁
钉继续
与酸作用
2、酸与金属氧化物的反应
3、氢氧化钠与硫酸铜的反应;酸与不溶性碱的反应
实验内容
结论(反应的化学方程式)
向盛有CuSO4的试管中加入几滴
NaOH溶液
再向上述
试管中加入
稀盐酸
有蓝色沉淀生成
①CuSO4+ 2NaOH = Cu(OH)2 + 2NaCl
反应的现象
沉淀消失
① Cu(OH)2 + 2HCl = CuCl2 + 2H2O
氢氧化钠溶液与盐酸的中和反应
实验现象
试管中溶液_____________________,蒸发皿中____________________
反应的化学方程式
?
实验结论:________________________
先变为红色再变为无色
有白色晶体析出
HCl+NaOH=NaCl+H2O
酸能与碱发生中和反应
4.酸与碱发生的反应
5、验证氢氧化钙的性质
实验内容
反应的现象
结论(化学方程式)
向1ml水中加入少
量的氢氧化钙粉
末,振荡,再滴入
1-2滴的酚酞溶液,
再加入1ml的水,
振荡
向1ml水中加入同质量的氢氧化钙粉末,振荡,再滴入1-2滴的酚酞溶液,再加入1ml的稀盐酸,振荡
有固体未溶解
溶液由无色变
为红色
有固体未溶解
溶液由无色变
为红色,加入盐酸后,固体全部溶解,溶液由红色变为无色
氢氧化钙微溶于水,
水溶液称碱性
Ca(OH)2+ 2HCl=CaCl2 + 2H2O
1.比较酸和碱与指示剂的作用,你发现了什么现象?
2.取两根生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。将铁钉放入试管应如何操作?
3.硫酸铜溶液中滴入几滴氢氧化钠溶液,你发现了什么现象?
学生讨论
【易错易混提示】
1.酸碱能使指示剂变色,而不是酸碱变色。
2.生锈的铁钉放入盐酸中先后会发生两个反应。
3.稀盐酸也能与不溶于水的碱(如氢氧化铜)发生反应。
1.下列物质加入到稀硫酸中,溶液变为浅绿色的是( )
A.氧化铜 B.氧化铁
C.铁 D.氧化锌
2.物质X可发生下列两个反应,则X可能是( )
①X+碱―→ 盐+H2O ②X+金属氧化物―→ 盐+H2O
A.H2SO4 B.CO2
C.CaO D.NaOH
A
自我提升
C
练一练
3.氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:
①Co+2HCl=== CoCl2+H2↑;
②CoCl2+2NaOH=== Co(OH)2↓+2NaCl。下列说法错误的是( )
A.钴的金属活动性比铜强
B.Co(OH)2不能干燥氯化氢气体
C.Co(OH)2能使酚酞溶液变红
D.Co(OH)2的化学性质不稳定
C
1.下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )
A.紫色石蕊溶液
B.氯化钠溶液
C.铁粉
D.pH试纸
D
六、达标检测
3.下列图像能正确反映其对应关系的是( )
B规律方法综合练
A.向盛有一定量的氢氧化钠溶液的烧杯中逐滴加入pH=2的稀盐酸至过量
B. 加水稀释氢氧化钠溶液
C.向pH=2的盐酸中加水稀释
D.向一定量的稀硫酸中加氢氧化钠溶液
D
物质名称
稀硫酸
氢氧化钙溶液
实验现象
_______________
溶液变为蓝色
4.实验是学习化学的重要途径,小亮在学习酸、碱的化学性质时做了如下实验,请你和他一起完成实验活动。
(1)在白色点滴板上完成实验A,请将实验现象补充完整。
溶液变为红色
挥发性
(2)在实验B的烧杯②中滴加2滴酚酞溶液后,扣上大烧杯,一段时间后观察到的现象是______________________________,本实验不仅说明分子________________,还能说明盐酸具有________。
(3)小亮用实验C验证二氧化碳与氢氧化钠溶液的反应,挤压滴管,观察到的现象是____________。
实验活动6 酸、碱的化学性质
一、目标要求
1.通过本实验活动,加深对酸和碱的主要性质的认识;
2.培养学生的实验操作能力和实验安全意识;
3.通过实验解释生活中的一些现象。
性质归纳
性质规律或化学方程式
(1)酸、碱都能与酸碱指示剂作用
紫色石蕊溶液遇酸溶液变为______色,遇碱溶液变为______色;
无色酚酞溶液遇酸溶液________色,遇碱溶液变为______色
(2)酸能与多种活泼金属反应,生成盐和氢气
Zn+HCl
?
Al+H2SO4
?
(3)酸能与某些金属氧化物反应,生成盐和水
CuO+HCl
?
Fe2O3+
H2SO4
?
【知识回顾】已经学习过的酸和碱的化学性质,完成下表:
实验导学
【实验目的】
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
【实验用品】
试管、药匙、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、火柴。
稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
性质归纳
性质规律或化学方程式
(4)碱能与某些非金属氧化物反应,生成盐和水
NaOH+CO2
?
Ca(OH)2+SO2
?
(5)酸能与碱发生中和反应,生成盐和水
HCl+Ca(OH)2
?
H2SO4+NaOH
?
【知识回顾】
【实验步骤】
1.酸和碱与指示剂的作用
{2D5ABB26-0587-4C30-8999-92F81FD0307C}石蕊溶液
稀硫酸
稀盐酸
______色
______色
氢氧化钙
溶液
氢氧化钠
溶液
______色
______色
红
红
蓝
蓝
【实验步骤】
1.酸和碱与指示剂的作用
1、酸碱与指示剂的反应
石蕊溶液
酚酞溶液
稀盐酸
稀硫酸
稀NaOH(aq)
氢氧化钙溶液
溶液变成红色
溶液变成红色
溶液变成蓝色
溶液变成蓝色
溶液仍然为无色
溶液仍然为无色
溶液变成红色
溶液变成红色
结论:
1.酸溶液
能使紫色石蕊溶液变成红色
2.碱溶液
(1)能使紫色石蕊溶液变成蓝色;
(2)能使无色酚酞溶液变成红色。
反应的现象
结论(化学方程式)
稀盐酸和生锈铁钉的反应
①铁锈消失,铁钉变
得光亮,溶液由无色
变成黄色
②光亮的铁钉表面有
气泡冒出,溶液由黄色
变成绿色
①Fe2O3 + 6HCl = FeCl3 + H2O
② Fe + 2HCl = FeCl2 + H2
光亮的铁
钉继续
与酸作用
2、酸与金属氧化物的反应
3、氢氧化钠与硫酸铜的反应;酸与不溶性碱的反应
实验内容
结论(反应的化学方程式)
向盛有CuSO4的试管中加入几滴
NaOH溶液
再向上述
试管中加入
稀盐酸
有蓝色沉淀生成
①CuSO4+ 2NaOH = Cu(OH)2 + 2NaCl
反应的现象
沉淀消失
① Cu(OH)2 + 2HCl = CuCl2 + 2H2O
氢氧化钠溶液与盐酸的中和反应
实验现象
试管中溶液_____________________,蒸发皿中____________________
反应的化学方程式
?
实验结论:________________________
先变为红色再变为无色
有白色晶体析出
HCl+NaOH=NaCl+H2O
酸能与碱发生中和反应
4.酸与碱发生的反应
5、验证氢氧化钙的性质
实验内容
反应的现象
结论(化学方程式)
向1ml水中加入少
量的氢氧化钙粉
末,振荡,再滴入
1-2滴的酚酞溶液,
再加入1ml的水,
振荡
向1ml水中加入同质量的氢氧化钙粉末,振荡,再滴入1-2滴的酚酞溶液,再加入1ml的稀盐酸,振荡
有固体未溶解
溶液由无色变
为红色
有固体未溶解
溶液由无色变
为红色,加入盐酸后,固体全部溶解,溶液由红色变为无色
氢氧化钙微溶于水,
水溶液称碱性
Ca(OH)2+ 2HCl=CaCl2 + 2H2O
1.比较酸和碱与指示剂的作用,你发现了什么现象?
2.取两根生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。将铁钉放入试管应如何操作?
3.硫酸铜溶液中滴入几滴氢氧化钠溶液,你发现了什么现象?
学生讨论
【易错易混提示】
1.酸碱能使指示剂变色,而不是酸碱变色。
2.生锈的铁钉放入盐酸中先后会发生两个反应。
3.稀盐酸也能与不溶于水的碱(如氢氧化铜)发生反应。
1.下列物质加入到稀硫酸中,溶液变为浅绿色的是( )
A.氧化铜 B.氧化铁
C.铁 D.氧化锌
2.物质X可发生下列两个反应,则X可能是( )
①X+碱―→ 盐+H2O ②X+金属氧化物―→ 盐+H2O
A.H2SO4 B.CO2
C.CaO D.NaOH
A
自我提升
C
练一练
3.氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:
①Co+2HCl=== CoCl2+H2↑;
②CoCl2+2NaOH=== Co(OH)2↓+2NaCl。下列说法错误的是( )
A.钴的金属活动性比铜强
B.Co(OH)2不能干燥氯化氢气体
C.Co(OH)2能使酚酞溶液变红
D.Co(OH)2的化学性质不稳定
C
1.下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )
A.紫色石蕊溶液
B.氯化钠溶液
C.铁粉
D.pH试纸
D
六、达标检测
3.下列图像能正确反映其对应关系的是( )
B规律方法综合练
A.向盛有一定量的氢氧化钠溶液的烧杯中逐滴加入pH=2的稀盐酸至过量
B. 加水稀释氢氧化钠溶液
C.向pH=2的盐酸中加水稀释
D.向一定量的稀硫酸中加氢氧化钠溶液
D
物质名称
稀硫酸
氢氧化钙溶液
实验现象
_______________
溶液变为蓝色
4.实验是学习化学的重要途径,小亮在学习酸、碱的化学性质时做了如下实验,请你和他一起完成实验活动。
(1)在白色点滴板上完成实验A,请将实验现象补充完整。
溶液变为红色
挥发性
(2)在实验B的烧杯②中滴加2滴酚酞溶液后,扣上大烧杯,一段时间后观察到的现象是______________________________,本实验不仅说明分子________________,还能说明盐酸具有________。
(3)小亮用实验C验证二氧化碳与氢氧化钠溶液的反应,挤压滴管,观察到的现象是____________。
同课章节目录
