湖北省武汉二中2011-2012学年高二上学期期中考试化学试题
文档属性
| 名称 | 湖北省武汉二中2011-2012学年高二上学期期中考试化学试题 |

|
|
| 格式 | zip | ||
| 文件大小 | 551.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-12-30 00:00:00 | ||
图片预览




文档简介
考试时间:2011年11月2日下午14:00-16:00 试卷满分:100分
可能用到的原子量:H-1 O-16 C-12 S-32 Na-23
一、选择题(每题只有一个选项,1~9题每小题2分,10~18题每小题3分,共45分)
1、下列获取物质的方法,不正确的是 ( )
A、用电石和饱和食盐水制取乙炔
B、通过石油分馏得到甲烷、乙烯和苯
C、用碳酸钠和氢氧化钙反应制氢氧化钠
D、将氯气通入氢氧化钠溶液得到漂白液
2、2010年2月19日,德国重离子研究中心宣布,经国际纯粹与应用化学联合会(IUPAC)确认,由该中心人工合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”,以纪念著名天文学家哥白尼。下列关于Cn的说法不正确的是 ( )
A、该元素原子核外有七个电子层
B、该元素既属于超铀元素,又属于主族元素
C、若一个Cn原子的质量约为氕原子质量的277倍,则该原子可表示为Cn
D、Cn与Cn互为同位素,二者中子数之差为8
3、据报道,结构式为 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是 ( )
A、O4与O3、O2互为同素异形体
B、O4与H2反应生成冰
C、O4中各原子最外电子层均达到8电子结构
D、O4的化学性质一定比O2稳定
4、2009年11月26日,中国正式对外宣布控制温室气体排放的行动目标,决定到2020年单位国内生产总值二氧化碳排放比2005年下降40%~45%。下列说法正确的是
( )
A、控制二氧化碳的排放是有效防止酸雨的重要措施
B、二氧化碳是一种含有非极性共价键的非极性分子
C、二氧化碳分子的比例模型为
D、广泛使用高效节能的荧光电灯可以减少二氧化碳的排放量
5、某有机物的结构简式为:
其不可能发生的反应有 ( )
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
⑥与氢氧化钠的反应 ⑦与稀盐酸的反应
A、②③④ B、①④⑥ C、③⑤⑦ D、⑦
6、有机物X是一种广谱杀菌剂,作为香料、麻醉剂、食品添加剂,曾广泛应用于医药和工业。该有机物具有下列性质:①与FeCl3溶液作用发生显色反应;②能发生加成反应;③能与溴水发生反应。依据以上信息,下列说法合理的是 ( )
A、有机物X是一种芳香烃
B、有机物X可能不含双键结构
C、有机物X可以与碳酸氢钠溶液反应
D、有机物X一定含有碳碳双键或碳碳叁键
7、下列对粒子之间关系和粒子特征的描述正确的是 ( )
选项 粒子 相互关系 特征描述
A C60、C70、C540 同位素 均只含共价键
B 新戊烷、2,2-二甲基丙烷 同分异构体 常温常压下呈气态
C Pt和Pt 同素异形体 铂可用作氨催化氧化反应的催化剂
D 甲醇、乙二醇、甘油 同类物质 能发生酯化、催化氧化反应
8、下列实验操作或对实验事实的叙述正确的是 ( )
A、采用先蒸发浓缩后冷却结晶的方法分离硝酸钾和氯化钠
B、常温时,用pH试纸测得0.1mol·L-1碳酸钠溶液的pH=7
C、如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗
D、向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
9、下列说法正确的是 ( )
A、第ⅠA族元素的金属性一定比第ⅡA族元素的金属性强
B、第ⅥA族元素中氢化物最稳定的其沸点一定最高
C、全部由非金属元素形成的化合物中只有共价化合物
D、短周期中,同周期元素的离子半径从左到右逐渐减小
10、某有机物M与氢气加成的产物是(CH3)2CHCH2OH,则有关M的说法正确的是( )
A、M的分子式为C4H6O B、M是丙醛的同分异构体
C、M能发生银镜反应 D、M可能是乙醛的同系物
11、认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法正确的是
( )
A、等体积的甲烷与氯气在光照条件下反应,一定只生成一氯甲烷和氯化氢
B、钠在敞口容器中长期存放或在空气中燃烧的产物一定是Na2O2
C、溶液中盐与盐的复分解反应,一定不会有气体产生
D、向苯酚钠溶液中通入少量CO2或过量CO2,产物中一定含有NaHCO3
12、稻瘟灵是一种高效内吸杀菌剂,是防治水稻稻瘟病的特效药剂。其结构简式如图所示,下列有关稻瘟灵的说法正确的是 ( )
A、稻瘟灵的分子式为C12H18O4S2
B、在一定条件下,1mol稻瘟灵可与3mol H2发生加成反应
C、该物质在稀硫酸作用下水解可生成3种有机物
D、该物质不能使酸性高锰酸钾溶液褪色
13、氧化还原反应中实际上包含氧化和还原两个过程。某氧化还原反应的一个还原过程的反应式为:S2O+2e-2SO,该反应中另一重要反应物可能是KMnO4、Na2CO3、MnSO4、KNO3四种物质中的一种。下列有关说法正确的是 ( )
A、S2O中S显+7价,说明S的最外层有7个电子
B、该反应中另一重要反应物为KMnO4
C、该反应的氧化过程可表示为:Mn2+-5e-+4H2OMnO+8H+
D、若有5mol S2O参与反应,溶液中会生成8 mol H+
14、A、B、C三种短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数。下列说法中不正确的是( )
①B与C均存在同素异形体
②X的种类比Y的多
③A、B、C形成的简单氢化物中,A的氢化物沸点最高
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A、①④ B、③ C、② D、②③
15、新型微生物原料电池可以将富含有机物的污水变成干净的水,同时提供电能。该电池中用质子交换膜将正负极分开。工作时,将污水注入反应槽中,污水中的有机物在微生物作用下分解放出电子和质子,质子通过交换膜到另一极与富含氧气的水反应。下列说法正确的是 ( )
A、注入污水的一极是电池的负极,发生氧化反应
B、注入污水的一极是电池的正极,发生氧化反应
C、这种新型微生物燃料电池适宜处理硫酸厂的废水
D、用葡萄糖表示污水中的有机物,通入污水一极的电极反应为
C6H12O6+6O26CO2+6H2O
16、某相对分子质量小于200的芳香族含氧衍生物中氧的质量分数为13.1%(仅含碳、氢、氧三种元素),已知其分子中含有2个-CH3,且该物质遇FeCl3溶液显紫色,则该有机物的结构共有 ( )
A、2种 B、4种 C、6种 D、8种
17、缓慢进行下列各种操作,不会导致液体分散系颜色发生两次显著变化的是( )
A、向Fe(OH)3胶体中加入4mol/L硫酸至过量
B、向紫色石蕊试液中通入过量氯气
C、向紫色石蕊试液中通入过量二氧化硫
D、向酚酞试液中加入Na2O2粉末至过量
18、香柠檬油可用于化妆品。香柠檬油中含微量的香柠檬酚和香柠檬醚,其结构分别如图所示。下列说法不正确的是 ( )
A、香柠檬醚的分子式为C13H8O4
B、1mol 香柠檬酚最多与3mol溴水发生反应
C、香柠檬酚通过取代反应可转化成香柠檬醚
D、1mol 香柠檬酚在NaOH溶液中水解时能消耗2mol NaOH
二、非选择题(共55分)
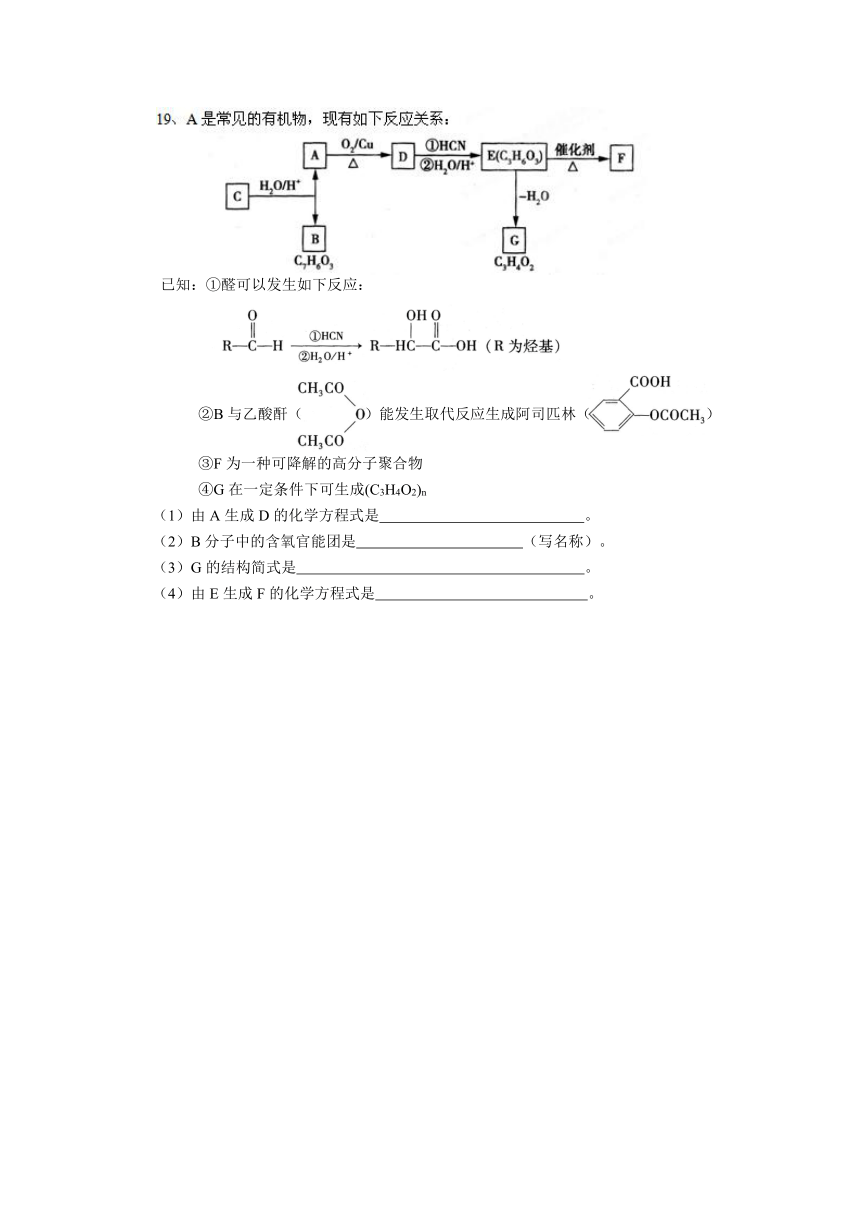
已知:①醛可以发生如下反应:
②B与乙酸酐( )能发生取代反应生成阿司匹林( )
③F为一种可降解的高分子聚合物
④G在一定条件下可生成(C3H4O2)n
(1)由A生成D的化学方程式是 。
(2)B分子中的含氧官能团是 (写名称)。
(3)G的结构简式是 。
(4)由E生成F的化学方程式是 。
20、V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族。Z的化合物可以发生某一反应,其离子方程式为:
5 +ZO+6H+3Z2+3H2O(未完成)。
(1)Y、Z两种元素的简单离子的半径大小关系为 (用离子符号表示)。
(2)五种元素中分子的空间构型相同的氢化物沸点高低排列顺序为
(用分子式表示),其原因是 。
(3)V与Z单质不能直接化合生成VZ4,在催化剂作用下由VY2与Z2反应制得VZ4,其化学反应方程式为VY2+Z2→VZ4+Y2Z2(未配平)。
①写出上述化学反应方程式 。
②Y2Z2分子中,Y与Z均满足8e-结构,则Y2Z2的结构式为 。
③Y与W两种元素形成一种重要化合物A,A分子的结构如图所示:
6mol Y2Z2与16mol W的简单氢化物恰好完全反应生成A、Y单质和一种中学化学中常见的盐。写出该反应的化学方程式: 。
21、环氧树脂是一类重要的热固性塑料。可以利用双酚A与环氧氯丙烷按下式反应制得环氧树脂。
(1)上述反应属于 (填反应类型)。
(2)双酚A是内分泌干扰素,可扰乱人体激素的分泌。双酚A的分子式为 ,分子中一定处于同一平面的原子有 个。
(3)通常条件下,双酚A能与浓溴水发生反应,则1mol双酚A可消耗 mol Br2。
(4)环氧氯丙烷易燃,有毒性,是致癌物质。环氧氯丙烷有如下转化关系:
①A是一种常见烃,能使酸性高锰酸钾溶液褪色,A的结构简式为 。
②C具有左右对称结构,C→甘油的化学反应方程式为 ,B→C的化学反应方程式为 。
③生成D的反应与制环氧树脂的反应类似,D的结构简式为 。
④C的同类同分异构体共有 种(包括C本身,已知“ ”不稳定)。
22、某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
第1组 第2组 第3组
S(单质) SO2、X、Na2SO3、NaHSO3 SO3、H2SO4、Na2SO4、NaHSO4
(2)利用下图所示的装置研究SO2的性质:
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。
23、有a、b、c、d四种原子序数依次增大的常见短周期元素,a、c结合构成化合物x;b、c结合构成化合物y;c、d结合构成化合物z。元素组成的单质(仍用a、b、c、d表示)和组成的化合物之间的反应关系如下(未配平):
①x+z→c↑+n ②y+z→c↑+m ③n+y→m+x ④d+x→n+a↑
(1)上述反应中,有充分理由说明该反应一定属于氧化还原反应的是
(填反应编号)。
(2)组成化合物n的元素为 (填字母),判断理由为 。
(3)根据题意写出:z的电子式为 ,y的结构式为 。
(4)根据题意写出:反应①的化学方程式 。
24、有机物A可作为合成降血脂药物安妥明( )和
某聚碳酸酯工程塑料( )的原料之一。
已知:
①如下有机物分子结构不稳定,会发生反应:
②某些醇或酚可以与碳酸酯反应生成聚碳酸酯,如:
相关的合成路线如下图所示:
(1)经质谱测定,有机物A的相对分子质量为58,燃烧2.9g有机物A,生成标准状况下3.36L CO2和2.7g H2O,A的核磁共振氢谱只出现一个吸收峰。则A的分子式是 。
(2)E→安妥明反应的化学方程式是 。
(3)C可能发生的反应类型是(填选项序号) 。
a. 取代反应 b. 加成反应 c. 消去反应 d. 还原反应
(4)F的结构简式是 。
(5)写出同时符合下列条件的E的同分异构体X的结构简式(只写1种即可)
。
①X能与饱和溴水发生取代反应
②X的苯环上有2个取代基,且苯环上的一溴取代物只有2种
③1mol X与足量NaHCO3溶液反应生成1mol CO2,与足量Na反应生成1mol H2
④X与NaOH水溶液发生取代反应所生成的官能团能被连续氧化为羧基
2011-2012学年度上学期武汉二中期中考试
高二化学试题参考答案
一、选择题(每题只有一个选项,1~9题每小题2分,10~18题每小题3分,共45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
答案 B B D D D B D A B D D A C B A C C D
二、非选择题
19、(共8分,每空2分)
20、(共10分)
(1)r(S2-)>r(Cl-)(1分)
(2)H2O>H2S(1分) H2O分子间存在氢键(2分)
(3)①CS2+3Cl2CCl4+S2Cl2(2分) ②Cl―S―S―Cl(2分)
③6S2Cl2+16NH3S4N4↓+12NH4Cl+8S↓(2分)
21、(共13分)
(1)缩聚反应(1分)
(2)C15H16O2(1分) 12(1分)
(3)4(1分)
(4)①CH2=CHCH3(1分)
(2分)
(2分)
(2分)
(2分)
22、(8分)
(1)H2SO3(1分)
(2)①2SO2+O2 2SO3(1分)
②冷凝SO3,将SO3与SO2、O2分离(2分)
5SO2+2MnO+2H2O5SO+2Mn2++4H+(2分)
③4SO2+7NaOH3Na2SO3+NaHSO3+3H2O(2分)
23、(共8分)
(1)①②④(1分)
(2)acd(1分)
根据反应①可以确定n一定含有a、d两种元素,根据反应④可以确定n一定含有c、d两种元素,所以n一定含有a、c、d三种元素(2分)
(3)Na+[:O : O : ]2-Na+(1分) O=C=O(1分)
(4)2Na2O2+2H2O4NaOH+O2↑(2分)
24、(8分)
(1)C3H6O(1分)
(2)
(2分)
(3)a、b、d(1分)
(4) (2分)
(5)
(2分)
: :
: :
可能用到的原子量:H-1 O-16 C-12 S-32 Na-23
一、选择题(每题只有一个选项,1~9题每小题2分,10~18题每小题3分,共45分)
1、下列获取物质的方法,不正确的是 ( )
A、用电石和饱和食盐水制取乙炔
B、通过石油分馏得到甲烷、乙烯和苯
C、用碳酸钠和氢氧化钙反应制氢氧化钠
D、将氯气通入氢氧化钠溶液得到漂白液
2、2010年2月19日,德国重离子研究中心宣布,经国际纯粹与应用化学联合会(IUPAC)确认,由该中心人工合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”,以纪念著名天文学家哥白尼。下列关于Cn的说法不正确的是 ( )
A、该元素原子核外有七个电子层
B、该元素既属于超铀元素,又属于主族元素
C、若一个Cn原子的质量约为氕原子质量的277倍,则该原子可表示为Cn
D、Cn与Cn互为同位素,二者中子数之差为8
3、据报道,结构式为 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是 ( )
A、O4与O3、O2互为同素异形体
B、O4与H2反应生成冰
C、O4中各原子最外电子层均达到8电子结构
D、O4的化学性质一定比O2稳定
4、2009年11月26日,中国正式对外宣布控制温室气体排放的行动目标,决定到2020年单位国内生产总值二氧化碳排放比2005年下降40%~45%。下列说法正确的是
( )
A、控制二氧化碳的排放是有效防止酸雨的重要措施
B、二氧化碳是一种含有非极性共价键的非极性分子
C、二氧化碳分子的比例模型为
D、广泛使用高效节能的荧光电灯可以减少二氧化碳的排放量
5、某有机物的结构简式为:
其不可能发生的反应有 ( )
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
⑥与氢氧化钠的反应 ⑦与稀盐酸的反应
A、②③④ B、①④⑥ C、③⑤⑦ D、⑦
6、有机物X是一种广谱杀菌剂,作为香料、麻醉剂、食品添加剂,曾广泛应用于医药和工业。该有机物具有下列性质:①与FeCl3溶液作用发生显色反应;②能发生加成反应;③能与溴水发生反应。依据以上信息,下列说法合理的是 ( )
A、有机物X是一种芳香烃
B、有机物X可能不含双键结构
C、有机物X可以与碳酸氢钠溶液反应
D、有机物X一定含有碳碳双键或碳碳叁键
7、下列对粒子之间关系和粒子特征的描述正确的是 ( )
选项 粒子 相互关系 特征描述
A C60、C70、C540 同位素 均只含共价键
B 新戊烷、2,2-二甲基丙烷 同分异构体 常温常压下呈气态
C Pt和Pt 同素异形体 铂可用作氨催化氧化反应的催化剂
D 甲醇、乙二醇、甘油 同类物质 能发生酯化、催化氧化反应
8、下列实验操作或对实验事实的叙述正确的是 ( )
A、采用先蒸发浓缩后冷却结晶的方法分离硝酸钾和氯化钠
B、常温时,用pH试纸测得0.1mol·L-1碳酸钠溶液的pH=7
C、如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗
D、向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
9、下列说法正确的是 ( )
A、第ⅠA族元素的金属性一定比第ⅡA族元素的金属性强
B、第ⅥA族元素中氢化物最稳定的其沸点一定最高
C、全部由非金属元素形成的化合物中只有共价化合物
D、短周期中,同周期元素的离子半径从左到右逐渐减小
10、某有机物M与氢气加成的产物是(CH3)2CHCH2OH,则有关M的说法正确的是( )
A、M的分子式为C4H6O B、M是丙醛的同分异构体
C、M能发生银镜反应 D、M可能是乙醛的同系物
11、认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法正确的是
( )
A、等体积的甲烷与氯气在光照条件下反应,一定只生成一氯甲烷和氯化氢
B、钠在敞口容器中长期存放或在空气中燃烧的产物一定是Na2O2
C、溶液中盐与盐的复分解反应,一定不会有气体产生
D、向苯酚钠溶液中通入少量CO2或过量CO2,产物中一定含有NaHCO3
12、稻瘟灵是一种高效内吸杀菌剂,是防治水稻稻瘟病的特效药剂。其结构简式如图所示,下列有关稻瘟灵的说法正确的是 ( )
A、稻瘟灵的分子式为C12H18O4S2
B、在一定条件下,1mol稻瘟灵可与3mol H2发生加成反应
C、该物质在稀硫酸作用下水解可生成3种有机物
D、该物质不能使酸性高锰酸钾溶液褪色
13、氧化还原反应中实际上包含氧化和还原两个过程。某氧化还原反应的一个还原过程的反应式为:S2O+2e-2SO,该反应中另一重要反应物可能是KMnO4、Na2CO3、MnSO4、KNO3四种物质中的一种。下列有关说法正确的是 ( )
A、S2O中S显+7价,说明S的最外层有7个电子
B、该反应中另一重要反应物为KMnO4
C、该反应的氧化过程可表示为:Mn2+-5e-+4H2OMnO+8H+
D、若有5mol S2O参与反应,溶液中会生成8 mol H+
14、A、B、C三种短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数。下列说法中不正确的是( )
①B与C均存在同素异形体
②X的种类比Y的多
③A、B、C形成的简单氢化物中,A的氢化物沸点最高
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A、①④ B、③ C、② D、②③
15、新型微生物原料电池可以将富含有机物的污水变成干净的水,同时提供电能。该电池中用质子交换膜将正负极分开。工作时,将污水注入反应槽中,污水中的有机物在微生物作用下分解放出电子和质子,质子通过交换膜到另一极与富含氧气的水反应。下列说法正确的是 ( )
A、注入污水的一极是电池的负极,发生氧化反应
B、注入污水的一极是电池的正极,发生氧化反应
C、这种新型微生物燃料电池适宜处理硫酸厂的废水
D、用葡萄糖表示污水中的有机物,通入污水一极的电极反应为
C6H12O6+6O26CO2+6H2O
16、某相对分子质量小于200的芳香族含氧衍生物中氧的质量分数为13.1%(仅含碳、氢、氧三种元素),已知其分子中含有2个-CH3,且该物质遇FeCl3溶液显紫色,则该有机物的结构共有 ( )
A、2种 B、4种 C、6种 D、8种
17、缓慢进行下列各种操作,不会导致液体分散系颜色发生两次显著变化的是( )
A、向Fe(OH)3胶体中加入4mol/L硫酸至过量
B、向紫色石蕊试液中通入过量氯气
C、向紫色石蕊试液中通入过量二氧化硫
D、向酚酞试液中加入Na2O2粉末至过量
18、香柠檬油可用于化妆品。香柠檬油中含微量的香柠檬酚和香柠檬醚,其结构分别如图所示。下列说法不正确的是 ( )
A、香柠檬醚的分子式为C13H8O4
B、1mol 香柠檬酚最多与3mol溴水发生反应
C、香柠檬酚通过取代反应可转化成香柠檬醚
D、1mol 香柠檬酚在NaOH溶液中水解时能消耗2mol NaOH
二、非选择题(共55分)
已知:①醛可以发生如下反应:
②B与乙酸酐( )能发生取代反应生成阿司匹林( )
③F为一种可降解的高分子聚合物
④G在一定条件下可生成(C3H4O2)n
(1)由A生成D的化学方程式是 。
(2)B分子中的含氧官能团是 (写名称)。
(3)G的结构简式是 。
(4)由E生成F的化学方程式是 。
20、V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族。Z的化合物可以发生某一反应,其离子方程式为:
5 +ZO+6H+3Z2+3H2O(未完成)。
(1)Y、Z两种元素的简单离子的半径大小关系为 (用离子符号表示)。
(2)五种元素中分子的空间构型相同的氢化物沸点高低排列顺序为
(用分子式表示),其原因是 。
(3)V与Z单质不能直接化合生成VZ4,在催化剂作用下由VY2与Z2反应制得VZ4,其化学反应方程式为VY2+Z2→VZ4+Y2Z2(未配平)。
①写出上述化学反应方程式 。
②Y2Z2分子中,Y与Z均满足8e-结构,则Y2Z2的结构式为 。
③Y与W两种元素形成一种重要化合物A,A分子的结构如图所示:
6mol Y2Z2与16mol W的简单氢化物恰好完全反应生成A、Y单质和一种中学化学中常见的盐。写出该反应的化学方程式: 。
21、环氧树脂是一类重要的热固性塑料。可以利用双酚A与环氧氯丙烷按下式反应制得环氧树脂。
(1)上述反应属于 (填反应类型)。
(2)双酚A是内分泌干扰素,可扰乱人体激素的分泌。双酚A的分子式为 ,分子中一定处于同一平面的原子有 个。
(3)通常条件下,双酚A能与浓溴水发生反应,则1mol双酚A可消耗 mol Br2。
(4)环氧氯丙烷易燃,有毒性,是致癌物质。环氧氯丙烷有如下转化关系:
①A是一种常见烃,能使酸性高锰酸钾溶液褪色,A的结构简式为 。
②C具有左右对称结构,C→甘油的化学反应方程式为 ,B→C的化学反应方程式为 。
③生成D的反应与制环氧树脂的反应类似,D的结构简式为 。
④C的同类同分异构体共有 种(包括C本身,已知“ ”不稳定)。
22、某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示的3组,第2组中物质X的化学式是 。
第1组 第2组 第3组
S(单质) SO2、X、Na2SO3、NaHSO3 SO3、H2SO4、Na2SO4、NaHSO4
(2)利用下图所示的装置研究SO2的性质:
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;
装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是
。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有70mL 2mol·L-1NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是 。
23、有a、b、c、d四种原子序数依次增大的常见短周期元素,a、c结合构成化合物x;b、c结合构成化合物y;c、d结合构成化合物z。元素组成的单质(仍用a、b、c、d表示)和组成的化合物之间的反应关系如下(未配平):
①x+z→c↑+n ②y+z→c↑+m ③n+y→m+x ④d+x→n+a↑
(1)上述反应中,有充分理由说明该反应一定属于氧化还原反应的是
(填反应编号)。
(2)组成化合物n的元素为 (填字母),判断理由为 。
(3)根据题意写出:z的电子式为 ,y的结构式为 。
(4)根据题意写出:反应①的化学方程式 。
24、有机物A可作为合成降血脂药物安妥明( )和
某聚碳酸酯工程塑料( )的原料之一。
已知:
①如下有机物分子结构不稳定,会发生反应:
②某些醇或酚可以与碳酸酯反应生成聚碳酸酯,如:
相关的合成路线如下图所示:
(1)经质谱测定,有机物A的相对分子质量为58,燃烧2.9g有机物A,生成标准状况下3.36L CO2和2.7g H2O,A的核磁共振氢谱只出现一个吸收峰。则A的分子式是 。
(2)E→安妥明反应的化学方程式是 。
(3)C可能发生的反应类型是(填选项序号) 。
a. 取代反应 b. 加成反应 c. 消去反应 d. 还原反应
(4)F的结构简式是 。
(5)写出同时符合下列条件的E的同分异构体X的结构简式(只写1种即可)
。
①X能与饱和溴水发生取代反应
②X的苯环上有2个取代基,且苯环上的一溴取代物只有2种
③1mol X与足量NaHCO3溶液反应生成1mol CO2,与足量Na反应生成1mol H2
④X与NaOH水溶液发生取代反应所生成的官能团能被连续氧化为羧基
2011-2012学年度上学期武汉二中期中考试
高二化学试题参考答案
一、选择题(每题只有一个选项,1~9题每小题2分,10~18题每小题3分,共45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
答案 B B D D D B D A B D D A C B A C C D
二、非选择题
19、(共8分,每空2分)
20、(共10分)
(1)r(S2-)>r(Cl-)(1分)
(2)H2O>H2S(1分) H2O分子间存在氢键(2分)
(3)①CS2+3Cl2CCl4+S2Cl2(2分) ②Cl―S―S―Cl(2分)
③6S2Cl2+16NH3S4N4↓+12NH4Cl+8S↓(2分)
21、(共13分)
(1)缩聚反应(1分)
(2)C15H16O2(1分) 12(1分)
(3)4(1分)
(4)①CH2=CHCH3(1分)
(2分)
(2分)
(2分)
(2分)
22、(8分)
(1)H2SO3(1分)
(2)①2SO2+O2 2SO3(1分)
②冷凝SO3,将SO3与SO2、O2分离(2分)
5SO2+2MnO+2H2O5SO+2Mn2++4H+(2分)
③4SO2+7NaOH3Na2SO3+NaHSO3+3H2O(2分)
23、(共8分)
(1)①②④(1分)
(2)acd(1分)
根据反应①可以确定n一定含有a、d两种元素,根据反应④可以确定n一定含有c、d两种元素,所以n一定含有a、c、d三种元素(2分)
(3)Na+[:O : O : ]2-Na+(1分) O=C=O(1分)
(4)2Na2O2+2H2O4NaOH+O2↑(2分)
24、(8分)
(1)C3H6O(1分)
(2)
(2分)
(3)a、b、d(1分)
(4) (2分)
(5)
(2分)
: :
: :
同课章节目录
