5.2 氮及其化合物——硝 酸的性质 课件【新教材】2020-2021学年人教版(2019)高一化学必修二
文档属性
| 名称 | 5.2 氮及其化合物——硝 酸的性质 课件【新教材】2020-2021学年人教版(2019)高一化学必修二 |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-03 00:00:00 | ||
图片预览





文档简介
第五章、化工生产中的重要非金属元素
第二节、氮及其化合物
第二部分:氨和铵盐
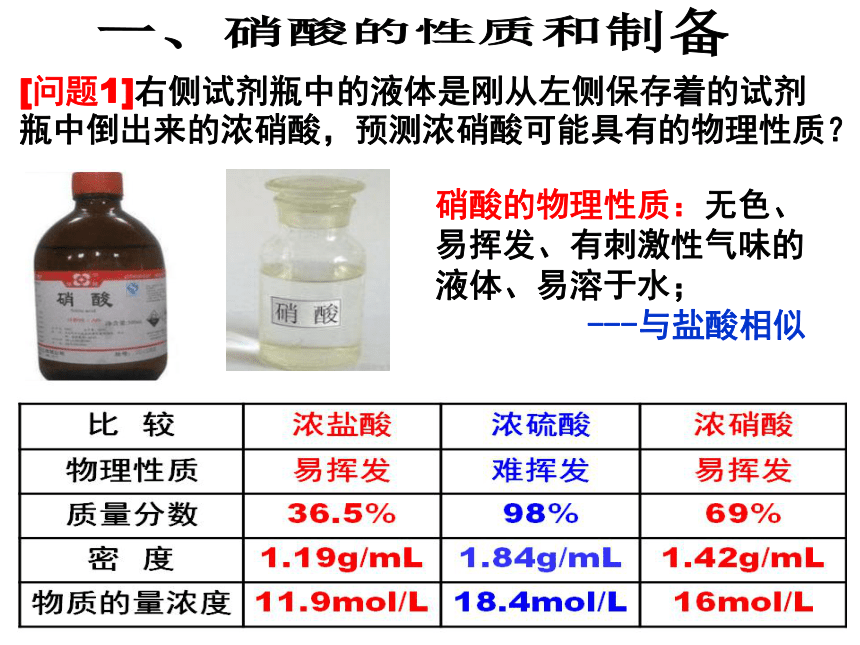
[问题1]右侧试剂瓶中的液体是刚从左侧保存着的试剂瓶中倒出来的浓硝酸,预测浓硝酸可能具有的物理性质?
硝酸的物理性质:无色、易挥发、有刺激性气味的液体、易溶于水;
---与盐酸相似
一、硝酸的性质和制备
[问题2]浓硝酸和浓盐酸的保存有何不同,推测可能的原因?浓硝酸久置后呈黄色,为什么?如何除去黄色?
A、不稳定性:光照或受热易分解---浓硝酸贮存在棕色细口瓶中并避光、低温
[问题3]在实验室,保存浓硝酸的试剂瓶通常用玻璃塞而不用橡胶塞,推测可能的原因?
一、硝酸的性质和制备
[实验5-8]向两支具支试管中分别加入2毫升浓硝酸与稀硝酸,用橡胶塞塞住试管口,并使铜丝与硝酸接触,观察并比较实验现象的差异。向上拉铜丝,终止反应,推测可能发生的反应方程式。
反应物
实验现象
铜丝与
浓硝酸
铜丝与
稀硝酸
反应剧烈、铜丝逐渐变细、溶液呈绿色、试管上方出现红棕色气体。
反应缓慢,铜丝逐渐溶解、溶液呈蓝色、试管上方气体呈淡红棕色,后逐渐变无色。
该实验步骤的好处:利用Cu与浓硝酸反应生成的NO2排出具支试管中的空气,有利于观察Cu与稀硝酸反应产物
一、硝酸的性质和制备
[问题4]用等质量铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:A、两者颜色不同的原因,是因为Cu2+浓度差异引起的。B、前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。你认为上述看法 (“A”或“B”)合理。若是A合理,说明理由,若是B合理,设计一个简单实验证明: 。
B合理---铜质量相等,硝酸足量,硝酸铜浓度相同
实验方案:往蓝色溶液中通入NO2,溶液由蓝色变为绿色;或加热绿色溶液,有红棕色气体产生,溶液变成蓝色;
必修二教材第18页练习与应用习题6
一、硝酸的性质和制备
一、硝酸的性质和制备
[问题5]铜与浓、稀硝酸均可反应,但常温下常用铁或铝制容器来盛装浓硝酸或浓硫酸,你知道原因吗?
浓硝酸和浓盐酸按体积比为1∶3混合得到的混合物叫做王水,王水能使不溶于硝酸的金属如金、铂等溶解。
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
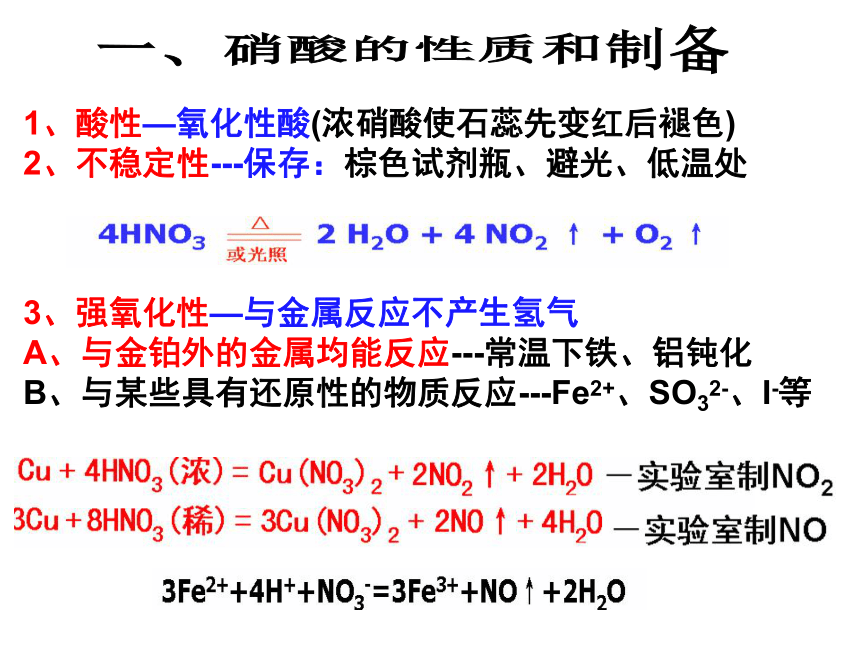
1、酸性—氧化性酸(浓硝酸使石蕊先变红后褪色)
2、不稳定性---保存:棕色试剂瓶、避光、低温处
3、强氧化性—与金属反应不产生氢气
A、与金铂外的金属均能反应---常温下铁、铝钝化
B、与某些具有还原性的物质反应---Fe2+、SO32-、I-等
一、硝酸的性质和制备
注意:
(1)单独的NO3— 几乎没有啥氧化性
(2) H+ +NO3— 就是硝酸,氧化性强,
和Fe2+ HSO3— SO32— I— S2—等还原性很强的离子不共存
一、硝酸的性质和制备
[问题6]硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等,工业上制备硝酸的原理如下图所示,写出每一步反应的化学方程式,并分析每一步反应中物质类别和氮元素化合价的变化情况。
[问题7]阅读必修二教材第16页了解什么叫酸雨、形成酸雨的原因、酸雨有哪些危害?如何防止形成酸雨?
A、酸雨:硫酸型酸雨---煤、石油和某些金属硫化物燃烧或冶炼时产生SO2;硝酸型酸雨---机动车发动机中燃烧产生的高温条件使空气中的氮气与氧气反应生成NxOy。
B、危害:损伤农作物、破坏森林和草原、使土壤、湖泊酸化、加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀等。
硝酸型酸雨产生的原因:
硫酸型酸雨产生的原因:
3NO2+H2O=2HNO3+NO
酸雨产生的原理:
D
C
课堂练习
D
C
第二节、氮及其化合物
第二部分:氨和铵盐
[问题1]右侧试剂瓶中的液体是刚从左侧保存着的试剂瓶中倒出来的浓硝酸,预测浓硝酸可能具有的物理性质?
硝酸的物理性质:无色、易挥发、有刺激性气味的液体、易溶于水;
---与盐酸相似
一、硝酸的性质和制备
[问题2]浓硝酸和浓盐酸的保存有何不同,推测可能的原因?浓硝酸久置后呈黄色,为什么?如何除去黄色?
A、不稳定性:光照或受热易分解---浓硝酸贮存在棕色细口瓶中并避光、低温
[问题3]在实验室,保存浓硝酸的试剂瓶通常用玻璃塞而不用橡胶塞,推测可能的原因?
一、硝酸的性质和制备
[实验5-8]向两支具支试管中分别加入2毫升浓硝酸与稀硝酸,用橡胶塞塞住试管口,并使铜丝与硝酸接触,观察并比较实验现象的差异。向上拉铜丝,终止反应,推测可能发生的反应方程式。
反应物
实验现象
铜丝与
浓硝酸
铜丝与
稀硝酸
反应剧烈、铜丝逐渐变细、溶液呈绿色、试管上方出现红棕色气体。
反应缓慢,铜丝逐渐溶解、溶液呈蓝色、试管上方气体呈淡红棕色,后逐渐变无色。
该实验步骤的好处:利用Cu与浓硝酸反应生成的NO2排出具支试管中的空气,有利于观察Cu与稀硝酸反应产物
一、硝酸的性质和制备
[问题4]用等质量铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:A、两者颜色不同的原因,是因为Cu2+浓度差异引起的。B、前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。你认为上述看法 (“A”或“B”)合理。若是A合理,说明理由,若是B合理,设计一个简单实验证明: 。
B合理---铜质量相等,硝酸足量,硝酸铜浓度相同
实验方案:往蓝色溶液中通入NO2,溶液由蓝色变为绿色;或加热绿色溶液,有红棕色气体产生,溶液变成蓝色;
必修二教材第18页练习与应用习题6
一、硝酸的性质和制备
一、硝酸的性质和制备
[问题5]铜与浓、稀硝酸均可反应,但常温下常用铁或铝制容器来盛装浓硝酸或浓硫酸,你知道原因吗?
浓硝酸和浓盐酸按体积比为1∶3混合得到的混合物叫做王水,王水能使不溶于硝酸的金属如金、铂等溶解。
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
1、酸性—氧化性酸(浓硝酸使石蕊先变红后褪色)
2、不稳定性---保存:棕色试剂瓶、避光、低温处
3、强氧化性—与金属反应不产生氢气
A、与金铂外的金属均能反应---常温下铁、铝钝化
B、与某些具有还原性的物质反应---Fe2+、SO32-、I-等
一、硝酸的性质和制备
注意:
(1)单独的NO3— 几乎没有啥氧化性
(2) H+ +NO3— 就是硝酸,氧化性强,
和Fe2+ HSO3— SO32— I— S2—等还原性很强的离子不共存
一、硝酸的性质和制备
[问题6]硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等,工业上制备硝酸的原理如下图所示,写出每一步反应的化学方程式,并分析每一步反应中物质类别和氮元素化合价的变化情况。
[问题7]阅读必修二教材第16页了解什么叫酸雨、形成酸雨的原因、酸雨有哪些危害?如何防止形成酸雨?
A、酸雨:硫酸型酸雨---煤、石油和某些金属硫化物燃烧或冶炼时产生SO2;硝酸型酸雨---机动车发动机中燃烧产生的高温条件使空气中的氮气与氧气反应生成NxOy。
B、危害:损伤农作物、破坏森林和草原、使土壤、湖泊酸化、加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀等。
硝酸型酸雨产生的原因:
硫酸型酸雨产生的原因:
3NO2+H2O=2HNO3+NO
酸雨产生的原理:
D
C
课堂练习
D
C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
