2020—2021学年高中化学人教必修二课件-2.3化学反应的速率和限度
文档属性
| 名称 | 2020—2021学年高中化学人教必修二课件-2.3化学反应的速率和限度 |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-03 20:51:16 | ||
图片预览





文档简介
(共27张PPT)
第三节 化学反应的速率和限度
1、掌握可逆反应的定义;
2、了解化学平衡的含义;
2、掌握化学平衡的特点与判断标志。
2SO2
+
18O2
2SO3
看我的化学动画新魔术
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词破解这个动画魔术吗?
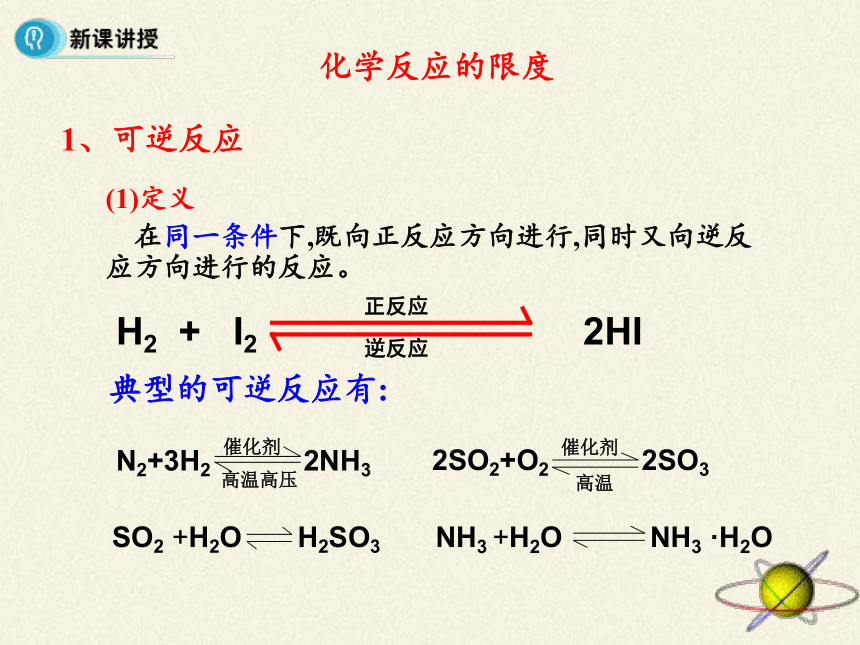
1、可逆反应
(1)定义
在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应。
典型的可逆反应有:
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
H2
+
I2
2HI
正反应
逆反应
化学反应的限度
(1)水的生成(H2+O2)与电解,
(2)二次电池的放电与充电,
(3)CO2和H2O在植物中通过光合作用合成糖与糖在体内氧化生成CO2和H2O,
它们是否属于“可逆反应”?
可逆反应有什么特点?
(2)特点
双向性、同时性、共存性
2SO2
+
18O2
2SO3
?
1、可逆反应中反应物能否完全转化为生成物?
不能!
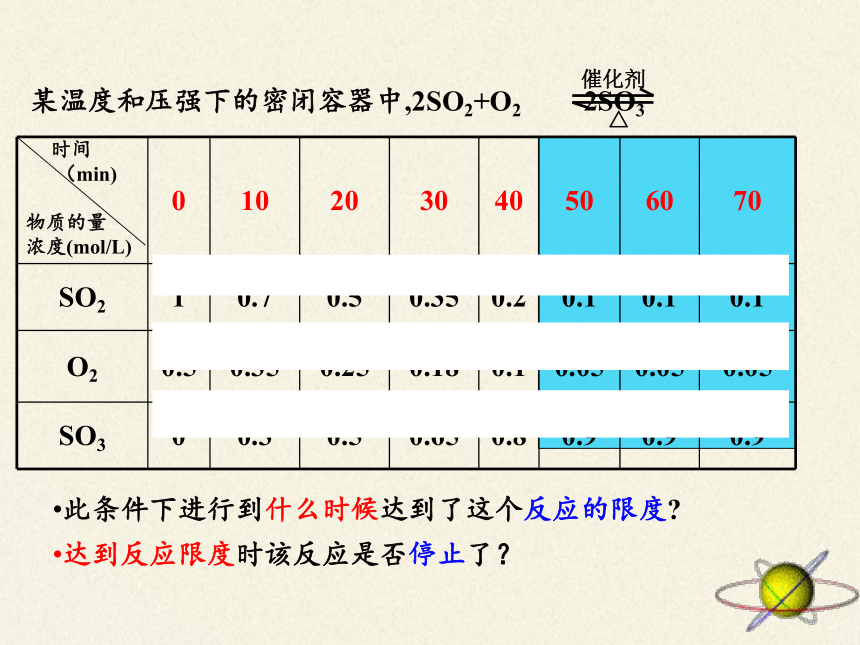
某温度和压强下的密闭容器中,2SO2+O2
2SO3
△
催化剂
时间
(min)
物质的量
浓度(mol/L)
0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
此条件下进行到什么时候达到了这个反应的限度?
达到反应限度时该反应是否停止了?
2SO2
+
O2
2SO3
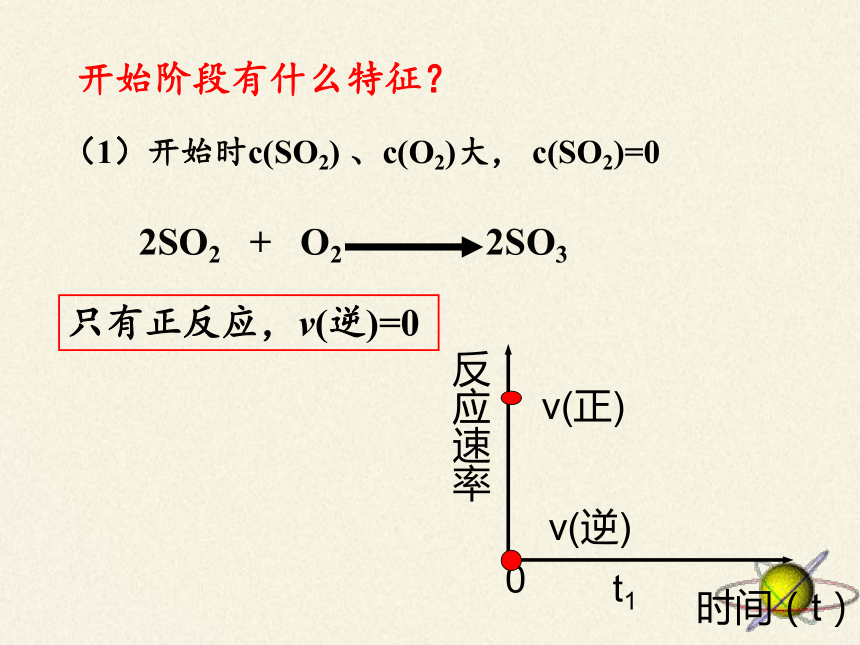
(1)开始时c(SO2)
、c(O2)大,
c(SO2)=0
开始阶段有什么特征?
只有正反应,v(逆)=0
反应速率
v(正)
v(逆)
t1
时间(t)
0
(2)瞬间后c(SO2)、c(O2
)变小,c(SO3)≠0
瞬间过后有什么特征?
正逆反应都进行,v(逆)
≠0,v(正)>
v(逆)
2SO2
+
O2
2SO3
反应速率
v(正)
v(逆)
t1
时间(t)
0
c(SO2)
、c(O2
)变小
,
v(正)减小
c(SO3)
增大,v(逆)增大
(3)c(SO2)、c(O2)逐渐变小,c(SO3)逐渐增大,
三种物质的浓度达到一个特定值。
一定时间段内有什么特征?
v(正)=
v(逆)
≠0
2SO2
+
O2
2SO3
反应速率
v(正)
v(逆)
t1
时间(t)
0
1、由于v(正)=
v(逆)≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化.
2、从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。
可逆反应反应速率的特点
化学平衡与反应的限度
在给定的条件下,当一个可逆反应进行到一定
程度时,正反应速率与逆反应速率相等,反应物与
生成物浓度不再改变,达到一种表面静止的状态,
称为
“化学平衡状态”,简称化学平衡。此时,是
在给定条件下化学反应所能达到或完成的最大程
度,即该反应进行的限度。化学反应的限度决定
了反应物在该条件下的最大转化率。
转化率
=
转化的量
起始的量
×100%
量:
质量、物质的量、体积、浓度
等。
1逆:可逆反应
2等:
V(正)==V(逆)
3定:
外界条件一定,混合体系中各组分的百分含量一定,浓度不变
4动:动态平衡
5变:
条件改变,平衡被破坏,发生移动,建立新的平衡(反应所能达到的限度发生变化)。
1.反应所能达到的限度(化学平衡)
有几个主要特征?逆
等
定
动
变
(3)如何判断达到化学平衡状态?
从平衡状态的定义入手:各组分的百分含量保持不变;正反应速率等于逆反应速率。
③
颜色、混合气体的总压、总体积、总物质的量、密度、平均摩尔质量保持不变
间接标志:
①速率:v(正)=v(逆)
②各成分的含量保持不变
直接标志:
将1moLN2和3moLH2充入一密闭容器,使其在一定条件下发生反应:N2+3H2
2NH3下列哪一种状态说明反应达到平衡
1、氨气的生成速率与分解速率相等的状态
2、氮气的消耗速率与氨气的消耗速率相等
的状态
4、氮气的消耗速率与氨气的消耗速率等
于1:2的状态
3、氮气的消耗速率与氨气的生成速率等
于1:2的状态
√
√
平衡状态判断
例子
mA(g)+nB(g)
pC(g)+qD(g)
混合物体系中各成分的含量
各物质的物质的量或物质的量分数一定
各物质的质量或质量分数一定
各物质的体积或体积分数一定
平衡
平衡
平衡
压强
当m+n≠p+q时,总压强一定
当m+n=p+q时,总压强一定
平衡
不一定
反应举例
mA(g)+nB(g)
pC(g)+qD(g)
正、逆反应速率的关系
单位时间内消耗了m
molA同时生成了m
molA。即V正=V逆
单位时间内消耗了n
molB,同时生成了p
mol
C,
VA:VB:VC:VD=
m:n:p:q
V正不一定等于V逆
单位时间内生成了n
mol
B,同时消耗了q
mol
D。均指V逆
平衡
不一定
不一定
不一定
反应举例
mA(g)+nB(g)
pC(g)+qD(g)
温度
体系的温度保持一定
气体的密度
若体系的体积不变,密度一定
混合气体的平均相对分子质量
当m+n≠p+q时,平均相对分子质量一定
当m+n=p+q时,平均相对分子质量一定
其它
如体系的颜色不再变化等
平衡
平衡
不一定
平衡
不一定
有变不变可作平衡判据
将1moLN2和3moLH2充入一密闭容器,使其在一定条件下发生反应:N2+3H2
2NH3下列哪一种状态说明反应达到平衡
1、1molNH3分解,
同时0.5molN2消耗.
2、H2的浓度不再变化.
5、N2、H2、NH3总物质的量不在改变或各组分含量不再变化.
3、CN2=CH2=CNH3
4、CN2:CH2:CNH3=1:3:2
√
√
√
可逆反应O2+2SO2
2SO3的正、逆
反应速率可用各反应物或生成物浓度的
变化来表示。下列各关系中能说明反应
已达到平衡状态的是
A?
?正?SO2?=2?正?O2?
B?
?正?O2?=?逆?SO3?
C?
?正?O2?=2?逆?SO3?
D?
?正?SO2?=?逆?SO3?
D
在密闭容器中充入PCl5,发生化学反应:
PCl5(g)
PCl3(g)+
Cl2(g),
反应一段时间后又向其中加入37Cl2,在重
新达到化学平衡状态后,37Cl原子存在于
A.PCl5中
B.PCl3中
C.Cl2
D.三种物质中都有
D
练习
1.可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
D
2.对于可逆反应
M+N
Q
达到平衡状态时,下列说法正确的是(
)
A.
M、N、Q三种物质的浓度一定相等
B.
M、N全部变成了Q
C.
M、N、Q的浓度都保持不变
D.
反应已经停止
C
3.在一定温度下,可逆反应A(g)+3B(g)
2C(g)
达到平衡的标志是( )
A. A的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的浓度比为1:3:2
C
定向爆破
化学反应条件的控制
为什么要控制反应的条件:
对有利于我们的或我们需要的化学反应,要想办法增大反应速率,并提高原料的利用率或转化率。
对有害于我们的或我们不需要的化学反应,要设法降低反应的速率,或隔离会引起反应的物质。
对应用于特定环境下及特殊需要的化学反应,则需要对反应的条件进行特殊的控制。
谢
谢
第三节 化学反应的速率和限度
1、掌握可逆反应的定义;
2、了解化学平衡的含义;
2、掌握化学平衡的特点与判断标志。
2SO2
+
18O2
2SO3
看我的化学动画新魔术
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词破解这个动画魔术吗?
1、可逆反应
(1)定义
在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应。
典型的可逆反应有:
N2+3H2
2NH3
催化剂
高温高压
2SO2+O2
2SO3
催化剂
高温
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
H2
+
I2
2HI
正反应
逆反应
化学反应的限度
(1)水的生成(H2+O2)与电解,
(2)二次电池的放电与充电,
(3)CO2和H2O在植物中通过光合作用合成糖与糖在体内氧化生成CO2和H2O,
它们是否属于“可逆反应”?
可逆反应有什么特点?
(2)特点
双向性、同时性、共存性
2SO2
+
18O2
2SO3
?
1、可逆反应中反应物能否完全转化为生成物?
不能!
某温度和压强下的密闭容器中,2SO2+O2
2SO3
△
催化剂
时间
(min)
物质的量
浓度(mol/L)
0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
此条件下进行到什么时候达到了这个反应的限度?
达到反应限度时该反应是否停止了?
2SO2
+
O2
2SO3
(1)开始时c(SO2)
、c(O2)大,
c(SO2)=0
开始阶段有什么特征?
只有正反应,v(逆)=0
反应速率
v(正)
v(逆)
t1
时间(t)
0
(2)瞬间后c(SO2)、c(O2
)变小,c(SO3)≠0
瞬间过后有什么特征?
正逆反应都进行,v(逆)
≠0,v(正)>
v(逆)
2SO2
+
O2
2SO3
反应速率
v(正)
v(逆)
t1
时间(t)
0
c(SO2)
、c(O2
)变小
,
v(正)减小
c(SO3)
增大,v(逆)增大
(3)c(SO2)、c(O2)逐渐变小,c(SO3)逐渐增大,
三种物质的浓度达到一个特定值。
一定时间段内有什么特征?
v(正)=
v(逆)
≠0
2SO2
+
O2
2SO3
反应速率
v(正)
v(逆)
t1
时间(t)
0
1、由于v(正)=
v(逆)≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化.
2、从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。
可逆反应反应速率的特点
化学平衡与反应的限度
在给定的条件下,当一个可逆反应进行到一定
程度时,正反应速率与逆反应速率相等,反应物与
生成物浓度不再改变,达到一种表面静止的状态,
称为
“化学平衡状态”,简称化学平衡。此时,是
在给定条件下化学反应所能达到或完成的最大程
度,即该反应进行的限度。化学反应的限度决定
了反应物在该条件下的最大转化率。
转化率
=
转化的量
起始的量
×100%
量:
质量、物质的量、体积、浓度
等。
1逆:可逆反应
2等:
V(正)==V(逆)
3定:
外界条件一定,混合体系中各组分的百分含量一定,浓度不变
4动:动态平衡
5变:
条件改变,平衡被破坏,发生移动,建立新的平衡(反应所能达到的限度发生变化)。
1.反应所能达到的限度(化学平衡)
有几个主要特征?逆
等
定
动
变
(3)如何判断达到化学平衡状态?
从平衡状态的定义入手:各组分的百分含量保持不变;正反应速率等于逆反应速率。
③
颜色、混合气体的总压、总体积、总物质的量、密度、平均摩尔质量保持不变
间接标志:
①速率:v(正)=v(逆)
②各成分的含量保持不变
直接标志:
将1moLN2和3moLH2充入一密闭容器,使其在一定条件下发生反应:N2+3H2
2NH3下列哪一种状态说明反应达到平衡
1、氨气的生成速率与分解速率相等的状态
2、氮气的消耗速率与氨气的消耗速率相等
的状态
4、氮气的消耗速率与氨气的消耗速率等
于1:2的状态
3、氮气的消耗速率与氨气的生成速率等
于1:2的状态
√
√
平衡状态判断
例子
mA(g)+nB(g)
pC(g)+qD(g)
混合物体系中各成分的含量
各物质的物质的量或物质的量分数一定
各物质的质量或质量分数一定
各物质的体积或体积分数一定
平衡
平衡
平衡
压强
当m+n≠p+q时,总压强一定
当m+n=p+q时,总压强一定
平衡
不一定
反应举例
mA(g)+nB(g)
pC(g)+qD(g)
正、逆反应速率的关系
单位时间内消耗了m
molA同时生成了m
molA。即V正=V逆
单位时间内消耗了n
molB,同时生成了p
mol
C,
VA:VB:VC:VD=
m:n:p:q
V正不一定等于V逆
单位时间内生成了n
mol
B,同时消耗了q
mol
D。均指V逆
平衡
不一定
不一定
不一定
反应举例
mA(g)+nB(g)
pC(g)+qD(g)
温度
体系的温度保持一定
气体的密度
若体系的体积不变,密度一定
混合气体的平均相对分子质量
当m+n≠p+q时,平均相对分子质量一定
当m+n=p+q时,平均相对分子质量一定
其它
如体系的颜色不再变化等
平衡
平衡
不一定
平衡
不一定
有变不变可作平衡判据
将1moLN2和3moLH2充入一密闭容器,使其在一定条件下发生反应:N2+3H2
2NH3下列哪一种状态说明反应达到平衡
1、1molNH3分解,
同时0.5molN2消耗.
2、H2的浓度不再变化.
5、N2、H2、NH3总物质的量不在改变或各组分含量不再变化.
3、CN2=CH2=CNH3
4、CN2:CH2:CNH3=1:3:2
√
√
√
可逆反应O2+2SO2
2SO3的正、逆
反应速率可用各反应物或生成物浓度的
变化来表示。下列各关系中能说明反应
已达到平衡状态的是
A?
?正?SO2?=2?正?O2?
B?
?正?O2?=?逆?SO3?
C?
?正?O2?=2?逆?SO3?
D?
?正?SO2?=?逆?SO3?
D
在密闭容器中充入PCl5,发生化学反应:
PCl5(g)
PCl3(g)+
Cl2(g),
反应一段时间后又向其中加入37Cl2,在重
新达到化学平衡状态后,37Cl原子存在于
A.PCl5中
B.PCl3中
C.Cl2
D.三种物质中都有
D
练习
1.可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
D
2.对于可逆反应
M+N
Q
达到平衡状态时,下列说法正确的是(
)
A.
M、N、Q三种物质的浓度一定相等
B.
M、N全部变成了Q
C.
M、N、Q的浓度都保持不变
D.
反应已经停止
C
3.在一定温度下,可逆反应A(g)+3B(g)
2C(g)
达到平衡的标志是( )
A. A的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的浓度比为1:3:2
C
定向爆破
化学反应条件的控制
为什么要控制反应的条件:
对有利于我们的或我们需要的化学反应,要想办法增大反应速率,并提高原料的利用率或转化率。
对有害于我们的或我们不需要的化学反应,要设法降低反应的速率,或隔离会引起反应的物质。
对应用于特定环境下及特殊需要的化学反应,则需要对反应的条件进行特殊的控制。
谢
谢
