山东省青岛市即墨区2020-2021学年高二上学期期中考试化学试题 Word版含答案
文档属性
| 名称 | 山东省青岛市即墨区2020-2021学年高二上学期期中考试化学试题 Word版含答案 |
|
|
| 格式 | doc | ||
| 文件大小 | 1018.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-04 00:00:00 | ||
图片预览



文档简介
即墨市2020-2021学年度
期中模块高二化学试题
2020.11
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分。考试时间90分钟。
可用到的相对原子质量: H 1 C 12 O 16 N 14 S 32 Mg 24 Cu 64 Fe 56
第Ⅰ卷(选择题,共40分)
一、单项选择题(共10小题,每个小题2分,每小题只有一个正确选项)
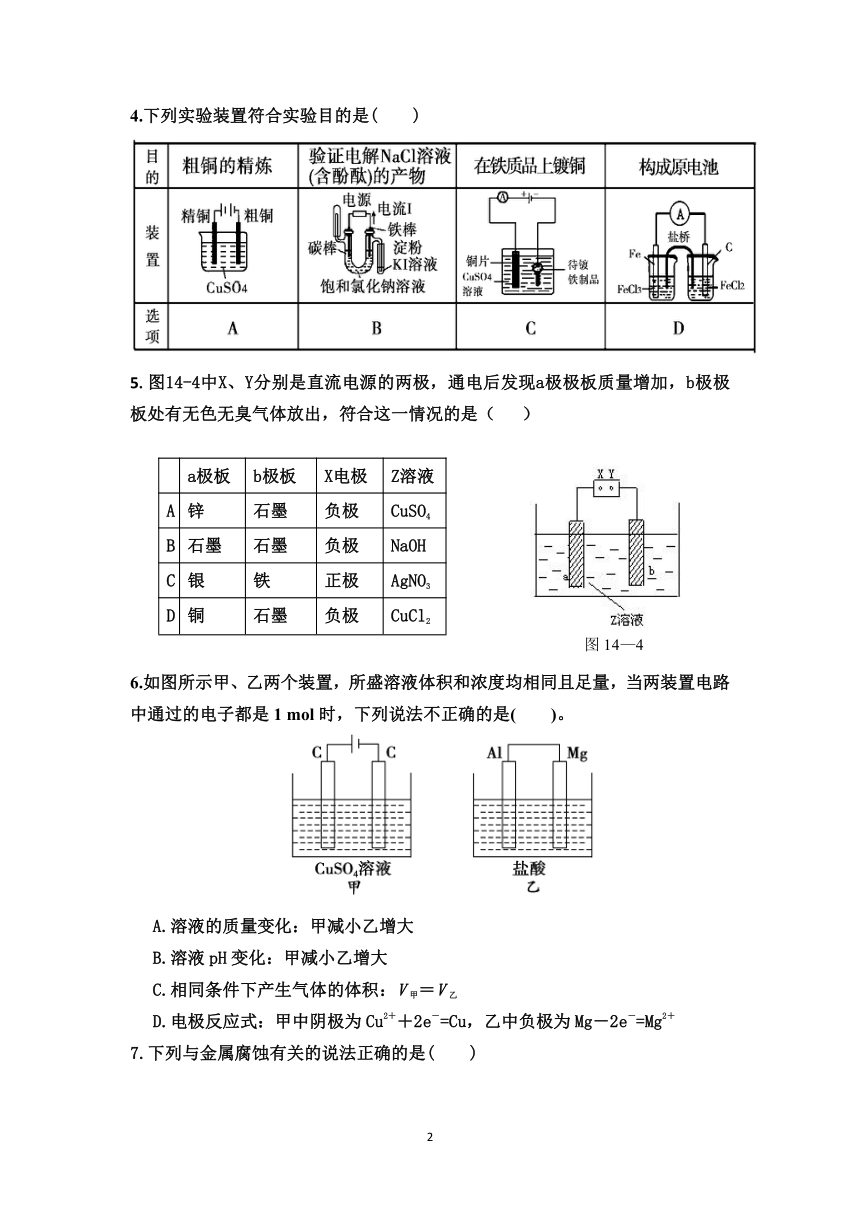
1.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )。
2.已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )
A.该反应的进行一定需要加热
B.该反应的ΔH=-(E1-E2)kJ·mol-1
C.断裂1 molA—A键和2 mol B—B键,放出E1 kJ能量
D.该反应为吸热反应
3.将Fe片和Zn片放在盛有NaCl溶液(其中滴有酚酞溶液)的表面皿上,如图所示,最先观察到变为红色的区域为( )
A.Ⅰ 和 Ⅲ
B.Ⅰ 和 Ⅳ
C.Ⅱ 和 Ⅲ
D.Ⅱ 和 Ⅳ
4.下列实验装置符合实验目的是( )
5.图14-4中X、Y分别是直流电源的两极,通电后发现a极极板质量增加,b极极板处有无色无臭气体放出,符合这一情况的是( )
a极板 b极板 X电极 Z溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
6.如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是( )。
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-=Cu,乙中负极为Mg-2e-=Mg2+
7.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
8.下列热化学方程式,正确的是( )
A.甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
9.某高能电池以磷酸溶液作为电解质溶液,利用乙烯直接氧化法制乙酸,其总反应式为CH2=CH2+O2=CH3COOH。某兴趣小组将该反应设计成如图所示的燃料电池,下列有关说法正确的是( )
A.在电池工作过程中,溶液中的PO43-向正极移动
B.电子移动方向:电极a→磷酸溶液→电极b
C.负极的电极反应式为CH2=CH2-4e-+2H2O=CH3COOH+4H+
D.当电路中通过0.04mol电子时,参加反应的CH2=CH2为224mL
10.在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+ SO2(g)=S2(g)+2H2O(g) △H2
H2S(g)+ O2(g)=S(g)+H2O(g) △H3 , 2S(g)=S2(g) △H4
则△H4的正确表达式为
A.△H4=(△H1+△H2-3△H3) B.△H4=(3△H3-△H1-△H2)
C.△H4=(△H1+△H2-3△H3) D.△H4=(△H1-△H2-3△H3)
二.不定项选择题(本小题共5小题,每小题4分,共20分,每小题有一个或2个符合题意,全部选对得4分,选对但不全得2分,选错不得分)
11.下列关于实验现象的描述不正确的是( )
A.把Cu片和Fe片紧靠在一起浸入稀硫酸中,Cu片表面出现气泡
B.用Zn片做阳极,Fe片做阴极,电解饱和ZnCl2溶液,Fe片表面出现一层锌
C.把Cu片浸入FeCl3溶液中,在Cu片表面出现一层铁
D.把Zn粒放入装有稀盐酸的试管中,加入几滴CuCl2溶液,放出气泡的速率减慢
12.肼(N2H4)/空气燃料电池的能量转化率高,装置如图所示。电池放电时,电流由铜极经外电路流向铂极。下列说法错误的是( )
A.在铜极区填充空气
B.放电过程中,OH-向铂极迁移
C.负极反应式为N2H4—4e-=N2+4H+
D.放电过程中,铂极附近溶液pH降低
13.pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,停止电解,取出电极,将溶液摇匀,测得溶液的pH>a,则该电解质溶液是( )
A.K2SO4 B.NaOH C.NaCl D.AgNO3
4.人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH
15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述正确的是( )
A.放电时正极附近溶液的PH减小
B.充电时阳极反应为:Fe(OH)3 —3e—+ 5 OH— = FeO + 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
第II卷(非选择题,共60分)
16.(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③ 2H2(g)、?+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
根据以上三个热化学方程式,计算 C(s,石墨)+2H2(g)===CH4(g)的反应热ΔH为____________。
(3)如图,当线路接通时,发现M(滴有酚酞的K2SO4溶液浸润过得滤纸)a端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。回答下列问题:
①甲、乙分别是什么装置? ? 、? ? 。
②写出C的电极名称和电极反应式 ? ? ;? ?? ?? ?? 。
17.如图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200mL.
①装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为 .
②乙装置中a极上的电极反应式为 .若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4 mL(标准状况),乙装置中所得溶液的pH如何变化_______(变大、变小、不变)。
20.从NO3-、SO42-、Cl-、H+、Cu2+、Ba2+、Ag+ 等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
(1)两极分别放出H2和O2时,电解质的化学式可能是________________(只写一种即可,下同);
(2)若阴极析出金属,阳极放出O2,电解质的化学式可能是__________________;
(3)两极分别放出气体,气体体积为1﹕1(同温同压),电解质的化学式可能是______________;
高二化学期中试题参考答案 2020.11
一、单项选择题(共40分)
1 2 3 4 5 6 7 8
D D B C A C B B
9 10 11 12 13 14 15
C A CD C BC C BD
二、填空题(共60分)
16.(1)NO2(g)+ CO(g)=NO(g)+ CO2(g) △H=﹣234 kJ/mol
(2)-74.8kJ/mol
(3)①原电池;电解池 ②阳极;4OH- -4e- =O2+2H2O或2H2O-4e- =O2+4H+
17.(1)CH4 ; O2+4e- + 2CO2=2CO32- ;
(2)4OH- -4e- =O2+2H2O或2H2O-4e- =O2+4H+ ;56;变小
18.(1)①负;HCHO-4e-+ 6OH-= CO32-+4H2O
②2Cu2++2H2O 2Cu+4H++O2↑;3.1;1.45
(2)2SO2+4H2O-4e-=2SO42-+8H+;
O2+4H++4e-=2H2O
(1)①2NH3-6e- +6OH- =N2+6H2O;②Fe;③16.8;④阴极;2NO2- + 6e-+4H2O =N2+8OH-
(1)H2SO4 / HNO3/Ba(NO3)2 (2)CuSO4/AgNO3 (3)HCl
期中模块高二化学试题
2020.11
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分。考试时间90分钟。
可用到的相对原子质量: H 1 C 12 O 16 N 14 S 32 Mg 24 Cu 64 Fe 56
第Ⅰ卷(选择题,共40分)
一、单项选择题(共10小题,每个小题2分,每小题只有一个正确选项)
1.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )。
2.已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )
A.该反应的进行一定需要加热
B.该反应的ΔH=-(E1-E2)kJ·mol-1
C.断裂1 molA—A键和2 mol B—B键,放出E1 kJ能量
D.该反应为吸热反应
3.将Fe片和Zn片放在盛有NaCl溶液(其中滴有酚酞溶液)的表面皿上,如图所示,最先观察到变为红色的区域为( )
A.Ⅰ 和 Ⅲ
B.Ⅰ 和 Ⅳ
C.Ⅱ 和 Ⅲ
D.Ⅱ 和 Ⅳ
4.下列实验装置符合实验目的是( )
5.图14-4中X、Y分别是直流电源的两极,通电后发现a极极板质量增加,b极极板处有无色无臭气体放出,符合这一情况的是( )
a极板 b极板 X电极 Z溶液
A 锌 石墨 负极 CuSO4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO3
D 铜 石墨 负极 CuCl2
6.如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是( )。
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-=Cu,乙中负极为Mg-2e-=Mg2+
7.下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
8.下列热化学方程式,正确的是( )
A.甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
9.某高能电池以磷酸溶液作为电解质溶液,利用乙烯直接氧化法制乙酸,其总反应式为CH2=CH2+O2=CH3COOH。某兴趣小组将该反应设计成如图所示的燃料电池,下列有关说法正确的是( )
A.在电池工作过程中,溶液中的PO43-向正极移动
B.电子移动方向:电极a→磷酸溶液→电极b
C.负极的电极反应式为CH2=CH2-4e-+2H2O=CH3COOH+4H+
D.当电路中通过0.04mol电子时,参加反应的CH2=CH2为224mL
10.在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+ SO2(g)=S2(g)+2H2O(g) △H2
H2S(g)+ O2(g)=S(g)+H2O(g) △H3 , 2S(g)=S2(g) △H4
则△H4的正确表达式为
A.△H4=(△H1+△H2-3△H3) B.△H4=(3△H3-△H1-△H2)
C.△H4=(△H1+△H2-3△H3) D.△H4=(△H1-△H2-3△H3)
二.不定项选择题(本小题共5小题,每小题4分,共20分,每小题有一个或2个符合题意,全部选对得4分,选对但不全得2分,选错不得分)
11.下列关于实验现象的描述不正确的是( )
A.把Cu片和Fe片紧靠在一起浸入稀硫酸中,Cu片表面出现气泡
B.用Zn片做阳极,Fe片做阴极,电解饱和ZnCl2溶液,Fe片表面出现一层锌
C.把Cu片浸入FeCl3溶液中,在Cu片表面出现一层铁
D.把Zn粒放入装有稀盐酸的试管中,加入几滴CuCl2溶液,放出气泡的速率减慢
12.肼(N2H4)/空气燃料电池的能量转化率高,装置如图所示。电池放电时,电流由铜极经外电路流向铂极。下列说法错误的是( )
A.在铜极区填充空气
B.放电过程中,OH-向铂极迁移
C.负极反应式为N2H4—4e-=N2+4H+
D.放电过程中,铂极附近溶液pH降低
13.pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,停止电解,取出电极,将溶液摇匀,测得溶液的pH>a,则该电解质溶液是( )
A.K2SO4 B.NaOH C.NaCl D.AgNO3
4.人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH
15.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述正确的是( )
A.放电时正极附近溶液的PH减小
B.充电时阳极反应为:Fe(OH)3 —3e—+ 5 OH— = FeO + 4H2O
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
第II卷(非选择题,共60分)
16.(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③ 2H2(g)、?+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
根据以上三个热化学方程式,计算 C(s,石墨)+2H2(g)===CH4(g)的反应热ΔH为____________。
(3)如图,当线路接通时,发现M(滴有酚酞的K2SO4溶液浸润过得滤纸)a端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。回答下列问题:
①甲、乙分别是什么装置? ? 、? ? 。
②写出C的电极名称和电极反应式 ? ? ;? ?? ?? ?? 。
17.如图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200mL.
①装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为 .
②乙装置中a极上的电极反应式为 .若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4 mL(标准状况),乙装置中所得溶液的pH如何变化_______(变大、变小、不变)。
20.从NO3-、SO42-、Cl-、H+、Cu2+、Ba2+、Ag+ 等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
(1)两极分别放出H2和O2时,电解质的化学式可能是________________(只写一种即可,下同);
(2)若阴极析出金属,阳极放出O2,电解质的化学式可能是__________________;
(3)两极分别放出气体,气体体积为1﹕1(同温同压),电解质的化学式可能是______________;
高二化学期中试题参考答案 2020.11
一、单项选择题(共40分)
1 2 3 4 5 6 7 8
D D B C A C B B
9 10 11 12 13 14 15
C A CD C BC C BD
二、填空题(共60分)
16.(1)NO2(g)+ CO(g)=NO(g)+ CO2(g) △H=﹣234 kJ/mol
(2)-74.8kJ/mol
(3)①原电池;电解池 ②阳极;4OH- -4e- =O2+2H2O或2H2O-4e- =O2+4H+
17.(1)CH4 ; O2+4e- + 2CO2=2CO32- ;
(2)4OH- -4e- =O2+2H2O或2H2O-4e- =O2+4H+ ;56;变小
18.(1)①负;HCHO-4e-+ 6OH-= CO32-+4H2O
②2Cu2++2H2O 2Cu+4H++O2↑;3.1;1.45
(2)2SO2+4H2O-4e-=2SO42-+8H+;
O2+4H++4e-=2H2O
(1)①2NH3-6e- +6OH- =N2+6H2O;②Fe;③16.8;④阴极;2NO2- + 6e-+4H2O =N2+8OH-
(1)H2SO4 / HNO3/Ba(NO3)2 (2)CuSO4/AgNO3 (3)HCl
同课章节目录
