2020-2021学年九年级化学人教版下册 9.3溶液的浓度同步练习 有答案
文档属性
| 名称 | 2020-2021学年九年级化学人教版下册 9.3溶液的浓度同步练习 有答案 | 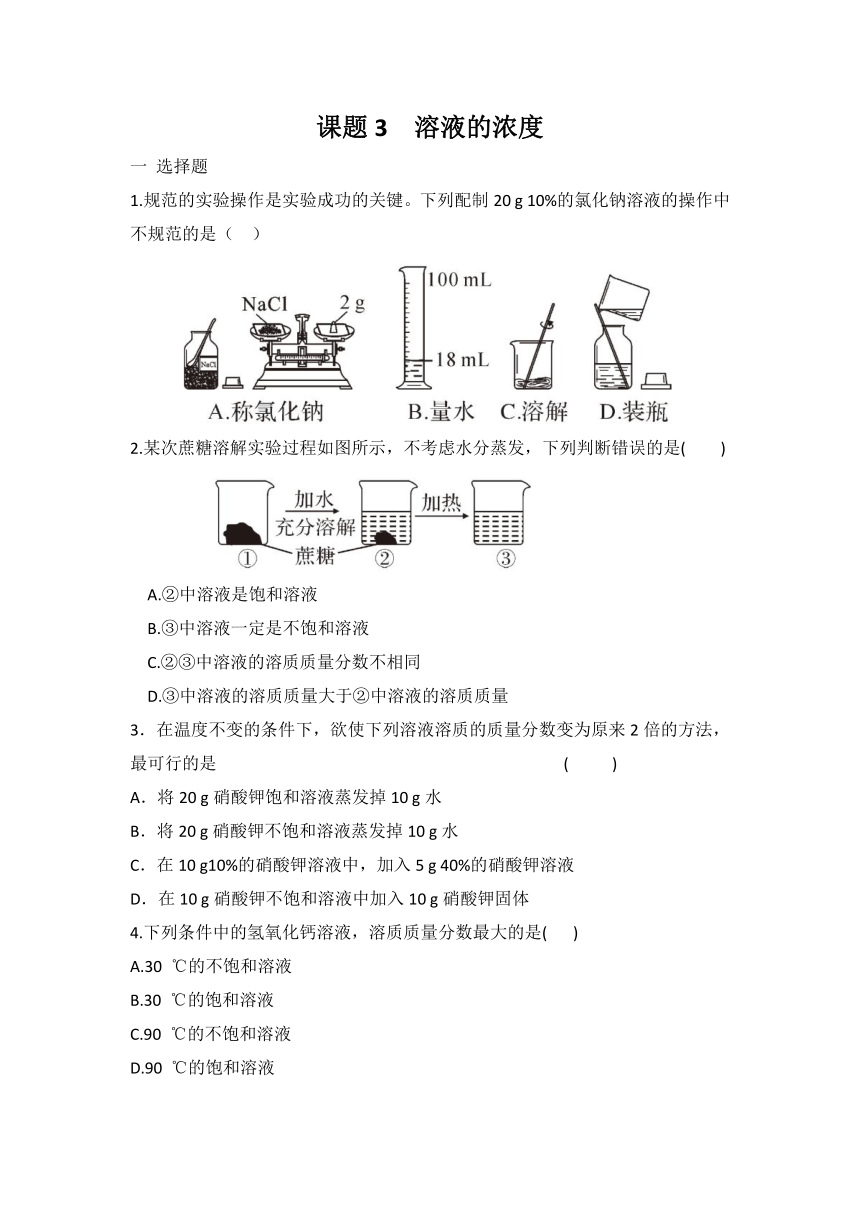 | |
| 格式 | doc | ||
| 文件大小 | 250.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-03 22:19:59 | ||
图片预览


文档简介
课题3 溶液的浓度
一 选择题
1.规范的实验操作是实验成功的关键。下列配制20 g 10%的氯化钠溶液的操作中不规范的是( )
2.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
3.在温度不变的条件下,欲使下列溶液溶质的质量分数变为原来2倍的方法,最可行的是 ( )
A.将20 g硝酸钾饱和溶液蒸发掉10 g水
B.将20 g硝酸钾不饱和溶液蒸发掉10 g水
C.在10 g10%的硝酸钾溶液中,加入5 g 40%的硝酸钾溶液
D.在10 g硝酸钾不饱和溶液中加入10 g硝酸钾固体
4.下列条件中的氢氧化钙溶液,溶质质量分数最大的是( )
A.30 ℃的不饱和溶液
B.30 ℃的饱和溶液
C.90 ℃的不饱和溶液
D.90 ℃的饱和溶液
5.某同学用25 ℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解。然后该同学又用酒精灯加热至60 ℃,固体全部溶解。那么在加热前后,以下各项没有发生改变的是( )
A.NaCl的溶解度 B.溶质的质量
C.溶剂的质量 D.溶质的质量分数
6.电解水时,常在水中加入少量的硫酸以增强水的导电性。现用25 g质量分数为8%的硫酸进行电解水的实验,过一段时间后,测得硫酸溶液中溶质的质量分数为10%,则被电解的水的质量为( )
A.1 g B.2 g C.3 g D.5 g
二 非选择题
1.已知Si+2NaOH+H2O===Na2SiO3+2H2↑,向100 g NaOH溶液中加入足量Si,充分反应后生成0.4 g H2。求该NaOH溶液中溶质的质量分数。
2.如图所示,往水电解器中加入96 g蒸馏水和2 g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2 g气体时,停止实验。计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中Na2SO4的质量分数是多少?
3.CuSO4溶液对过氧化氢的分解有催化作用。取溶质质量分数为8.5%的过氧化氢溶液20 g倒入小烧杯中,向其中加入溶质质量为0.75 g的CuSO4溶液10.8 g,使过氧化氢完全分解。试计算:
(1)产生氧气的质量;
(2)反应后所得溶液中CuSO4的质量分数。
4.马英同学取某地石灰石样品12 g进行测定实验,现将100 g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:
试求:
(1)m的值为______g。
(2)12 g石灰石样品中碳酸钙的质量等于______g。
(3)反应完全后最终溶液中氯化钙的质量分数。
5.请你仔细分析如图所示的实验过程和提供的数据,并进行计算。
(1)生成氢气_______g。
(2)反应后所得溶液中溶质的质量分数是多少?(写出计算过程)
6.有关资料介绍,制取氧气有多种方法,其中氧化铜与氯酸钾混合加热,也能很快产生氧气,现将2.5 g氧化铜与24.5 g氯酸钾的混合物充分加热,残余固体经冷却、称量,质量为17.4 g。然后将固体溶于65.1 g水中,充分搅拌,过滤得到滤液和黑色的滤渣。滤渣又经过洗涤,烘干,称量,质量为2.5 g。(不考虑过程中物质的损失,计算结果保留一位小数)
(1)该反应中氧化铜起________作用。
(2)生成的氧气为_______g。
(3)所得滤液中溶质是__________,其质量分数为_________。
(4)向所得滤液中加入质量分数为16%的AgNO3溶液恰好完全反应,需AgNO3溶液的质量为多少?(列出必要的计算过程)(已知:KCl+AgNO3===AgCl↓+KNO3)
参考答案
一 选择题
BBCBCD
二 非选择题
1.
2.
3.
4.3.3 10
0.4
6.催化 9.6 氯化钾 18.6%
一 选择题
1.规范的实验操作是实验成功的关键。下列配制20 g 10%的氯化钠溶液的操作中不规范的是( )
2.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是( )
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
3.在温度不变的条件下,欲使下列溶液溶质的质量分数变为原来2倍的方法,最可行的是 ( )
A.将20 g硝酸钾饱和溶液蒸发掉10 g水
B.将20 g硝酸钾不饱和溶液蒸发掉10 g水
C.在10 g10%的硝酸钾溶液中,加入5 g 40%的硝酸钾溶液
D.在10 g硝酸钾不饱和溶液中加入10 g硝酸钾固体
4.下列条件中的氢氧化钙溶液,溶质质量分数最大的是( )
A.30 ℃的不饱和溶液
B.30 ℃的饱和溶液
C.90 ℃的不饱和溶液
D.90 ℃的饱和溶液
5.某同学用25 ℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解。然后该同学又用酒精灯加热至60 ℃,固体全部溶解。那么在加热前后,以下各项没有发生改变的是( )
A.NaCl的溶解度 B.溶质的质量
C.溶剂的质量 D.溶质的质量分数
6.电解水时,常在水中加入少量的硫酸以增强水的导电性。现用25 g质量分数为8%的硫酸进行电解水的实验,过一段时间后,测得硫酸溶液中溶质的质量分数为10%,则被电解的水的质量为( )
A.1 g B.2 g C.3 g D.5 g
二 非选择题
1.已知Si+2NaOH+H2O===Na2SiO3+2H2↑,向100 g NaOH溶液中加入足量Si,充分反应后生成0.4 g H2。求该NaOH溶液中溶质的质量分数。
2.如图所示,往水电解器中加入96 g蒸馏水和2 g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2 g气体时,停止实验。计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中Na2SO4的质量分数是多少?
3.CuSO4溶液对过氧化氢的分解有催化作用。取溶质质量分数为8.5%的过氧化氢溶液20 g倒入小烧杯中,向其中加入溶质质量为0.75 g的CuSO4溶液10.8 g,使过氧化氢完全分解。试计算:
(1)产生氧气的质量;
(2)反应后所得溶液中CuSO4的质量分数。
4.马英同学取某地石灰石样品12 g进行测定实验,现将100 g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:
试求:
(1)m的值为______g。
(2)12 g石灰石样品中碳酸钙的质量等于______g。
(3)反应完全后最终溶液中氯化钙的质量分数。
5.请你仔细分析如图所示的实验过程和提供的数据,并进行计算。
(1)生成氢气_______g。
(2)反应后所得溶液中溶质的质量分数是多少?(写出计算过程)
6.有关资料介绍,制取氧气有多种方法,其中氧化铜与氯酸钾混合加热,也能很快产生氧气,现将2.5 g氧化铜与24.5 g氯酸钾的混合物充分加热,残余固体经冷却、称量,质量为17.4 g。然后将固体溶于65.1 g水中,充分搅拌,过滤得到滤液和黑色的滤渣。滤渣又经过洗涤,烘干,称量,质量为2.5 g。(不考虑过程中物质的损失,计算结果保留一位小数)
(1)该反应中氧化铜起________作用。
(2)生成的氧气为_______g。
(3)所得滤液中溶质是__________,其质量分数为_________。
(4)向所得滤液中加入质量分数为16%的AgNO3溶液恰好完全反应,需AgNO3溶液的质量为多少?(列出必要的计算过程)(已知:KCl+AgNO3===AgCl↓+KNO3)
参考答案
一 选择题
BBCBCD
二 非选择题
1.
2.
3.
4.3.3 10
0.4
6.催化 9.6 氯化钾 18.6%
同课章节目录
