上海市长宁区2012届高三第一学期期末质量抽测(化学)
文档属性
| 名称 | 上海市长宁区2012届高三第一学期期末质量抽测(化学) |

|
|
| 格式 | zip | ||
| 文件大小 | 314.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 11:56:31 | ||
图片预览



文档简介
2011学年第一学期高三化学期终质量抽测试卷
满分l50分,考试时间120分钟。
相对原子质量:
H-1 C-12 N-14 O-16 P-31 S-32 Cl-35.5 Na-23 Mg-24 Al-27 K-39 Fe-56
第I卷 (共66分)
一、选择题(本题共10分,每小题2分,只有一个正确选项,答案涂写在答题卷上)
1. 化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①研发易降解的生物农药;②推广使用节能环保材料。③田间焚烧秸秆;④应用高效洁净的能源转换技术;⑤加快化石燃料的开采与使用;
A. ①②④ B.②③⑤ C. ①③⑤ D.②④⑤
2.下列有关化学用语表示正确的是
A. 水分子的球棍模型: B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子: I D.N2的电子式:
3. 下列“化学与生活”的说法错误的是
A.硫酸钡可用作白色颜料 B.石膏可用来调节水泥的凝固时间
C.明矾可用于水的消毒、杀菌 D.醋可用于除去暖水瓶中的水垢
4. 下列叙述正确的是
A. 金属晶体的硬度高于离子晶体
B. K、Zn分别与稀硫酸反应所得溶液均呈中性
C. Fe分别与氯气和稀盐酸反应所得氯化物相同
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强
5.下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
二、选择题(本题共36分,每小题3分,只有一个正确选项,答案涂写在答题卡上)
6. 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
7. 下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生成的是
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. KClO3和K2SO4 D. Na2SO3和BaCO3
8. 下列各组有机物只用一种试剂无法鉴别的是
A.甲苯、乙醇、溴苯 B.苯、甲苯、环己烷
C.甲酸、乙醛、乙酸 D.苯、苯酚、己烯
9. 下列实验设计和结论相符的是
A. 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
B. 将SO2通入溴水,溴水褪色后加热恢复原色 ,说明SO2漂白生成的物质不稳定。
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D. 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH
10. 硫代硫酸钠溶液与盐酸反应,可用于探究浓度对于反应速率的影响。常温常压下,若该反应产生固体单质16 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
二氧化硫 硫代硫酸钠 转移的电子
A 1mol NA
B 11.2L 0.5mol
C 158 g 2mol
D 79 g 1NA
11. 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
A. 该物质既有氧化性又有还原性
B.分子中四个氮原子共平面
C. 该物质属于盐类
D.15.2g该物质含有6.02×1022个原子
12. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s)+ Q,体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)不变
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应Q 0
D.c(Pb2+)一线表示正反应快慢, c(Sn2+)一线表示逆反应的快慢
13.根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
A.c(HCO3-)> c(ClO-)> c(OH-)
B.c(ClO-)> c(HCO3-)> c(H+)
C.c(ClO-)+ c(HClO)= c(HCO3-)+ c(H2CO3)
D.c(Na+)+ c(H+)= c(HCO3-)+ c(ClO-)+c(OH-)
14. 中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示:
下列叙述正确的是
A. 该化合物属于苯的同系物 B.1 mol M最多能与2mol 发生反应
C.M与足量的溶液发生反应时,所得有机产物的化学式为
D.1mol M与足量反应能生成2 mol
15.常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
B.甲基橙呈黄色的溶液: I- 、 Ba2+、AlO2-、Cl-
C. c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
D. 1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
16. SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g) →SF6(g)+ Q的反应热Q为
A. 1780kJ B. 1220 kJ
C.450 kJ D. -430 kJ
17. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
A.液滴下氧气含量少,发生析氢腐蚀
B.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
C.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e→4OH-
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e→Cu2+
三、选择题(本题共20分,每小题4分,每小题有一个或两个正确选项,只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分)
第Ⅱ卷(共84分)
18.含有1 mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2后,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=1.5,2Fe2++4Br-+3Cl2→2Br2+2Fe3++6Cl-
B. x=1.2,Fe2++2Br-+2Cl2→Br2+Fe3++4Cl-
C.x=0.6,2Br-+ Cl2→Br2+2Cl-
D. x=0.4,2Fe2++Cl2→2Fe3++2Cl-
19.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作 现象 结论
A 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液 红色褪去 产生了乙烯
B 滴加氯水和CCl4,振荡、静置 下层溶液显紫色 原溶液中有I-
C 向饱和Na2CO3溶液中通入足量CO2 溶液变浑浊 析出了NaHCO3
D 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH4+
20短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
21.室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)= c(NH4+)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
22.将NaOH溶液加入到13.2g含有(NH4)2SO4与(NH4)2CO3的固体混合物中,充分反应后,可收集到密度为17 g/22.4 L的气体体积不可能是
A.4.68L B.4.3 L
C.6.16L D.5.2L
四、(本题共24分)
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
23.T的离子结构示意图为_______.
24.元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
25. W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为____ _.
26.原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________ .
27.R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________
I、磷、硫元素的单质和化合物应用广泛。
28.磷元素的原子核外电子排布式是____________。
29.磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C+P4O10→P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
30.铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
31.在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++ H2O2+ H2O → Ce(OH)4↓+ _______
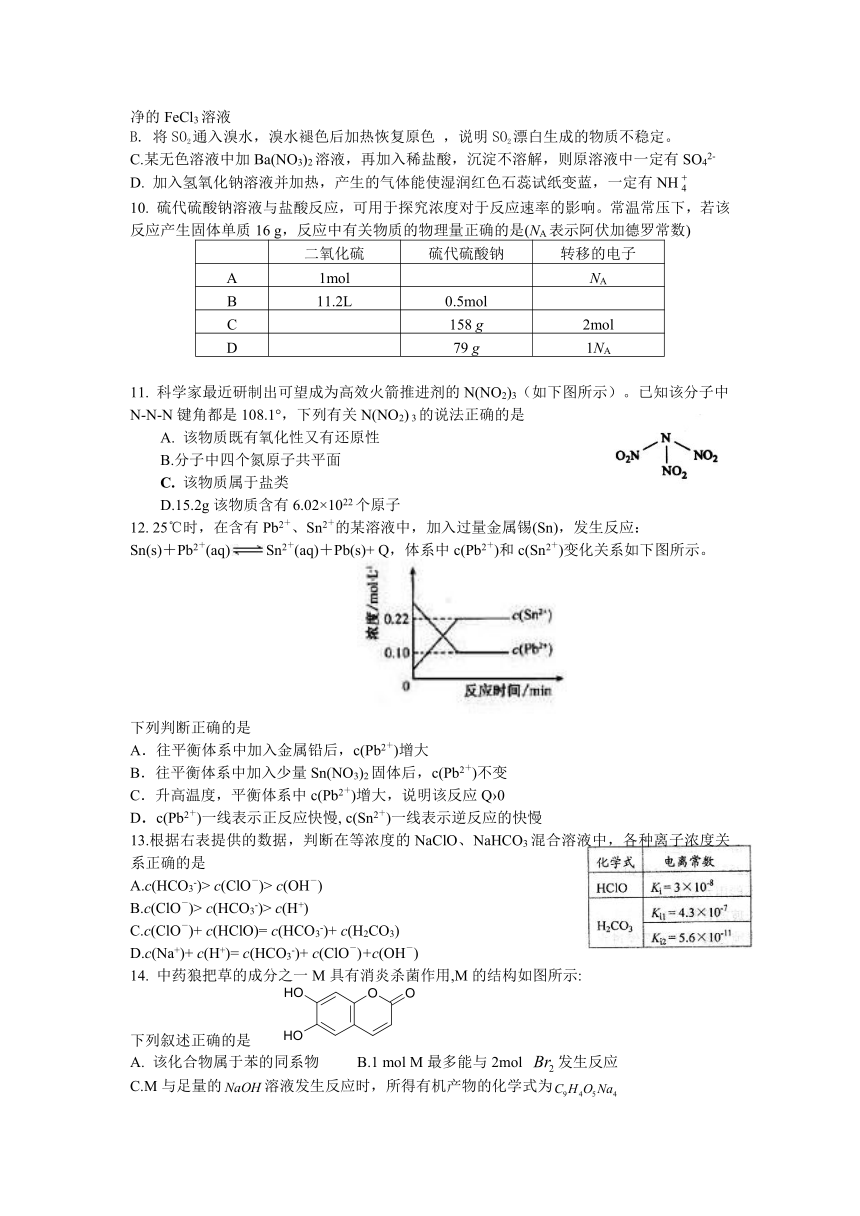
在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为、及。
反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
32.与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:②_______________; .
③_______________; .
33.实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
34.该反应是________热反应,判断其理由是____________________________;
35.该反应进行到4.0min时的平均反应速度率:
实验②:=__________________________________;
五、(本题共24分)
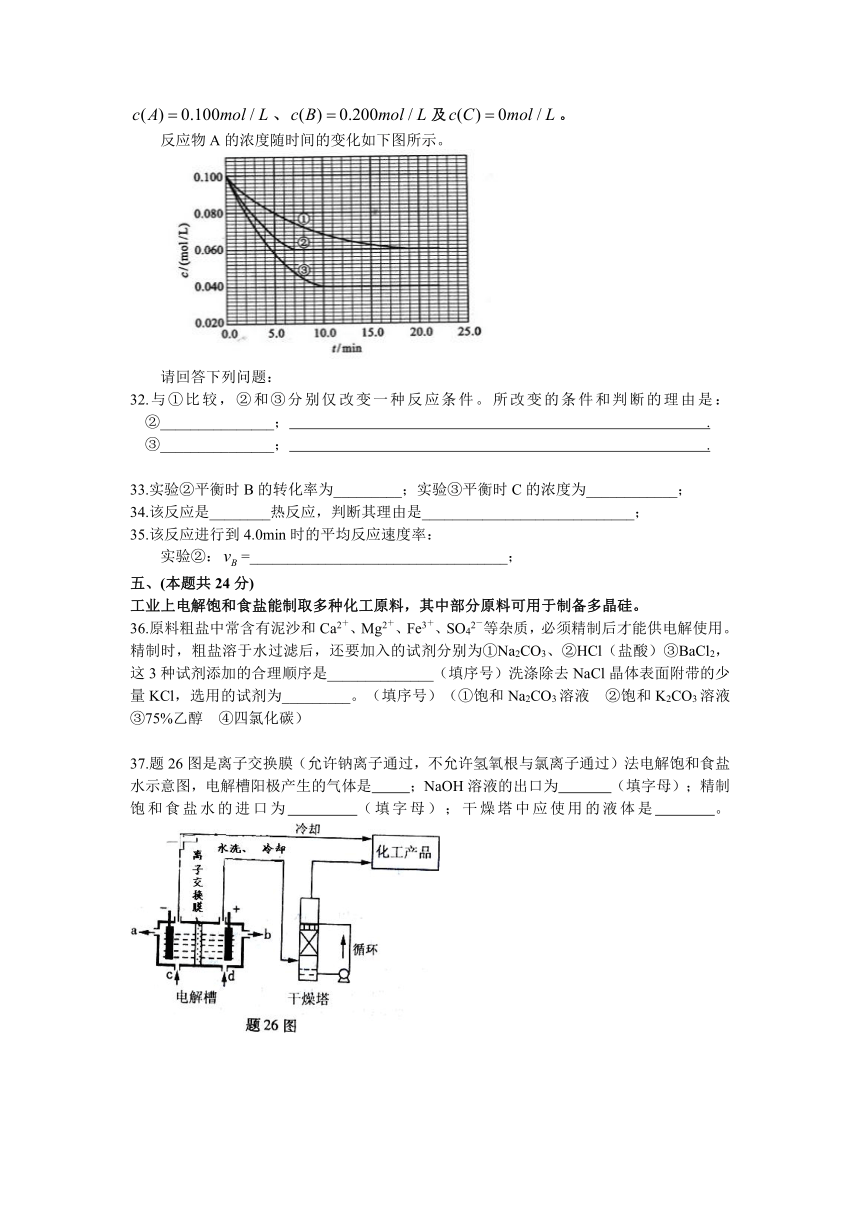
工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
36.原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。(填序号)(①饱和Na2CO3溶液 ②饱和K2CO3溶液 ③75%乙醇 ④四氯化碳)
37.题26图是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。
多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
38.SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为 。
39.SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 kg。
40.实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4→ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
41. 采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气 (标准状况)。(忽略可能存在的其他反应)
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
沉淀物 Fe(OH)3 Al(OH)3 Mg(OH)2
PH 3.2 5.2 12.4
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
42.“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
43.滤渣I的主要成分是 。
Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3 →Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
44.将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
45.按题44中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
六、(本题共20分)
有机物的结构也可用键线式表示。如:
结构简式
键线式
46.具有相同碳原子数的环烷烃与 是同分异构体。
47. 的分子式为_________;
48.乙炔3分子聚合的产物为苯。写出丙炔三分子聚合形成的芳香烃分子的键线式______
49.由 以及必要的无机试剂可合成,写出第一步合成反应的化学方程式__________________________________________。
50.的一种同分异构体A,它的一氯代物有三种。与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为 。
乙基香草醛( )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
51.乙基香草醛分子中的含氧官能团有乙氧基、 、 。核磁共振谱表明该分子中有 种不同类型的氢原子。
乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
提示:a. RCH2OH RCHO
b. 与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
52. A生成C的反应类型是 。
53.写出在加热条件下C与NaOH水溶液发生反应的化学方程式 。
54.乙基香草醛的另一种同分异构体D( )是一种医药中间体。
请设计合理方案用茴香醛( )合成D。用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内。并写出茴香醛与银氨溶液反应的化学方程式。
七、计算(本题共16分)
将a mol的和固体混合后,在密闭容器中加热到250℃,让其充分反应,假设分解产生的与反应完后,再与反应.
55.当剩余固体只有,排出气体中的物质的量为 (用含a或b的代数式表示)
56. 当时,剩余固体是________,排出气体是________。
57. 当剩余固体为,NaOH,排出气体为,时,的值为________.
58.当排出的和为等物质的量时,则的值为________.
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
59.写出反应过程中的离子反应方程式:
DE段 ,
EF段__________________________________。
60.合金中,铝的质量为 g,铁的质量为 g 。
61.硝酸溶液的物质的量浓度为 mol·L-1
62. C的值为 mL。
2011学年第一学期高三化学参考答案
第I卷 (共66分)
一(10分) 题号 1 2 3 4 5
答案 A C C D A
二(36分) 题号 6 7 8 9 10
答案 D D B D D
题号 11 12 13 14 15
答案 A C A C C
题号 16 17
答案 B C
三(20分) 题号 18 19 20 21 22
答案 BC BC AD C C
第Ⅱ卷(共84分)
四、(本题共24分)
23.(1分)
24.(1分)弱于
25.(2分)S + 2H2SO4(浓) 3SO2↑+ 2H2O
26.(2分)2H2O2 2H2O + O2↑(或其他合理答案:)
27(2分)NaNO2
28.(2分)1s22s22p63s23p3; 29.(2分)20;
30.(2分)分解出HCl气体,抑制CeCl3的水解(或其他合理答案);
31.(2分) 2Ce3++H2O2+6H2O→ 2Ce(OH)4↓+6H+
32.(2分)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变③温度升高;达到平衡的时间缩短,平衡时A的浓度减小(②③各1分,原因错了得0分)
33.(2分)40%(或0.4);0.06mol/L; 34(2分)吸热;升高温度平衡向正反应方向移动,故该反应是吸热反应
35(2分)0.014mol(L·min)-1;
五、(本题共24分)
36.(2分)③①② ;③37.(4分)氯气;a;d;浓硫酸
38.(2分)①SiCl4+2H2+O2SiO2+4HCl 39. (2分)0.35 40.(2分)e;d
41.(2分)134.4,
42(2分)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
43.(2分)Fe(OH)3 Al(OH)3 44.(2分)在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大,NaCl 的溶解度与其他物质的溶解度有一定的差别。
45. (4分)降温前溶液中NaCl已达饱和,降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。
六(本题共20分)
46.(1)单烯烃(2分) 47. C10H16(2分)
48.、(各1分),共2分)
49. (2分)
50. (写出1种即可,2分)
51.醛基 (1分) 酚羟基(或羟基) (1分) 7 (1分)
52.取代反应(1分)
53. (2(2分)
54. (共4分)
(1分+1分,共2分)
+2Ag(NH3)2OH
(2分)
七、计算(本题共16分)
55. (2分) mol (写 mol或 mol不给分)
56.(2分)、NaOH、;排出气体为
57. (2分)
58. (2分)2/3
59. (2分) NH4++OH-→NH3·H2O
Al(OH)3+ OHˉ→AlO2ˉ+2H2O
60. (2分) 0.216 1.344 61. (2分) 1.48
62. (2分) 7
A(C9H10O3)
C(C9H9O2Br)
B(C9H8O3)
CrO3/H2SO4
KMnO4/H3O+
能发生银镜反应
CrO3/H2SO4
CH3OH
浓硫酸 △
满分l50分,考试时间120分钟。
相对原子质量:
H-1 C-12 N-14 O-16 P-31 S-32 Cl-35.5 Na-23 Mg-24 Al-27 K-39 Fe-56
第I卷 (共66分)
一、选择题(本题共10分,每小题2分,只有一个正确选项,答案涂写在答题卷上)
1. 化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①研发易降解的生物农药;②推广使用节能环保材料。③田间焚烧秸秆;④应用高效洁净的能源转换技术;⑤加快化石燃料的开采与使用;
A. ①②④ B.②③⑤ C. ①③⑤ D.②④⑤
2.下列有关化学用语表示正确的是
A. 水分子的球棍模型: B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子: I D.N2的电子式:
3. 下列“化学与生活”的说法错误的是
A.硫酸钡可用作白色颜料 B.石膏可用来调节水泥的凝固时间
C.明矾可用于水的消毒、杀菌 D.醋可用于除去暖水瓶中的水垢
4. 下列叙述正确的是
A. 金属晶体的硬度高于离子晶体
B. K、Zn分别与稀硫酸反应所得溶液均呈中性
C. Fe分别与氯气和稀盐酸反应所得氯化物相同
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强
5.下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
二、选择题(本题共36分,每小题3分,只有一个正确选项,答案涂写在答题卡上)
6. 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
7. 下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生成的是
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. KClO3和K2SO4 D. Na2SO3和BaCO3
8. 下列各组有机物只用一种试剂无法鉴别的是
A.甲苯、乙醇、溴苯 B.苯、甲苯、环己烷
C.甲酸、乙醛、乙酸 D.苯、苯酚、己烯
9. 下列实验设计和结论相符的是
A. 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
B. 将SO2通入溴水,溴水褪色后加热恢复原色 ,说明SO2漂白生成的物质不稳定。
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D. 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH
10. 硫代硫酸钠溶液与盐酸反应,可用于探究浓度对于反应速率的影响。常温常压下,若该反应产生固体单质16 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
二氧化硫 硫代硫酸钠 转移的电子
A 1mol NA
B 11.2L 0.5mol
C 158 g 2mol
D 79 g 1NA
11. 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是
A. 该物质既有氧化性又有还原性
B.分子中四个氮原子共平面
C. 该物质属于盐类
D.15.2g该物质含有6.02×1022个原子
12. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s)+ Q,体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)不变
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应Q 0
D.c(Pb2+)一线表示正反应快慢, c(Sn2+)一线表示逆反应的快慢
13.根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
A.c(HCO3-)> c(ClO-)> c(OH-)
B.c(ClO-)> c(HCO3-)> c(H+)
C.c(ClO-)+ c(HClO)= c(HCO3-)+ c(H2CO3)
D.c(Na+)+ c(H+)= c(HCO3-)+ c(ClO-)+c(OH-)
14. 中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示:
下列叙述正确的是
A. 该化合物属于苯的同系物 B.1 mol M最多能与2mol 发生反应
C.M与足量的溶液发生反应时,所得有机产物的化学式为
D.1mol M与足量反应能生成2 mol
15.常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
B.甲基橙呈黄色的溶液: I- 、 Ba2+、AlO2-、Cl-
C. c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
D. 1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
16. SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g) →SF6(g)+ Q的反应热Q为
A. 1780kJ B. 1220 kJ
C.450 kJ D. -430 kJ
17. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
A.液滴下氧气含量少,发生析氢腐蚀
B.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
C.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e→4OH-
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e→Cu2+
三、选择题(本题共20分,每小题4分,每小题有一个或两个正确选项,只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分)
第Ⅱ卷(共84分)
18.含有1 mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2后,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=1.5,2Fe2++4Br-+3Cl2→2Br2+2Fe3++6Cl-
B. x=1.2,Fe2++2Br-+2Cl2→Br2+Fe3++4Cl-
C.x=0.6,2Br-+ Cl2→Br2+2Cl-
D. x=0.4,2Fe2++Cl2→2Fe3++2Cl-
19.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作 现象 结论
A 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液 红色褪去 产生了乙烯
B 滴加氯水和CCl4,振荡、静置 下层溶液显紫色 原溶液中有I-
C 向饱和Na2CO3溶液中通入足量CO2 溶液变浑浊 析出了NaHCO3
D 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH4+
20短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
21.室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)= c(NH4+)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
22.将NaOH溶液加入到13.2g含有(NH4)2SO4与(NH4)2CO3的固体混合物中,充分反应后,可收集到密度为17 g/22.4 L的气体体积不可能是
A.4.68L B.4.3 L
C.6.16L D.5.2L
四、(本题共24分)
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
23.T的离子结构示意图为_______.
24.元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
25. W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为____ _.
26.原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________ .
27.R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________
I、磷、硫元素的单质和化合物应用广泛。
28.磷元素的原子核外电子排布式是____________。
29.磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C+P4O10→P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
30.铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
31.在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++ H2O2+ H2O → Ce(OH)4↓+ _______
在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为、及。
反应物A的浓度随时间的变化如下图所示。
请回答下列问题:
32.与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:②_______________; .
③_______________; .
33.实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
34.该反应是________热反应,判断其理由是____________________________;
35.该反应进行到4.0min时的平均反应速度率:
实验②:=__________________________________;
五、(本题共24分)
工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
36.原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。(填序号)(①饱和Na2CO3溶液 ②饱和K2CO3溶液 ③75%乙醇 ④四氯化碳)
37.题26图是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。
多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
38.SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为 。
39.SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 kg。
40.实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4→ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
41. 采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气 (标准状况)。(忽略可能存在的其他反应)
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
沉淀物 Fe(OH)3 Al(OH)3 Mg(OH)2
PH 3.2 5.2 12.4
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
42.“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(要求写出两条)。
43.滤渣I的主要成分是 。
Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3 →Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
44.将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
45.按题44中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
六、(本题共20分)
有机物的结构也可用键线式表示。如:
结构简式
键线式
46.具有相同碳原子数的环烷烃与 是同分异构体。
47. 的分子式为_________;
48.乙炔3分子聚合的产物为苯。写出丙炔三分子聚合形成的芳香烃分子的键线式______
49.由 以及必要的无机试剂可合成,写出第一步合成反应的化学方程式__________________________________________。
50.的一种同分异构体A,它的一氯代物有三种。与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为 。
乙基香草醛( )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
51.乙基香草醛分子中的含氧官能团有乙氧基、 、 。核磁共振谱表明该分子中有 种不同类型的氢原子。
乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
提示:a. RCH2OH RCHO
b. 与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
52. A生成C的反应类型是 。
53.写出在加热条件下C与NaOH水溶液发生反应的化学方程式 。
54.乙基香草醛的另一种同分异构体D( )是一种医药中间体。
请设计合理方案用茴香醛( )合成D。用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内。并写出茴香醛与银氨溶液反应的化学方程式。
七、计算(本题共16分)
将a mol的和固体混合后,在密闭容器中加热到250℃,让其充分反应,假设分解产生的与反应完后,再与反应.
55.当剩余固体只有,排出气体中的物质的量为 (用含a或b的代数式表示)
56. 当时,剩余固体是________,排出气体是________。
57. 当剩余固体为,NaOH,排出气体为,时,的值为________.
58.当排出的和为等物质的量时,则的值为________.
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
59.写出反应过程中的离子反应方程式:
DE段 ,
EF段__________________________________。
60.合金中,铝的质量为 g,铁的质量为 g 。
61.硝酸溶液的物质的量浓度为 mol·L-1
62. C的值为 mL。
2011学年第一学期高三化学参考答案
第I卷 (共66分)
一(10分) 题号 1 2 3 4 5
答案 A C C D A
二(36分) 题号 6 7 8 9 10
答案 D D B D D
题号 11 12 13 14 15
答案 A C A C C
题号 16 17
答案 B C
三(20分) 题号 18 19 20 21 22
答案 BC BC AD C C
第Ⅱ卷(共84分)
四、(本题共24分)
23.(1分)
24.(1分)弱于
25.(2分)S + 2H2SO4(浓) 3SO2↑+ 2H2O
26.(2分)2H2O2 2H2O + O2↑(或其他合理答案:)
27(2分)NaNO2
28.(2分)1s22s22p63s23p3; 29.(2分)20;
30.(2分)分解出HCl气体,抑制CeCl3的水解(或其他合理答案);
31.(2分) 2Ce3++H2O2+6H2O→ 2Ce(OH)4↓+6H+
32.(2分)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变③温度升高;达到平衡的时间缩短,平衡时A的浓度减小(②③各1分,原因错了得0分)
33.(2分)40%(或0.4);0.06mol/L; 34(2分)吸热;升高温度平衡向正反应方向移动,故该反应是吸热反应
35(2分)0.014mol(L·min)-1;
五、(本题共24分)
36.(2分)③①② ;③37.(4分)氯气;a;d;浓硫酸
38.(2分)①SiCl4+2H2+O2SiO2+4HCl 39. (2分)0.35 40.(2分)e;d
41.(2分)134.4,
42(2分)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
43.(2分)Fe(OH)3 Al(OH)3 44.(2分)在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大,NaCl 的溶解度与其他物质的溶解度有一定的差别。
45. (4分)降温前溶液中NaCl已达饱和,降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。
六(本题共20分)
46.(1)单烯烃(2分) 47. C10H16(2分)
48.、(各1分),共2分)
49. (2分)
50. (写出1种即可,2分)
51.醛基 (1分) 酚羟基(或羟基) (1分) 7 (1分)
52.取代反应(1分)
53. (2(2分)
54. (共4分)
(1分+1分,共2分)
+2Ag(NH3)2OH
(2分)
七、计算(本题共16分)
55. (2分) mol (写 mol或 mol不给分)
56.(2分)、NaOH、;排出气体为
57. (2分)
58. (2分)2/3
59. (2分) NH4++OH-→NH3·H2O
Al(OH)3+ OHˉ→AlO2ˉ+2H2O
60. (2分) 0.216 1.344 61. (2分) 1.48
62. (2分) 7
A(C9H10O3)
C(C9H9O2Br)
B(C9H8O3)
CrO3/H2SO4
KMnO4/H3O+
能发生银镜反应
CrO3/H2SO4
CH3OH
浓硫酸 △
同课章节目录
