山东省临清市人教版化学必修1课件:第1章 第2节 化学计量在实验中的应用(4)
文档属性
| 名称 | 山东省临清市人教版化学必修1课件:第1章 第2节 化学计量在实验中的应用(4) |  | |
| 格式 | rar | ||
| 文件大小 | 900.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 21:18:39 | ||
图片预览







文档简介
(共21张PPT)
化学计量在实验中的应用
临清实高 王明伟 审核人:宁刚
第二节
1:气体摩尔体积:
单位物质的量的气体所占有的体积。
2:符号 Vm
3:单位:L/mol (或L·mol-1 )
4:在标准状况下,气体摩尔体积约为22.4L/mol
5:影响气体摩尔体积大小的因素:
粒子间的距离(即与 温度和压强有关)
6、标准状况下气体体积(V)、物质的量(n)、气体摩尔体积(V m)三者间的关系?
V
Vm
n=
V=n ×Vm
在化学实验中经常要用到溶液,我们有时用溶质的质量分数来表示溶液的组成,为了操作方便,一般取用溶液时并不是称量它的质量,而是量取它的体积。所以我们又引进一个新的物理量来表示溶液的浓度------物质的量浓度
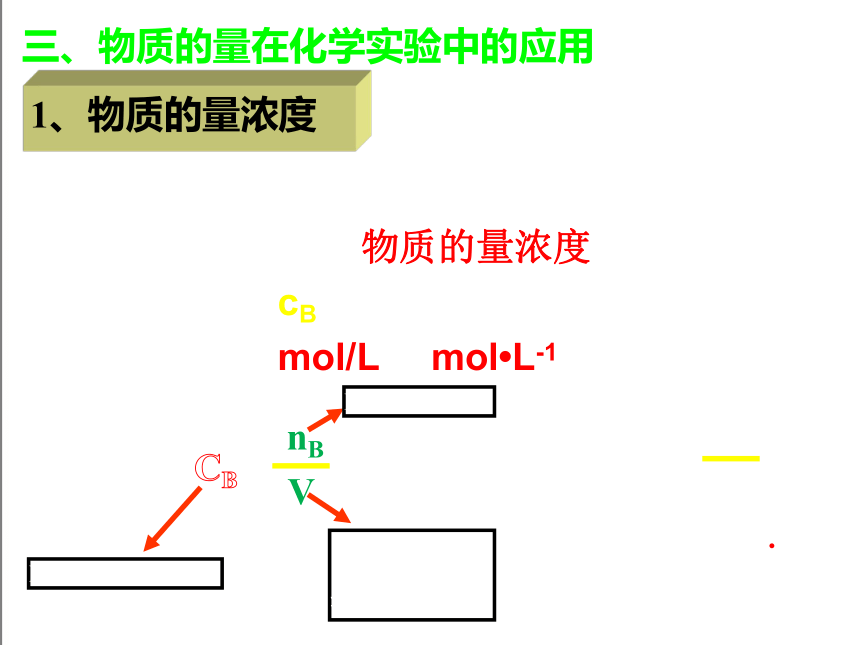
三、物质的量在化学实验中的应用
1、物质的量浓度
nB
V
B的物质的量浓度
B的物质的量
溶液的体积(注意:不是溶剂的体积)
变形公式:
V=
nB
CB
nB=CB ·V
(1)定义:单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度。
(2)符号:cB
(3)单位:mol/L(或mol L-1)
【例】配制500mL0.1mol/NaOH溶液需要NaOH的质量是多少?
分析:要求NaOH的质量,可依据m=n×M公式
所以要计算NaOH的物质的量,可依据
n=V×cB公式
课堂练习一
用5molNaOH配成500mL溶液,其浓度为 mol/L,取5mL该溶液,其浓度为 mol/L。
从1L 1mol/L NaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的物质的量浓度是否相等?所含溶质各是多少克?
10
10
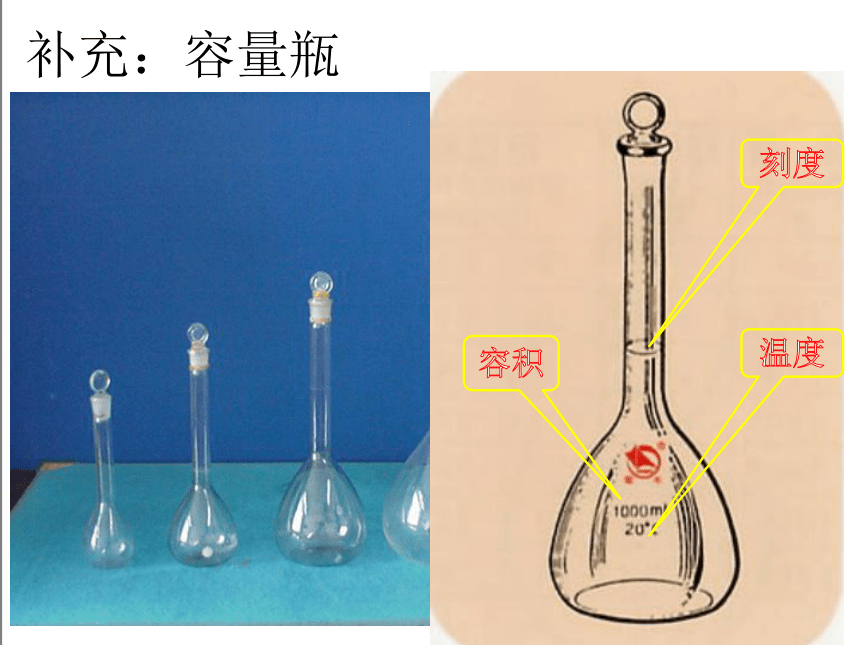
2、物质的量浓度溶液的配制
实验1-5 怎样配制 0.1mol/L 的NaCl溶液100mL?
(1)实验所需仪器
烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用)
补充:容量瓶
实验1-5步骤
教材P16页 配制100mL1.00mol/LNaCl溶液
计算需要NaCl固体的质量: 5.85 g
二称(量)
一 算
根据计算结果,用托盘天平称量对应NaCl固体
三 溶
将称好的NaCl固体放入烧杯中,用适量的蒸馏水溶解
四 移
将烧杯中的溶液冷却后注入到100mL的容量瓶中 ,
五 洗
六 摇
七 定
八 装
用少量蒸馏水洗涤烧杯内壁2-3次,洗涤液也注入到容量瓶中
轻轻摇动容量瓶,使溶液混合均匀
将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1-2cm时,改用
胶头滴管滴加蒸馏水至液面刻度线相切 ,盖好瓶塞,反复上下
颠倒,摇匀。
将所配好的溶液转到贴有标签的试剂瓶中
课堂练习二
下列关于0.1mol/L硝酸钾溶液配制的说法中,错误的是( )
(A)0.01molKNO3溶于100mL水配制而成
(B)0.05molKNO3溶于水配制成500mL水溶液
(C)0.2mol/LKNO3100mL稀释成200mL
(D)0.1molKNO3溶于1L水配制而成
A、D
随堂检测一
欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。
10.0
烧杯
少量
冷却
玻璃棒
250
③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。
随堂检测一
2~3
低
1~2厘米
胶头滴管
偏低
重新配制
摇匀
容量瓶
试剂瓶
讨论
在配制溶液中哪些操作可能引起溶液浓度的误差?
俯视或仰视刻度线对溶液浓度的影响
俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
(3)误差分析
配制步骤 错误操作 n V c
称量 物质、砝码位置放反了(使用了游码) —
量取液态溶质时,俯视量筒刻度。 —
溶解 有少量液体溅出 —
转移 溶液未冷却,就转移进容量瓶 —
移液前容量瓶内有少量水
玻璃棒在刻度线上引流溶剂 —
洗涤 未洗涤或洗涤液未注入容量瓶 —
定容 仰视刻度线 —
摇匀 摇匀后液面下降,补充了溶剂 —
装瓶 试剂瓶中有残留的蒸馏水 —
减小
减小
减小
减小
不变
不变
不变
增大
减小
增大
增大
增大
减小
减小
减小
减小
减小
减小
减小
减小
增大
小结:容量瓶的使用六忌
一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器)
三、物质的量在化学实验中的应用
1、物质的量浓度
nB
V
(1)定义:单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度。
(2)符号:cB
(3)单位:mol/L(或mol L-1)
称量
计算
溶解
转移
洗涤
摇匀
定容
装瓶
作 业
1.复习
2.完成《课时讲练通》
化学计量在实验中的应用
临清实高 王明伟 审核人:宁刚
第二节
1:气体摩尔体积:
单位物质的量的气体所占有的体积。
2:符号 Vm
3:单位:L/mol (或L·mol-1 )
4:在标准状况下,气体摩尔体积约为22.4L/mol
5:影响气体摩尔体积大小的因素:
粒子间的距离(即与 温度和压强有关)
6、标准状况下气体体积(V)、物质的量(n)、气体摩尔体积(V m)三者间的关系?
V
Vm
n=
V=n ×Vm
在化学实验中经常要用到溶液,我们有时用溶质的质量分数来表示溶液的组成,为了操作方便,一般取用溶液时并不是称量它的质量,而是量取它的体积。所以我们又引进一个新的物理量来表示溶液的浓度------物质的量浓度
三、物质的量在化学实验中的应用
1、物质的量浓度
nB
V
B的物质的量浓度
B的物质的量
溶液的体积(注意:不是溶剂的体积)
变形公式:
V=
nB
CB
nB=CB ·V
(1)定义:单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度。
(2)符号:cB
(3)单位:mol/L(或mol L-1)
【例】配制500mL0.1mol/NaOH溶液需要NaOH的质量是多少?
分析:要求NaOH的质量,可依据m=n×M公式
所以要计算NaOH的物质的量,可依据
n=V×cB公式
课堂练习一
用5molNaOH配成500mL溶液,其浓度为 mol/L,取5mL该溶液,其浓度为 mol/L。
从1L 1mol/L NaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的物质的量浓度是否相等?所含溶质各是多少克?
10
10
2、物质的量浓度溶液的配制
实验1-5 怎样配制 0.1mol/L 的NaCl溶液100mL?
(1)实验所需仪器
烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用)
补充:容量瓶
实验1-5步骤
教材P16页 配制100mL1.00mol/LNaCl溶液
计算需要NaCl固体的质量: 5.85 g
二称(量)
一 算
根据计算结果,用托盘天平称量对应NaCl固体
三 溶
将称好的NaCl固体放入烧杯中,用适量的蒸馏水溶解
四 移
将烧杯中的溶液冷却后注入到100mL的容量瓶中 ,
五 洗
六 摇
七 定
八 装
用少量蒸馏水洗涤烧杯内壁2-3次,洗涤液也注入到容量瓶中
轻轻摇动容量瓶,使溶液混合均匀
将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1-2cm时,改用
胶头滴管滴加蒸馏水至液面刻度线相切 ,盖好瓶塞,反复上下
颠倒,摇匀。
将所配好的溶液转到贴有标签的试剂瓶中
课堂练习二
下列关于0.1mol/L硝酸钾溶液配制的说法中,错误的是( )
(A)0.01molKNO3溶于100mL水配制而成
(B)0.05molKNO3溶于水配制成500mL水溶液
(C)0.2mol/LKNO3100mL稀释成200mL
(D)0.1molKNO3溶于1L水配制而成
A、D
随堂检测一
欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。
10.0
烧杯
少量
冷却
玻璃棒
250
③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 中并贴好标签。
随堂检测一
2~3
低
1~2厘米
胶头滴管
偏低
重新配制
摇匀
容量瓶
试剂瓶
讨论
在配制溶液中哪些操作可能引起溶液浓度的误差?
俯视或仰视刻度线对溶液浓度的影响
俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
(3)误差分析
配制步骤 错误操作 n V c
称量 物质、砝码位置放反了(使用了游码) —
量取液态溶质时,俯视量筒刻度。 —
溶解 有少量液体溅出 —
转移 溶液未冷却,就转移进容量瓶 —
移液前容量瓶内有少量水
玻璃棒在刻度线上引流溶剂 —
洗涤 未洗涤或洗涤液未注入容量瓶 —
定容 仰视刻度线 —
摇匀 摇匀后液面下降,补充了溶剂 —
装瓶 试剂瓶中有残留的蒸馏水 —
减小
减小
减小
减小
不变
不变
不变
增大
减小
增大
增大
增大
减小
减小
减小
减小
减小
减小
减小
减小
增大
小结:容量瓶的使用六忌
一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器)
三、物质的量在化学实验中的应用
1、物质的量浓度
nB
V
(1)定义:单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度。
(2)符号:cB
(3)单位:mol/L(或mol L-1)
称量
计算
溶解
转移
洗涤
摇匀
定容
装瓶
作 业
1.复习
2.完成《课时讲练通》
