山东省临清市人教版化学必修1课件:第2章 第1节 物质的分类
文档属性
| 名称 | 山东省临清市人教版化学必修1课件:第2章 第1节 物质的分类 |

|
|
| 格式 | rar | ||
| 文件大小 | 774.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 00:00:00 | ||
图片预览







文档简介
(共34张PPT)
第二章 化学物质及其变化
编制人:邢君
审稿人:凌丽
到图书馆借书时,为什么图书管理员很快就能找到你所需要的那本书呢?
进行了合理的
分类!!!
为什么要分类呢?
数目太多。方便查找。
对于多达三千万的化学物质和更多的化学反应,人们要想认识它们的规律性,就必须运用分类的方法,按照事先设定的“标准”进行分类。
一、简单分类法及其应用
1、分类的目的:
2、分类的标准:
3、分类的意义:
方便查找应用
根据组成或性质
方便学习和研究
第一节 物质的分类
1、NaCl KCl NaClO BaCl2
2、HClO3 KClO3 Cl2 NaClO3
3、H3PO4 HNO3 HCl H2SO4
4、空气 N2 HCl气体 CuSO4 5H2O
●
√
√
√
√
下列每组中都有一种物质与其他物质在分类上不同,试分析每组中的物质的组成规律,将这种不同于其他物质的物质找出来。
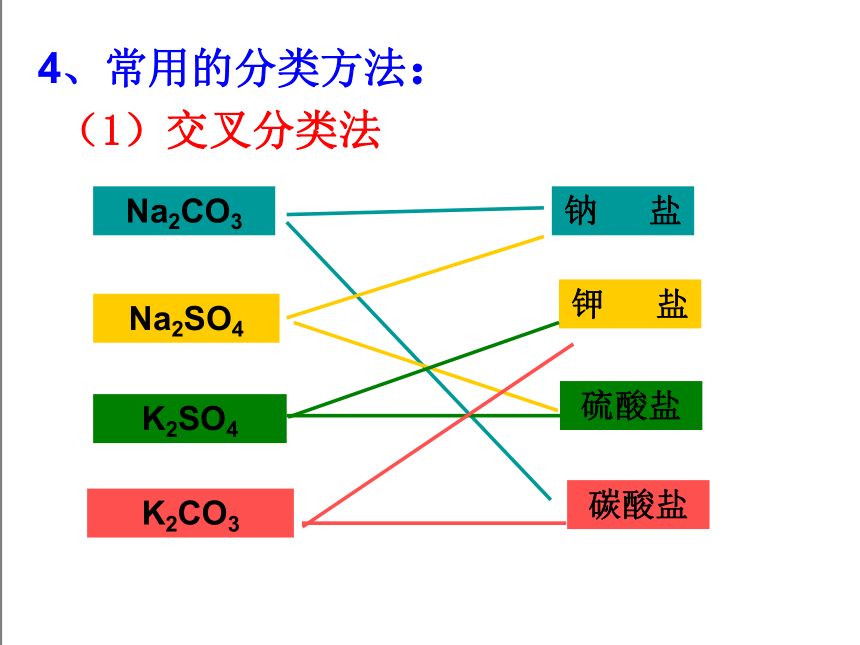
4、常用的分类方法:
(1)交叉分类法
Na2CO3
Na2SO4
K2SO4
K2CO3
钠 盐
钾 盐
硫酸盐
碳酸盐
思考与交流
1、请尝试对你所学过的化学物质和化学反应进行分类,并与同学交流。
2、请从其他方面收集一些应用分类的例子,讨论对它们进行分类的目的和意义。
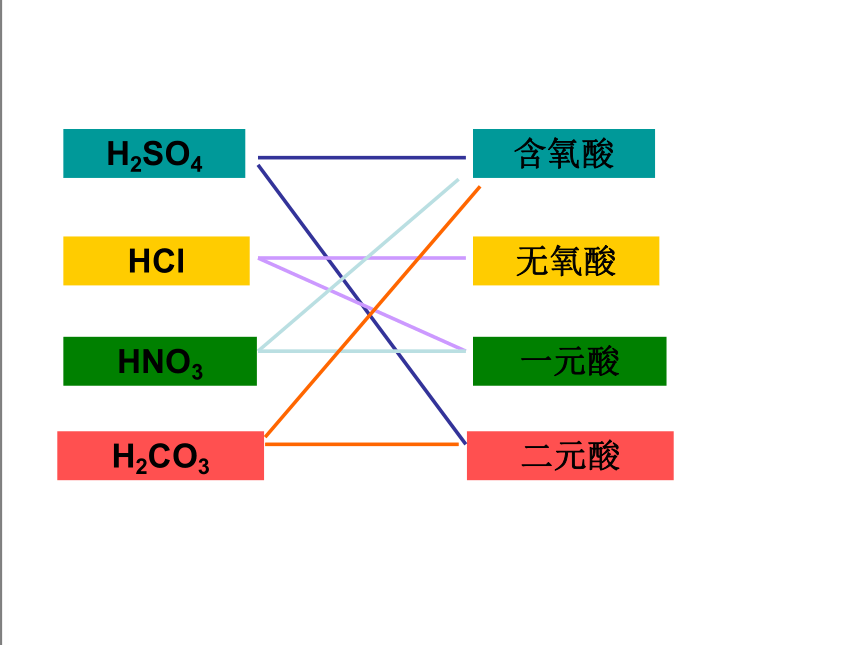
H2SO4
HCl
HNO3
H2CO3
含氧酸
无氧酸
一元酸
二元酸
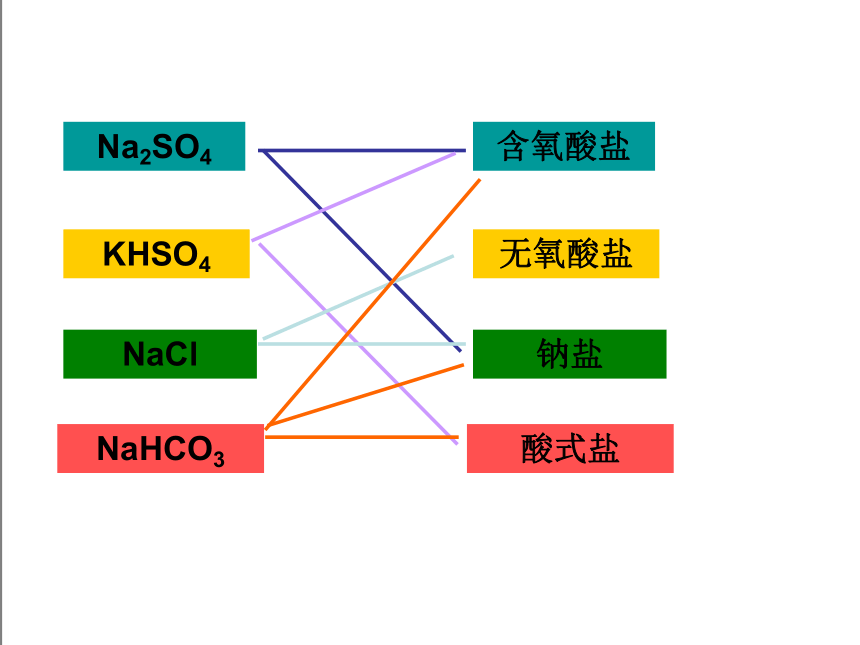
Na2SO4
KHSO4
NaCl
NaHCO3
含氧酸盐
无氧酸盐
钠盐
酸式盐
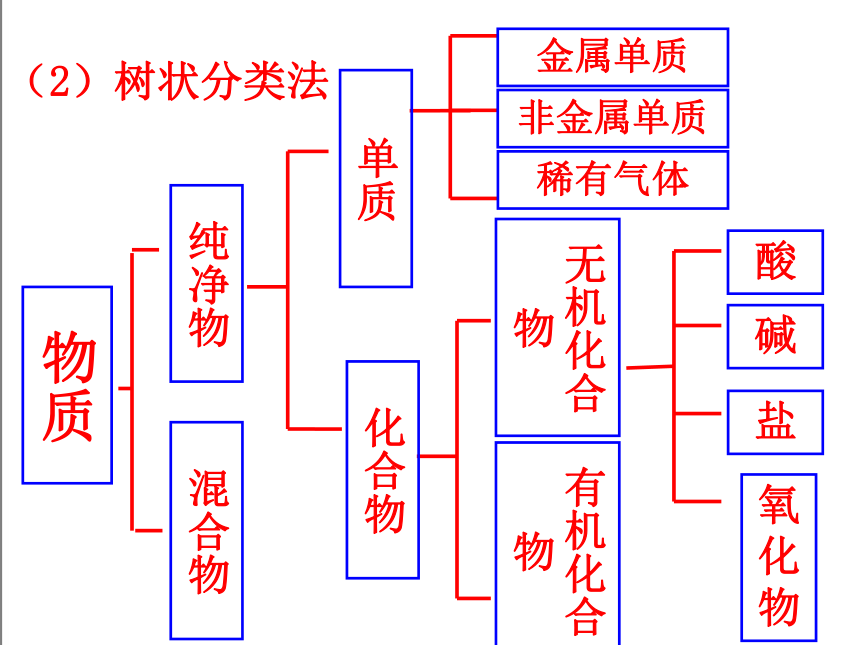
(2)树状分类法
酸
碱
盐
氧化物
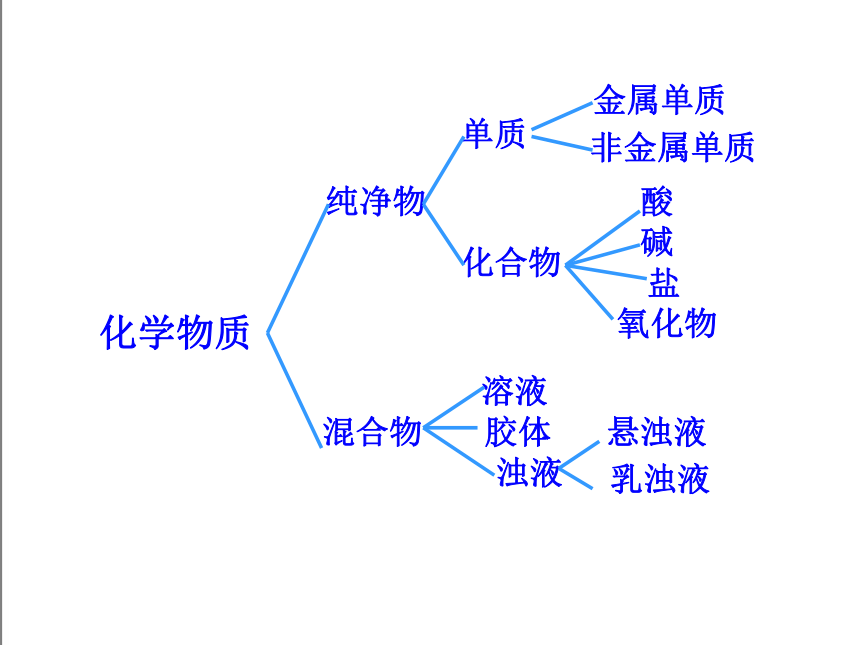
纯净物
无机化合物
有机化合物
物质
混合物
单质
化合物
金属单质
非金属单质
稀有气体
化学物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
氧化物
盐
溶液
胶体
浊液
悬浊液
乳浊液
树状分类法:是对同类物质按照属性进一步细分类的方法,能把事物认识得更加深刻,促进科学发展。
交叉分类法:是分别按照多种标准对某一事物进行类的方法,对事物认识较全面,可弥补单一分类方法的不足。
1、下列物质中属于混合物的是( )
A、蒸馏水
B、氯酸钾和二氧化锰混合加热完全反
应后试管中剩余物质
C、含铁70%的三氧化二铁样品
D、硫酸氢钠
B
2、下列物质中前者包含后者是的( )
A、纯净物、混合物
B、单质、纯净物
C、化合物、氧化物
D、酸、盐
C
化学反应
例如: 2CuO+C===2Cu+CO2
高温
按反应前后种类、类别分类
按得氧,失氧分类
化合反应A+B=AB
分解反应AB=A+B
置换反应A+BC=AB+C
复分解反应AB+CD=AD+BC
氧化反应
还原反应
实践活动
1.请在图2-3的方框内填上具体的化学物质,进一步体会树状分类法的应用。如果你对分类法有兴趣,还可以通过查找资料或与同学合作,为石油加工后的产物或用途制作一张树状分类图。
2.请选择你熟悉的化学物质,制作一张交叉分类图。
3.详见P25.
4.详见P25
3、下列物质按不同的分类标准选择,可选出与其他三项不属同类的物质?
(1)选___. 标准是_____________.
(2)选___. 标准是_____________.
A. 盐酸 B. 浓硫酸
C. 硝酸溶液 D. 纯碱
D
其它三种都是溶液
D
其它三种都是酸
学习活动:
观察思考:下列试剂有何不同?
CuSO4溶液、 Fe(OH)3 胶体、泥水、
淀粉溶液、 FeCl3溶液
实验探究:用激光笔照射上述试剂,出现了什么现象?
根据以上实验结果,上述试剂可分为几种类型?
光束通过溶液和胶体时的现象:
CuSO4溶液
Fe(OH)3胶体
阅读讨论:
1. 什么是分散系?
2 .按照分散质和分散剂的状态,分散
系可分为哪些类型?
3.按照分散质的大小,分散系可分为
几种类型?分别有何特征?
4.什么是丁达尔效应?它有何用途?
按照分散质和分散剂的状态:
分散系:
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
分散质 分散剂 实 例
气 气 空气
液 气 云、雾
固 气 烟灰尘
气 液 泡沫
液 液 牛奶、酒精的水溶液
固 液 糖水、油漆
气 固 泡沫塑料
液 固 珍珠(包藏着水的碳酸钙)
固 固 有色玻璃、合金
按照分散质粒子的大小:
溶液:粒子直径<1nm
胶体:1nm<粒子直径<100nm
浊液:粒子直径>100nm
树林中的丁达尔效应
实验探究:
如何用FeCl3溶液制取Fe(OH)3胶体?
⑴ FeCl3溶液中滴加NaOH溶液,观
察到的现象:
(2) 沸水中滴加FeCl3溶液,观察到的
现象: 反应原理:
(3) 将Fe(OH)3胶体进行过滤。
生成红褐色
得到红棕色液体
FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
△
阅读思考:
1. 用上述方法得到的Fe(OH)3胶体中还有什么杂质?
2. 能否通过过滤的方法将Fe(OH)3胶体中的杂质除去?
3. 用什么方法除去胶体中的可溶性杂质?
资料阅读:
胶体的分散质微粒粒度介于1nm—100nm之间。这样的微粒能透过滤纸,而不能穿过半透膜(如动物肠衣、鸡蛋克膜,羊皮纸、胶棉薄膜、玻璃纸等)。半透膜具有此滤纸更细小的孔隙,只有分子、离子能透过,而粒度较大的胶体分散质微粒不能通过,因而可以用它将胶体微粒与分子或离子分离开。利用半透膜分离胶体中的杂质分子或离子,提纯,精制胶体的操作称为渗析。
胶体的特征:
外观:介稳性
本质:分散质微粒粒度介于1nm — 100nm之间
光学性质:丁达尔效应
透过性质:能透过滤纸不能透过半透膜
不同分散系的比较:
溶液 悬浊液 乳浊液 胶体
分散质微粒
的 大 小
分散质微粒
的 组 成
外 观 特 征
稳 定 性
能否透过滤纸
能否透过半透膜
胶体的分类:
根据分散质
微粒的构成
粒子胶体:Fe(OH)3胶体、AgI胶体
分子胶体:淀粉溶液、蛋白质溶液
根据分散剂
的状态
气溶胶:烟、云、雾
液溶胶:AgI胶体、Fe(OH)3胶体
固溶胶:有色玻璃、烟水晶
可进一步研究的问题:
胶体为什么具有介稳性?
布朗运动
电泳现象---说明胶体粒子带电
胶体凝聚
胶体有哪些应用?
案例分析:
例1.纳米材料是指粒子直径在几纳米到几十纳米之间的材料。如将纳米材料分散到液体分散剂中,所得混合物具有的性质是( )
A 能全部透过半透膜
B 能产生丁达尔效应
C 所得液体一定能导电
D 所得物质一定为悬浊液或乳浊液
例2.已知Fe(OH)3胶粒带正电荷。Al(OH)3胶粒也带正电荷,而H2SiO3胶粒带负电荷,则下列实验的现象分别是:
①Fe(OH)3胶粒和Al(OH)3胶粒混合:
②Fe(OH)3胶粒和H2SiO3胶粒混合:
.例3.将盛有淀粉胶体和食盐溶液的
半透膜浸在蒸馏水中。 2分钟后用两
支试管各取5ml烧杯中液体。
(1)向其中一支试管里滴加少量AgNO3
溶液,其现象是___________
(2)向另一支试管里滴加少量碘水,其
现象是 ____________
第二章 化学物质及其变化
编制人:邢君
审稿人:凌丽
到图书馆借书时,为什么图书管理员很快就能找到你所需要的那本书呢?
进行了合理的
分类!!!
为什么要分类呢?
数目太多。方便查找。
对于多达三千万的化学物质和更多的化学反应,人们要想认识它们的规律性,就必须运用分类的方法,按照事先设定的“标准”进行分类。
一、简单分类法及其应用
1、分类的目的:
2、分类的标准:
3、分类的意义:
方便查找应用
根据组成或性质
方便学习和研究
第一节 物质的分类
1、NaCl KCl NaClO BaCl2
2、HClO3 KClO3 Cl2 NaClO3
3、H3PO4 HNO3 HCl H2SO4
4、空气 N2 HCl气体 CuSO4 5H2O
●
√
√
√
√
下列每组中都有一种物质与其他物质在分类上不同,试分析每组中的物质的组成规律,将这种不同于其他物质的物质找出来。
4、常用的分类方法:
(1)交叉分类法
Na2CO3
Na2SO4
K2SO4
K2CO3
钠 盐
钾 盐
硫酸盐
碳酸盐
思考与交流
1、请尝试对你所学过的化学物质和化学反应进行分类,并与同学交流。
2、请从其他方面收集一些应用分类的例子,讨论对它们进行分类的目的和意义。
H2SO4
HCl
HNO3
H2CO3
含氧酸
无氧酸
一元酸
二元酸
Na2SO4
KHSO4
NaCl
NaHCO3
含氧酸盐
无氧酸盐
钠盐
酸式盐
(2)树状分类法
酸
碱
盐
氧化物
纯净物
无机化合物
有机化合物
物质
混合物
单质
化合物
金属单质
非金属单质
稀有气体
化学物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
氧化物
盐
溶液
胶体
浊液
悬浊液
乳浊液
树状分类法:是对同类物质按照属性进一步细分类的方法,能把事物认识得更加深刻,促进科学发展。
交叉分类法:是分别按照多种标准对某一事物进行类的方法,对事物认识较全面,可弥补单一分类方法的不足。
1、下列物质中属于混合物的是( )
A、蒸馏水
B、氯酸钾和二氧化锰混合加热完全反
应后试管中剩余物质
C、含铁70%的三氧化二铁样品
D、硫酸氢钠
B
2、下列物质中前者包含后者是的( )
A、纯净物、混合物
B、单质、纯净物
C、化合物、氧化物
D、酸、盐
C
化学反应
例如: 2CuO+C===2Cu+CO2
高温
按反应前后种类、类别分类
按得氧,失氧分类
化合反应A+B=AB
分解反应AB=A+B
置换反应A+BC=AB+C
复分解反应AB+CD=AD+BC
氧化反应
还原反应
实践活动
1.请在图2-3的方框内填上具体的化学物质,进一步体会树状分类法的应用。如果你对分类法有兴趣,还可以通过查找资料或与同学合作,为石油加工后的产物或用途制作一张树状分类图。
2.请选择你熟悉的化学物质,制作一张交叉分类图。
3.详见P25.
4.详见P25
3、下列物质按不同的分类标准选择,可选出与其他三项不属同类的物质?
(1)选___. 标准是_____________.
(2)选___. 标准是_____________.
A. 盐酸 B. 浓硫酸
C. 硝酸溶液 D. 纯碱
D
其它三种都是溶液
D
其它三种都是酸
学习活动:
观察思考:下列试剂有何不同?
CuSO4溶液、 Fe(OH)3 胶体、泥水、
淀粉溶液、 FeCl3溶液
实验探究:用激光笔照射上述试剂,出现了什么现象?
根据以上实验结果,上述试剂可分为几种类型?
光束通过溶液和胶体时的现象:
CuSO4溶液
Fe(OH)3胶体
阅读讨论:
1. 什么是分散系?
2 .按照分散质和分散剂的状态,分散
系可分为哪些类型?
3.按照分散质的大小,分散系可分为
几种类型?分别有何特征?
4.什么是丁达尔效应?它有何用途?
按照分散质和分散剂的状态:
分散系:
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
分散质 分散剂 实 例
气 气 空气
液 气 云、雾
固 气 烟灰尘
气 液 泡沫
液 液 牛奶、酒精的水溶液
固 液 糖水、油漆
气 固 泡沫塑料
液 固 珍珠(包藏着水的碳酸钙)
固 固 有色玻璃、合金
按照分散质粒子的大小:
溶液:粒子直径<1nm
胶体:1nm<粒子直径<100nm
浊液:粒子直径>100nm
树林中的丁达尔效应
实验探究:
如何用FeCl3溶液制取Fe(OH)3胶体?
⑴ FeCl3溶液中滴加NaOH溶液,观
察到的现象:
(2) 沸水中滴加FeCl3溶液,观察到的
现象: 反应原理:
(3) 将Fe(OH)3胶体进行过滤。
生成红褐色
得到红棕色液体
FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
△
阅读思考:
1. 用上述方法得到的Fe(OH)3胶体中还有什么杂质?
2. 能否通过过滤的方法将Fe(OH)3胶体中的杂质除去?
3. 用什么方法除去胶体中的可溶性杂质?
资料阅读:
胶体的分散质微粒粒度介于1nm—100nm之间。这样的微粒能透过滤纸,而不能穿过半透膜(如动物肠衣、鸡蛋克膜,羊皮纸、胶棉薄膜、玻璃纸等)。半透膜具有此滤纸更细小的孔隙,只有分子、离子能透过,而粒度较大的胶体分散质微粒不能通过,因而可以用它将胶体微粒与分子或离子分离开。利用半透膜分离胶体中的杂质分子或离子,提纯,精制胶体的操作称为渗析。
胶体的特征:
外观:介稳性
本质:分散质微粒粒度介于1nm — 100nm之间
光学性质:丁达尔效应
透过性质:能透过滤纸不能透过半透膜
不同分散系的比较:
溶液 悬浊液 乳浊液 胶体
分散质微粒
的 大 小
分散质微粒
的 组 成
外 观 特 征
稳 定 性
能否透过滤纸
能否透过半透膜
胶体的分类:
根据分散质
微粒的构成
粒子胶体:Fe(OH)3胶体、AgI胶体
分子胶体:淀粉溶液、蛋白质溶液
根据分散剂
的状态
气溶胶:烟、云、雾
液溶胶:AgI胶体、Fe(OH)3胶体
固溶胶:有色玻璃、烟水晶
可进一步研究的问题:
胶体为什么具有介稳性?
布朗运动
电泳现象---说明胶体粒子带电
胶体凝聚
胶体有哪些应用?
案例分析:
例1.纳米材料是指粒子直径在几纳米到几十纳米之间的材料。如将纳米材料分散到液体分散剂中,所得混合物具有的性质是( )
A 能全部透过半透膜
B 能产生丁达尔效应
C 所得液体一定能导电
D 所得物质一定为悬浊液或乳浊液
例2.已知Fe(OH)3胶粒带正电荷。Al(OH)3胶粒也带正电荷,而H2SiO3胶粒带负电荷,则下列实验的现象分别是:
①Fe(OH)3胶粒和Al(OH)3胶粒混合:
②Fe(OH)3胶粒和H2SiO3胶粒混合:
.例3.将盛有淀粉胶体和食盐溶液的
半透膜浸在蒸馏水中。 2分钟后用两
支试管各取5ml烧杯中液体。
(1)向其中一支试管里滴加少量AgNO3
溶液,其现象是___________
(2)向另一支试管里滴加少量碘水,其
现象是 ____________
