山东省临清市人教版化学必修1课件:第3章 第3节 几种重要的金属化合物用途广泛的金属材料
文档属性
| 名称 | 山东省临清市人教版化学必修1课件:第3章 第3节 几种重要的金属化合物用途广泛的金属材料 |

|
|
| 格式 | rar | ||
| 文件大小 | 518.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 00:00:00 | ||
图片预览





文档简介
(共16张PPT)
第三章 金属及其化合物
第三节
用途广泛的金属材料
1.了解合金的概念及其重要应用。
2.认识几种常见的合金及其应用。
临清一中 郑忠强
一、合金
1.合金的定义
金属
金属或非金属
由一种________ 跟其他一种或几种_________________ 一
起熔合而成的具有______________的混合物。
金属特性
2.合金的性能
(1)合金的熔点一般比组成它的任何一种成分金属的熔点___。
(2)合金的硬度一般比组成它的各成分金属的硬度_____。
(3)有些合金在化学性质方面有很大改善,例如不锈钢比铁
耐腐蚀。
低
大
二、如何选用材料
选择材料时常常要考虑以下几个方面:①主要用途;②外
观;③物理性质(______、_______、______、_______、______);
④化学性质(___________、___________);⑤价格;⑥加工难度;
⑦正常维护;⑧对环境的影响。
密度
硬度
强度
导电性
导热性
对水的作用
耐腐蚀性
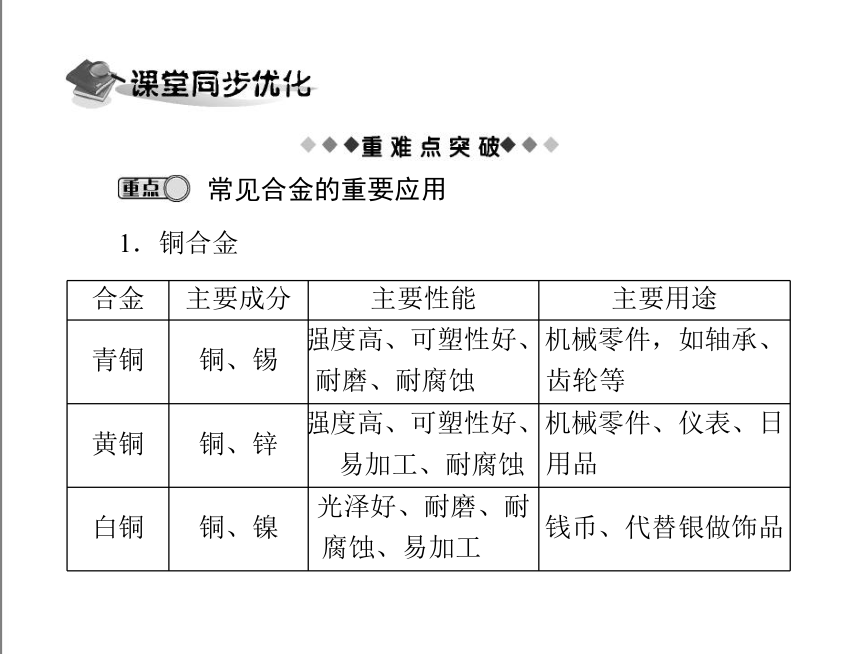
合金 主要成分 主要性能 主要用途
青铜 铜、锡 强度高、可塑性好、
耐磨、耐腐蚀 机械零件,如轴承、
齿轮等
黄铜 铜、锌 强度高、可塑性好、
易加工、耐腐蚀 机械零件、仪表、日
用品
白铜 铜、镍 光泽好、耐磨、耐
腐蚀、易加工 钱币、代替银做饰品
常见合金的重要应用
1.铜合金
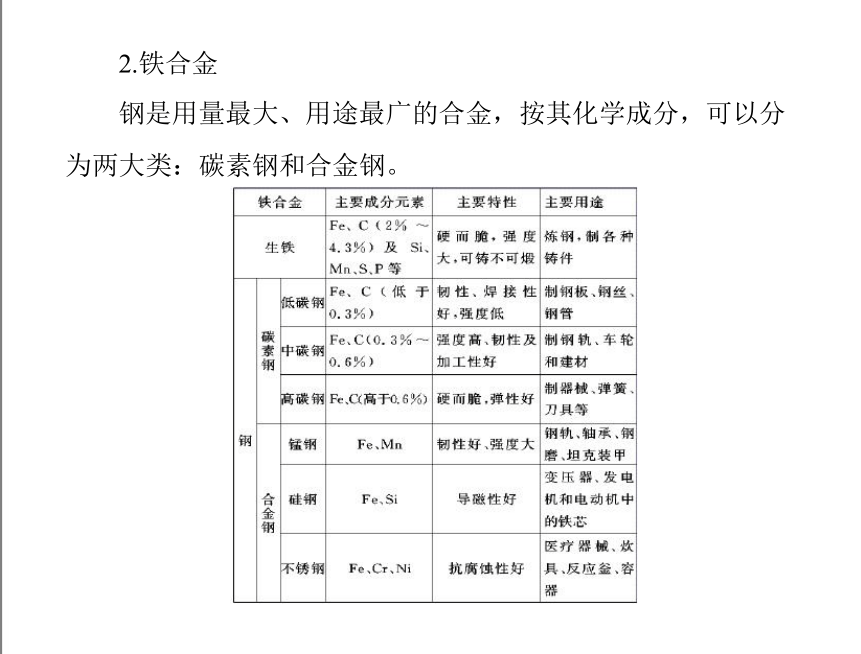
2.铁合金
钢是用量最大、用途最广的合金,按其化学成分,可以分
为两大类:碳素钢和合金钢。
合金一般性质的考查
[例1]下列有关合金的叙述正确的是(
)
A.合金的密度比各成分金属小
B.合金的抗腐性能都很好
C.多数合金比成分金属熔点低、硬度大
D.金属之间都可以通过加热形成性能各异的合金
解析:合金的密度一般介于成分金属的密度之间,A项错;
不是所有的合金抗腐性都很好,B 项错;只有具有相近的熔点
范围的金属才能形成合金,如钠的沸点为883 ℃,铁的熔点为1
535 ℃,铁熔化时,钠早已变为气体而无法熔合,D 项错。
答案:C
1.(2011 年安徽安庆检测)铝镁合金因坚硬、轻巧、美观、
洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、
B.导电性好
D.强度高
A.不易生锈
C.密度小
答案:B
铁合金性质的考查
[例2](双选)有资料显示,铝元素在人体内的残留积累量过
多后对大脑发育有不良影响,建议多用不锈钢替代铝合金作为
A.不锈钢中的主要元素是镍、铬
B.不锈钢属于铁合金
C.不锈钢是无腐蚀性的
D.不锈钢在任何条件下都不被腐蚀的
合金相对于成分金属来说具有更优秀的物理性能或
机械性能,但合金仍具有成分金属的化学性质。
解析:不锈钢是含有镍、铬元素的铁合金,主要成分还是
铁。不锈钢本身无腐蚀性,耐腐蚀性也很强,但不锈钢也并不
是绝对不能被腐蚀的。
答案:AD
2.将 10 g 铁碳合金放入氧气中高温灼烧,反应后的二氧化
碳通入过量石灰水中得到沉淀 1.4 g。则此铁碳合金是(
)
A.生铁
C.中碳钢
B.高碳钢
D.低碳钢
答案:B
3.某兴趣小组的同学们探索一合金的成分。取适量合金粉
末于试管中,加入足量盐酸后加热,有大量气泡产生,最终得
到浅绿色溶液,试管底部残留少量黑色粉末。过滤上述溶液,
将所得黑色粉末点燃,产生的气体可以使澄清石灰水混浊。据
A.Cu
B.Fe
C. Al
D.C
答案:A
以合金为背景的信息题
[例3](双选)单质钛的机械强度高,抗腐蚀能力强,工业上
常用硫酸分解钛铁矿(FeTiO3)的方法制取二氧化钛,再由二氧化
钛制金属钛,主要反应有:
①FeTiO3+3H2SO4
②Ti(SO4)2+3H2O
Ti(SO4)2+FeSO4+3H2O
H2TiO3+2H2SO4
③H2TiO3
TiO2+H2O
④TiO2+2C+2Cl2
⑤TiCl4+2Mg
TiCl4+2CO
2MgCl2+Ti
下列叙述正确的是(
)
A.反应①是非氧化还原反应
B.反应②是复分解反应
C.反应④中 TiO2 是氧化剂
D.反应⑤说明了金属镁还原性比金属钛强
解析:①、②、③中元素化合价均未发生变化,是非氧化
还原反应。④、⑤属于氧化还原反应,④中氧化剂是 Cl2,还原
剂是 C,TiO2 既不是氧化剂,也不是还原剂。
答案:AD
4.(2011 年湖北武汉检测)钛和钛的合金被认为是 21 世纪
的重要材料,它们具有很多优良的性能,如熔点高、密度小、
可塑性好、易于加工,钛合金与人体有很好的“相容性”。根
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于制造船舶
答案:A
第三章 金属及其化合物
第三节
用途广泛的金属材料
1.了解合金的概念及其重要应用。
2.认识几种常见的合金及其应用。
临清一中 郑忠强
一、合金
1.合金的定义
金属
金属或非金属
由一种________ 跟其他一种或几种_________________ 一
起熔合而成的具有______________的混合物。
金属特性
2.合金的性能
(1)合金的熔点一般比组成它的任何一种成分金属的熔点___。
(2)合金的硬度一般比组成它的各成分金属的硬度_____。
(3)有些合金在化学性质方面有很大改善,例如不锈钢比铁
耐腐蚀。
低
大
二、如何选用材料
选择材料时常常要考虑以下几个方面:①主要用途;②外
观;③物理性质(______、_______、______、_______、______);
④化学性质(___________、___________);⑤价格;⑥加工难度;
⑦正常维护;⑧对环境的影响。
密度
硬度
强度
导电性
导热性
对水的作用
耐腐蚀性
合金 主要成分 主要性能 主要用途
青铜 铜、锡 强度高、可塑性好、
耐磨、耐腐蚀 机械零件,如轴承、
齿轮等
黄铜 铜、锌 强度高、可塑性好、
易加工、耐腐蚀 机械零件、仪表、日
用品
白铜 铜、镍 光泽好、耐磨、耐
腐蚀、易加工 钱币、代替银做饰品
常见合金的重要应用
1.铜合金
2.铁合金
钢是用量最大、用途最广的合金,按其化学成分,可以分
为两大类:碳素钢和合金钢。
合金一般性质的考查
[例1]下列有关合金的叙述正确的是(
)
A.合金的密度比各成分金属小
B.合金的抗腐性能都很好
C.多数合金比成分金属熔点低、硬度大
D.金属之间都可以通过加热形成性能各异的合金
解析:合金的密度一般介于成分金属的密度之间,A项错;
不是所有的合金抗腐性都很好,B 项错;只有具有相近的熔点
范围的金属才能形成合金,如钠的沸点为883 ℃,铁的熔点为1
535 ℃,铁熔化时,钠早已变为气体而无法熔合,D 项错。
答案:C
1.(2011 年安徽安庆检测)铝镁合金因坚硬、轻巧、美观、
洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、
B.导电性好
D.强度高
A.不易生锈
C.密度小
答案:B
铁合金性质的考查
[例2](双选)有资料显示,铝元素在人体内的残留积累量过
多后对大脑发育有不良影响,建议多用不锈钢替代铝合金作为
A.不锈钢中的主要元素是镍、铬
B.不锈钢属于铁合金
C.不锈钢是无腐蚀性的
D.不锈钢在任何条件下都不被腐蚀的
合金相对于成分金属来说具有更优秀的物理性能或
机械性能,但合金仍具有成分金属的化学性质。
解析:不锈钢是含有镍、铬元素的铁合金,主要成分还是
铁。不锈钢本身无腐蚀性,耐腐蚀性也很强,但不锈钢也并不
是绝对不能被腐蚀的。
答案:AD
2.将 10 g 铁碳合金放入氧气中高温灼烧,反应后的二氧化
碳通入过量石灰水中得到沉淀 1.4 g。则此铁碳合金是(
)
A.生铁
C.中碳钢
B.高碳钢
D.低碳钢
答案:B
3.某兴趣小组的同学们探索一合金的成分。取适量合金粉
末于试管中,加入足量盐酸后加热,有大量气泡产生,最终得
到浅绿色溶液,试管底部残留少量黑色粉末。过滤上述溶液,
将所得黑色粉末点燃,产生的气体可以使澄清石灰水混浊。据
A.Cu
B.Fe
C. Al
D.C
答案:A
以合金为背景的信息题
[例3](双选)单质钛的机械强度高,抗腐蚀能力强,工业上
常用硫酸分解钛铁矿(FeTiO3)的方法制取二氧化钛,再由二氧化
钛制金属钛,主要反应有:
①FeTiO3+3H2SO4
②Ti(SO4)2+3H2O
Ti(SO4)2+FeSO4+3H2O
H2TiO3+2H2SO4
③H2TiO3
TiO2+H2O
④TiO2+2C+2Cl2
⑤TiCl4+2Mg
TiCl4+2CO
2MgCl2+Ti
下列叙述正确的是(
)
A.反应①是非氧化还原反应
B.反应②是复分解反应
C.反应④中 TiO2 是氧化剂
D.反应⑤说明了金属镁还原性比金属钛强
解析:①、②、③中元素化合价均未发生变化,是非氧化
还原反应。④、⑤属于氧化还原反应,④中氧化剂是 Cl2,还原
剂是 C,TiO2 既不是氧化剂,也不是还原剂。
答案:AD
4.(2011 年湖北武汉检测)钛和钛的合金被认为是 21 世纪
的重要材料,它们具有很多优良的性能,如熔点高、密度小、
可塑性好、易于加工,钛合金与人体有很好的“相容性”。根
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于制造船舶
答案:A
