山东省临清市人教版化学必修1课件:第4章 第1节 无机非金属材料的主角--硅
文档属性
| 名称 | 山东省临清市人教版化学必修1课件:第4章 第1节 无机非金属材料的主角--硅 |  | |
| 格式 | rar | ||
| 文件大小 | 554.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 21:18:39 | ||
图片预览











文档简介
(共54张PPT)
学习目标
1.了解SiO2、H2SiO3的主要性质。
2.了解硅、硅酸盐的主要性质。
3.了解几种重要无机非金属材料的生产及用途。
4.了解晶体硅的重要用途。
硅在地壳中的含量仅次于 ,硅的氧化物和硅酸盐约占地壳质量的90%以上;硅原子最外层有 个电子,主要形成 价的化合物。
基础知识梳理
氧
4
+4
一、二氧化硅
1.存在
存在形态有 形和 形两大类,水晶、玛瑙的主要成分是结晶的二氧化硅。
2.物理性质
熔点 硬度 溶解性
高 大 不溶于水
无定
结晶
3.化学性质
4.用途
(1)沙子是基本的建筑材料。
(2)纯净的SiO2是现代光学及光纤制品的基本原料,可以制作光导纤维。
(3) 和玛瑙制作饰物和工艺品。
石英
保存NaOH溶液时能使用玻璃塞吗?为什么?
【思考·提示】 不能。因NaOH会与玻璃的主要成分SiO2反应,生成的Na2SiO3溶液会使瓶塞与瓶壁粘连在一起。
思考
二、硅酸
1.硅酸的性质
(1)弱酸性
向Na2SiO3溶液中通入CO2,反应的化学方程式为Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3。
结论:H2SiO3酸性比H2CO3酸性 。
(2)不稳定性
弱
2.硅酸的制备
可溶的硅酸盐与较强的酸反应可制得硅酸,Na2SiO3与盐酸反应的化学方程式为Na2SiO3+2HCl===H2SiO3↓+2NaCl。
3.硅酸的存在及用途
(1)浓度小时:形成硅酸溶胶;
(2)浓度大时:形成 。
(3)硅胶
硅酸凝胶经干燥脱水得到的硅酸干凝胶称为“ ”,具有强的 ,常用作干燥剂或催化剂的载体。
硅胶
吸水性
硅酸凝胶
三、硅酸盐
1.概念:硅酸盐是由硅、氧和金属元素组成的化合物的总称。
2.硅酸盐的性质
硅酸盐是一类结构复杂的固态物质,大多不溶于水,化学性质很 。
稳定
3.硅酸盐组成的表示
通常用二氧化硅和金属氧化物的组合形式表示其组成。
例如:Na2SiO3: ;
长石KAlSi3O8: ;
4.最常见的硅酸盐——Na2SiO3
Na2SiO3的水溶液俗称 ,能制备硅胶和木材防火剂。
水玻璃
Na2O·SiO2
K2O·Al2O3·6SiO2
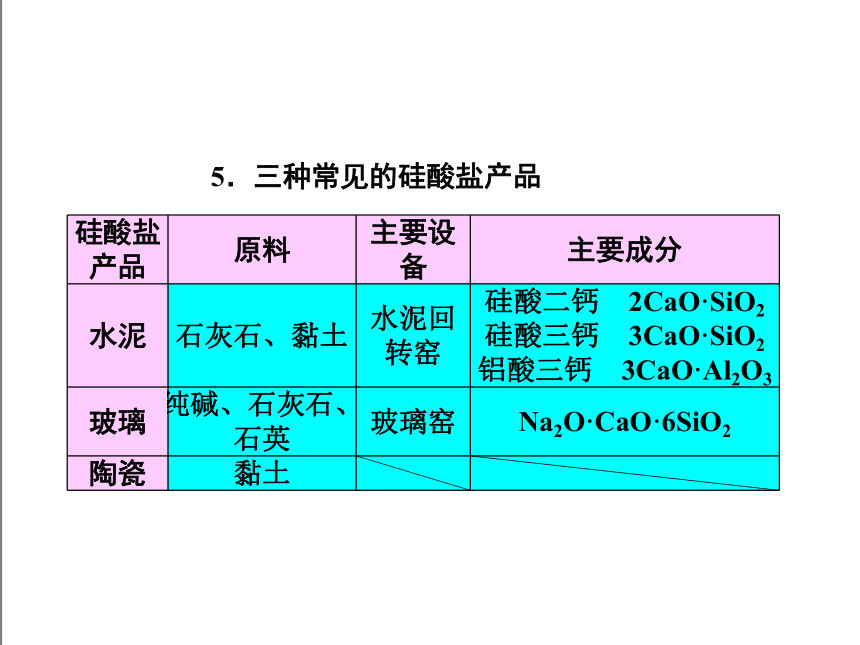
5.三种常见的硅酸盐产品
硅酸盐产品 原料 主要设备 主要成分
水泥 石灰石、黏土 水泥回转窑 硅酸二钙 2CaO·SiO2硅酸三钙 3CaO·SiO2铝酸三钙 3CaO·Al2O3
玻璃 纯碱、石灰石、石英 玻璃窑 Na2O·CaO·6SiO2
陶瓷 黏土
6.其他含硅的物质
物质 性质 用途
SiC 俗称金刚砂,具有 结构,硬度很大 砂纸、砂轮的磨料
含4%硅的硅钢 很高的导磁性 变压器铁芯
硅橡胶 既耐 ,又耐 ,在-60 ℃~250 ℃保持良好的弹性 制火箭、导弹、飞机的零件和绝缘材料
人工制造分子筛(铝硅酸盐) 有均匀微孔结构 作吸附剂和催化剂
金刚石
低温
高温
四、硅单质
1.种类:单质硅有 和 两类。
2.结构:晶体硅的结构与金刚石相似。
3.性质
(1)物理性质:
晶体
无定形
色、态 光泽 熔点 硬度 质地 导电性
灰黑色固体 金属光泽 高 大 脆 半导体
(2)化学性质:在常温下化学性质不活泼,但能与 、 发生反应。
4.用途
(1)半导体材料,如硅芯片等。
(2)新型能源,如光电池等。
氢氟酸
强碱
课堂互动讲练
要点一
CO2和SiO2的比较
CO2 SiO2
不同点 熔、沸点 低 高
状态 气态 无色晶体
与水反应 CO2+H2O??H2CO3 不反应
与酸反应 不反应 只与氢氟酸反应SiO2+4HF===SiF4↑+2H2O
虽然SiO2既能与NaOH溶液反应,也能与氢氟酸反应,但SiO2却不属于两性氧化物而属于酸性氧化物。
特别提醒
下列关于SiO2和CO2的说法中正确的是( )
A.CO2、SiO2分别是碳酸和硅酸的酸酐
B.CO2和SiO2与水反应分别生成相应的酸
C.CO2是酸性氧化物,SiO2是两性氧化物
D.CO2和SiO2都是由相应的分子组成的
例1
【解析】 虽然SiO2是H2SiO3的酸酐,但CO2可溶于水生成H2CO3,SiO2却不能溶于水生成H2SiO3,B错误;SiO2与CO2都是酸酐,都是酸性氧化物,A正确,C错误;CO2是由CO2分子构成的,而SiO2则是由硅原子和氧原子构成的,SiO2中不存在分子,D错误。
【答案】 A
1.下列关于二氧化硅的说法中正确的是( )
A.二氧化硅分子由一个硅原子和两个氧原子构成
B.在二氧化硅晶体中,每个硅原子周围结合4个氧原子
C.二氧化硅可用来制作干燥剂
D.二氧化硅是酸性氧化物,它不溶于任何酸
变式训练
解析:选B。SiO2晶体中不存在单个分子,其结构中每个硅原子周围结合4个氧原子,每个氧原子周围结合2个硅原子,所以硅原子与氧原子的个数比为1∶2,化学式写作SiO2,故A错误,B正确;硅酸在一定条件下制得硅胶,硅胶可用作干燥剂,C错误。SiO2是酸性氧化物,但常温下可与氢氟酸反应,D错误。
1.硅酸
二氧化硅对应的水化物是硅酸。
(1)性质
①硅酸为白色固体,难溶于水。
②酸性极弱,比碳酸还弱,不能使指示剂发生变色,只能与强碱反应,例如:
H2SiO3+2NaOH===Na2SiO3+2H2O
③硅酸不稳定,受热易分解,反应的化学方程式为:
要点二
硅酸与碳酸的对比
(2)制备
由于二氧化硅不能与水化合,所以制备硅酸时只能使用间接的方法,如向Na2SiO3溶液中滴加盐酸或通入CO2气体等,利用的原理都是:强酸+弱酸盐―→弱酸+强酸盐。如:CO2+Na2SiO3+H2O===H2SiO3↓+Na2CO3
2.碳酸
二氧化碳对应的水化物是碳酸(H2CO3),碳酸的酸性很弱(但比H2SiO3强),且很不稳定。
H2CO3===H2O+CO2↑
因此,有关碳酸的化学反应通常用二氧化碳和水来代替。
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
例2
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为________。
(2)装置B所盛的试剂是_______________ ________________________________________________________,
其作用是___________________________ ______________________________________。
(3)装置C所盛试剂是__________________ ______________________________________,
C中反应的离子方程式是______________ ______________________________________。
(4)由此得到的结论是:酸性:____>____>____。
【思路点拨】 解答本题要注意以下两点:
(1)酸性强弱关系比较可利用“强酸+弱酸盐―→弱酸+强酸盐”。
(2)可先制备CO2,再制备H2SiO3,由此选择合适的药品。
【解析】 根据强酸+弱酸盐―→弱酸+强酸盐分析可知,分液漏斗中盛装盐酸,A中盛放Na2CO3,根据Na2CO3+2HCl===2NaCl+H2O+CO2↑可以知道酸性HCl强于H2CO3,然后将生成的CO2通入Na2SiO3溶液中,反应为Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,由此判断酸性H2CO3>H2SiO3,但需注意的是A中反应会有HCl气体逸出,故通入Na2SiO3溶液前需将HCl吸收,但不能吸收CO2,故可选用饱和NaHCO3溶液。
【答案】 (1)盐酸 (2)饱和NaHCO3溶液 吸收HCl气体 (3)Na2SiO3溶液 SiO32-+CO2+H2O===H2SiO3↓+CO32- (4)HCl H2CO3 H2SiO3
2.下列离子方程式书写不正确的是( )
A.往NaOH溶液中通入少量CO2:
CO2+OH-===HCO3-
B.H2SiO3与NaOH溶液混合:
2OH-+H2SiO3===2H2O+SiO32-
C.石英砂与烧碱反应制水玻璃:
SiO2+2OH-===SiO32-+H2O
D.往水玻璃中通入二氧化碳:
Na2SiO3+H2O+CO2===H2SiO3↓+2Na++CO32-
变式训练
解析:选AD。A项中通入少量CO2,应生成Na2CO3,而不是NaHCO3,故错误。B项中H2SiO3是难溶性酸,在离子方程式中应写化学式,正确。C、D中Na2SiO3为钠盐,溶于水,写离子形式,所以C项正确,D项错误。
1.硅的化学性质
常温下,硅的化学性质不活泼。加热时可与一些非金属及其他物质反应。
(1)常温下,除能与氟气、氢氟酸和强碱反应外,硅不与氧气、氯气、硫酸、硝酸、盐酸等其他物质发生反应。
①与氟气反应:Si+2F2===SiF4;
②与氢氟酸反应:Si+4HF===SiF4↑+2H2↑;
③与NaOH溶液反应:
Si+2NaOH+H2O===Na2SiO3+2H2↑。
要点三
单质硅的化学性质及制备
(2)加热时,硅能与氧气、氯气等反应,也能与碳反应。
2.硅的制备
硅单质是由其氧化物制得的,主要分为两个阶段:
1.Si是能与NaOH溶液反应放出H2的非金属单质,Al是能与NaOH溶液反应放出H2的金属单质,推断题中常以此点作为突破口。
特别提醒
(2008年高考广东卷改编题)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
例3
①写出由纯SiHCl3制备高纯硅的化学反应方程式__________________________________ _______________________________________________________________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式________ ____________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是______________ __________________________________________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产砂纸、砂轮等
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
【思路点拨】 解答本题要注意以下三点:
(1)注意化学反应发生的条件。
(2)分析题目所给信息:无水无氧。
(3)根据性质分析用途。
②SiHCl3与H2O反应生成H2SiO3、HCl和H2;用H2还原SiHCl3过程中若混入O2,则高温下H2与O2反应发生爆炸。
(2)A项,碳化硅硬度很大,可用于生产砂纸、砂轮等,B项,氮化硅熔点高,硬度大,可用于制作高温陶瓷或轴承。
②SiHCl3+3H2O===H2SiO3↓+3HCl+H2↑
高温下H2与O2混合发生爆炸 (2)ABC
3.下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
变式训练
解析:选C。常温下,硅可与氟气、氢氟酸、强碱溶液等反应;加热和高温条件下,硅能与氧气、氢气起反应。
硅酸盐由于组成比较复杂,通常用二氧化硅和金属氧化物的形式表示其组成,改写时的规律为:
1.氧化物的排列顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。
2.氧化物之间以“·”隔开。
3.氧化物前的化学计量数配置原则:各元素原子总个数比符合原来的组成。
要点四
硅酸盐的氧化物形式的改写
4.化学计量数配置出现分数时应化为整数。
由于硅酸盐的组成与结构很复杂,为了简化对硅酸盐组成的表示方法,采用了氧化物法,实际上硅酸盐不是以简单氧化物形式存在的,而是以种种结构复杂的盐的形式存在的。
特别提醒
用氧化物的形式表示硅酸盐的组成,其中正确的是( )
A.钙沸石[Ca(Al2Si3O10)·3H2O],表示为
Al2O3·CaO·3SiO2·3H2O
例4
C.钾云母(K2Al6Si6H4O24),表示为
K2O·2H2O·3Al2O3·6SiO2
D.石棉[CaMg3Si4O12],表示为CaO·3MgO·4SiO2
【答案】 D
4.钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4]时反应的离子方程式为:
2KAlSi3O8+2H2CO3+5H2O===2K++2HCO3-+4H2SiO3+Al2Si2O5(OH)4
(1)将上述复杂硅酸盐改写成氧化物形式:
①KAlSi3O8_______________________;
②Al2Si2O5(OH)4______________________。
(2)上述反应能够发生的原因是__________ ________________________________________。
变式训练
解析:(1)将复杂硅酸盐化学式改写成氧化物时,只需将除O以外所有的元素写成其常见氧化物,并用“·”将它们合起来,但需注意各种原子个数比符合原来的组成,并在某种(或几种)氧化物前加合适系数。
①KAlSi3O8:K2O·Al2O3·6SiO2
②Al2Si2O5(OH)4:Al2O3·2SiO2·2H2O
(2)分析反应前后物质的种类,可知属于酸与盐发生的复分解反应,由于H2CO3酸性强于H2SiO3,发生了较强的酸制较弱的酸的反应。
答案:(1)①K2O·Al2O3·6SiO2
②Al2O3·2SiO2·2H2O
(2)H2CO3的酸性比H2SiO3的酸性强
当堂达标训练
课时活页训练
学习目标
1.了解SiO2、H2SiO3的主要性质。
2.了解硅、硅酸盐的主要性质。
3.了解几种重要无机非金属材料的生产及用途。
4.了解晶体硅的重要用途。
硅在地壳中的含量仅次于 ,硅的氧化物和硅酸盐约占地壳质量的90%以上;硅原子最外层有 个电子,主要形成 价的化合物。
基础知识梳理
氧
4
+4
一、二氧化硅
1.存在
存在形态有 形和 形两大类,水晶、玛瑙的主要成分是结晶的二氧化硅。
2.物理性质
熔点 硬度 溶解性
高 大 不溶于水
无定
结晶
3.化学性质
4.用途
(1)沙子是基本的建筑材料。
(2)纯净的SiO2是现代光学及光纤制品的基本原料,可以制作光导纤维。
(3) 和玛瑙制作饰物和工艺品。
石英
保存NaOH溶液时能使用玻璃塞吗?为什么?
【思考·提示】 不能。因NaOH会与玻璃的主要成分SiO2反应,生成的Na2SiO3溶液会使瓶塞与瓶壁粘连在一起。
思考
二、硅酸
1.硅酸的性质
(1)弱酸性
向Na2SiO3溶液中通入CO2,反应的化学方程式为Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3。
结论:H2SiO3酸性比H2CO3酸性 。
(2)不稳定性
弱
2.硅酸的制备
可溶的硅酸盐与较强的酸反应可制得硅酸,Na2SiO3与盐酸反应的化学方程式为Na2SiO3+2HCl===H2SiO3↓+2NaCl。
3.硅酸的存在及用途
(1)浓度小时:形成硅酸溶胶;
(2)浓度大时:形成 。
(3)硅胶
硅酸凝胶经干燥脱水得到的硅酸干凝胶称为“ ”,具有强的 ,常用作干燥剂或催化剂的载体。
硅胶
吸水性
硅酸凝胶
三、硅酸盐
1.概念:硅酸盐是由硅、氧和金属元素组成的化合物的总称。
2.硅酸盐的性质
硅酸盐是一类结构复杂的固态物质,大多不溶于水,化学性质很 。
稳定
3.硅酸盐组成的表示
通常用二氧化硅和金属氧化物的组合形式表示其组成。
例如:Na2SiO3: ;
长石KAlSi3O8: ;
4.最常见的硅酸盐——Na2SiO3
Na2SiO3的水溶液俗称 ,能制备硅胶和木材防火剂。
水玻璃
Na2O·SiO2
K2O·Al2O3·6SiO2
5.三种常见的硅酸盐产品
硅酸盐产品 原料 主要设备 主要成分
水泥 石灰石、黏土 水泥回转窑 硅酸二钙 2CaO·SiO2硅酸三钙 3CaO·SiO2铝酸三钙 3CaO·Al2O3
玻璃 纯碱、石灰石、石英 玻璃窑 Na2O·CaO·6SiO2
陶瓷 黏土
6.其他含硅的物质
物质 性质 用途
SiC 俗称金刚砂,具有 结构,硬度很大 砂纸、砂轮的磨料
含4%硅的硅钢 很高的导磁性 变压器铁芯
硅橡胶 既耐 ,又耐 ,在-60 ℃~250 ℃保持良好的弹性 制火箭、导弹、飞机的零件和绝缘材料
人工制造分子筛(铝硅酸盐) 有均匀微孔结构 作吸附剂和催化剂
金刚石
低温
高温
四、硅单质
1.种类:单质硅有 和 两类。
2.结构:晶体硅的结构与金刚石相似。
3.性质
(1)物理性质:
晶体
无定形
色、态 光泽 熔点 硬度 质地 导电性
灰黑色固体 金属光泽 高 大 脆 半导体
(2)化学性质:在常温下化学性质不活泼,但能与 、 发生反应。
4.用途
(1)半导体材料,如硅芯片等。
(2)新型能源,如光电池等。
氢氟酸
强碱
课堂互动讲练
要点一
CO2和SiO2的比较
CO2 SiO2
不同点 熔、沸点 低 高
状态 气态 无色晶体
与水反应 CO2+H2O??H2CO3 不反应
与酸反应 不反应 只与氢氟酸反应SiO2+4HF===SiF4↑+2H2O
虽然SiO2既能与NaOH溶液反应,也能与氢氟酸反应,但SiO2却不属于两性氧化物而属于酸性氧化物。
特别提醒
下列关于SiO2和CO2的说法中正确的是( )
A.CO2、SiO2分别是碳酸和硅酸的酸酐
B.CO2和SiO2与水反应分别生成相应的酸
C.CO2是酸性氧化物,SiO2是两性氧化物
D.CO2和SiO2都是由相应的分子组成的
例1
【解析】 虽然SiO2是H2SiO3的酸酐,但CO2可溶于水生成H2CO3,SiO2却不能溶于水生成H2SiO3,B错误;SiO2与CO2都是酸酐,都是酸性氧化物,A正确,C错误;CO2是由CO2分子构成的,而SiO2则是由硅原子和氧原子构成的,SiO2中不存在分子,D错误。
【答案】 A
1.下列关于二氧化硅的说法中正确的是( )
A.二氧化硅分子由一个硅原子和两个氧原子构成
B.在二氧化硅晶体中,每个硅原子周围结合4个氧原子
C.二氧化硅可用来制作干燥剂
D.二氧化硅是酸性氧化物,它不溶于任何酸
变式训练
解析:选B。SiO2晶体中不存在单个分子,其结构中每个硅原子周围结合4个氧原子,每个氧原子周围结合2个硅原子,所以硅原子与氧原子的个数比为1∶2,化学式写作SiO2,故A错误,B正确;硅酸在一定条件下制得硅胶,硅胶可用作干燥剂,C错误。SiO2是酸性氧化物,但常温下可与氢氟酸反应,D错误。
1.硅酸
二氧化硅对应的水化物是硅酸。
(1)性质
①硅酸为白色固体,难溶于水。
②酸性极弱,比碳酸还弱,不能使指示剂发生变色,只能与强碱反应,例如:
H2SiO3+2NaOH===Na2SiO3+2H2O
③硅酸不稳定,受热易分解,反应的化学方程式为:
要点二
硅酸与碳酸的对比
(2)制备
由于二氧化硅不能与水化合,所以制备硅酸时只能使用间接的方法,如向Na2SiO3溶液中滴加盐酸或通入CO2气体等,利用的原理都是:强酸+弱酸盐―→弱酸+强酸盐。如:CO2+Na2SiO3+H2O===H2SiO3↓+Na2CO3
2.碳酸
二氧化碳对应的水化物是碳酸(H2CO3),碳酸的酸性很弱(但比H2SiO3强),且很不稳定。
H2CO3===H2O+CO2↑
因此,有关碳酸的化学反应通常用二氧化碳和水来代替。
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
例2
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为________。
(2)装置B所盛的试剂是_______________ ________________________________________________________,
其作用是___________________________ ______________________________________。
(3)装置C所盛试剂是__________________ ______________________________________,
C中反应的离子方程式是______________ ______________________________________。
(4)由此得到的结论是:酸性:____>____>____。
【思路点拨】 解答本题要注意以下两点:
(1)酸性强弱关系比较可利用“强酸+弱酸盐―→弱酸+强酸盐”。
(2)可先制备CO2,再制备H2SiO3,由此选择合适的药品。
【解析】 根据强酸+弱酸盐―→弱酸+强酸盐分析可知,分液漏斗中盛装盐酸,A中盛放Na2CO3,根据Na2CO3+2HCl===2NaCl+H2O+CO2↑可以知道酸性HCl强于H2CO3,然后将生成的CO2通入Na2SiO3溶液中,反应为Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,由此判断酸性H2CO3>H2SiO3,但需注意的是A中反应会有HCl气体逸出,故通入Na2SiO3溶液前需将HCl吸收,但不能吸收CO2,故可选用饱和NaHCO3溶液。
【答案】 (1)盐酸 (2)饱和NaHCO3溶液 吸收HCl气体 (3)Na2SiO3溶液 SiO32-+CO2+H2O===H2SiO3↓+CO32- (4)HCl H2CO3 H2SiO3
2.下列离子方程式书写不正确的是( )
A.往NaOH溶液中通入少量CO2:
CO2+OH-===HCO3-
B.H2SiO3与NaOH溶液混合:
2OH-+H2SiO3===2H2O+SiO32-
C.石英砂与烧碱反应制水玻璃:
SiO2+2OH-===SiO32-+H2O
D.往水玻璃中通入二氧化碳:
Na2SiO3+H2O+CO2===H2SiO3↓+2Na++CO32-
变式训练
解析:选AD。A项中通入少量CO2,应生成Na2CO3,而不是NaHCO3,故错误。B项中H2SiO3是难溶性酸,在离子方程式中应写化学式,正确。C、D中Na2SiO3为钠盐,溶于水,写离子形式,所以C项正确,D项错误。
1.硅的化学性质
常温下,硅的化学性质不活泼。加热时可与一些非金属及其他物质反应。
(1)常温下,除能与氟气、氢氟酸和强碱反应外,硅不与氧气、氯气、硫酸、硝酸、盐酸等其他物质发生反应。
①与氟气反应:Si+2F2===SiF4;
②与氢氟酸反应:Si+4HF===SiF4↑+2H2↑;
③与NaOH溶液反应:
Si+2NaOH+H2O===Na2SiO3+2H2↑。
要点三
单质硅的化学性质及制备
(2)加热时,硅能与氧气、氯气等反应,也能与碳反应。
2.硅的制备
硅单质是由其氧化物制得的,主要分为两个阶段:
1.Si是能与NaOH溶液反应放出H2的非金属单质,Al是能与NaOH溶液反应放出H2的金属单质,推断题中常以此点作为突破口。
特别提醒
(2008年高考广东卷改编题)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
例3
①写出由纯SiHCl3制备高纯硅的化学反应方程式__________________________________ _______________________________________________________________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式________ ____________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是______________ __________________________________________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产砂纸、砂轮等
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
【思路点拨】 解答本题要注意以下三点:
(1)注意化学反应发生的条件。
(2)分析题目所给信息:无水无氧。
(3)根据性质分析用途。
②SiHCl3与H2O反应生成H2SiO3、HCl和H2;用H2还原SiHCl3过程中若混入O2,则高温下H2与O2反应发生爆炸。
(2)A项,碳化硅硬度很大,可用于生产砂纸、砂轮等,B项,氮化硅熔点高,硬度大,可用于制作高温陶瓷或轴承。
②SiHCl3+3H2O===H2SiO3↓+3HCl+H2↑
高温下H2与O2混合发生爆炸 (2)ABC
3.下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
变式训练
解析:选C。常温下,硅可与氟气、氢氟酸、强碱溶液等反应;加热和高温条件下,硅能与氧气、氢气起反应。
硅酸盐由于组成比较复杂,通常用二氧化硅和金属氧化物的形式表示其组成,改写时的规律为:
1.氧化物的排列顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。
2.氧化物之间以“·”隔开。
3.氧化物前的化学计量数配置原则:各元素原子总个数比符合原来的组成。
要点四
硅酸盐的氧化物形式的改写
4.化学计量数配置出现分数时应化为整数。
由于硅酸盐的组成与结构很复杂,为了简化对硅酸盐组成的表示方法,采用了氧化物法,实际上硅酸盐不是以简单氧化物形式存在的,而是以种种结构复杂的盐的形式存在的。
特别提醒
用氧化物的形式表示硅酸盐的组成,其中正确的是( )
A.钙沸石[Ca(Al2Si3O10)·3H2O],表示为
Al2O3·CaO·3SiO2·3H2O
例4
C.钾云母(K2Al6Si6H4O24),表示为
K2O·2H2O·3Al2O3·6SiO2
D.石棉[CaMg3Si4O12],表示为CaO·3MgO·4SiO2
【答案】 D
4.钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4]时反应的离子方程式为:
2KAlSi3O8+2H2CO3+5H2O===2K++2HCO3-+4H2SiO3+Al2Si2O5(OH)4
(1)将上述复杂硅酸盐改写成氧化物形式:
①KAlSi3O8_______________________;
②Al2Si2O5(OH)4______________________。
(2)上述反应能够发生的原因是__________ ________________________________________。
变式训练
解析:(1)将复杂硅酸盐化学式改写成氧化物时,只需将除O以外所有的元素写成其常见氧化物,并用“·”将它们合起来,但需注意各种原子个数比符合原来的组成,并在某种(或几种)氧化物前加合适系数。
①KAlSi3O8:K2O·Al2O3·6SiO2
②Al2Si2O5(OH)4:Al2O3·2SiO2·2H2O
(2)分析反应前后物质的种类,可知属于酸与盐发生的复分解反应,由于H2CO3酸性强于H2SiO3,发生了较强的酸制较弱的酸的反应。
答案:(1)①K2O·Al2O3·6SiO2
②Al2O3·2SiO2·2H2O
(2)H2CO3的酸性比H2SiO3的酸性强
当堂达标训练
课时活页训练
