山东省临清市人教版化学必修1课件:第4章 第2节 富集在海水中的元素--氯
文档属性
| 名称 | 山东省临清市人教版化学必修1课件:第4章 第2节 富集在海水中的元素--氯 |  | |
| 格式 | rar | ||
| 文件大小 | 499.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 21:18:39 | ||
图片预览









文档简介
(共38张PPT)
学习目标
1.了解氯元素单质及其重要化合物的主要性质及应用。
2.了解实验室制取Cl2的原理和实验装置。
3.掌握Cl-的检验方法。
一、活泼的黄绿色气体——氯气(Cl2)
1.氯的原子结构及存在
(1)原子结构
原子结构示意图为??? ,氯原子容易得到一
个电子而形成Cl-,表现为典型的 性。
基础知识梳理
非金属
氯在自然界中以 态存在,主要以 的形式存在。
化合
NaCl
2.氯气的发现
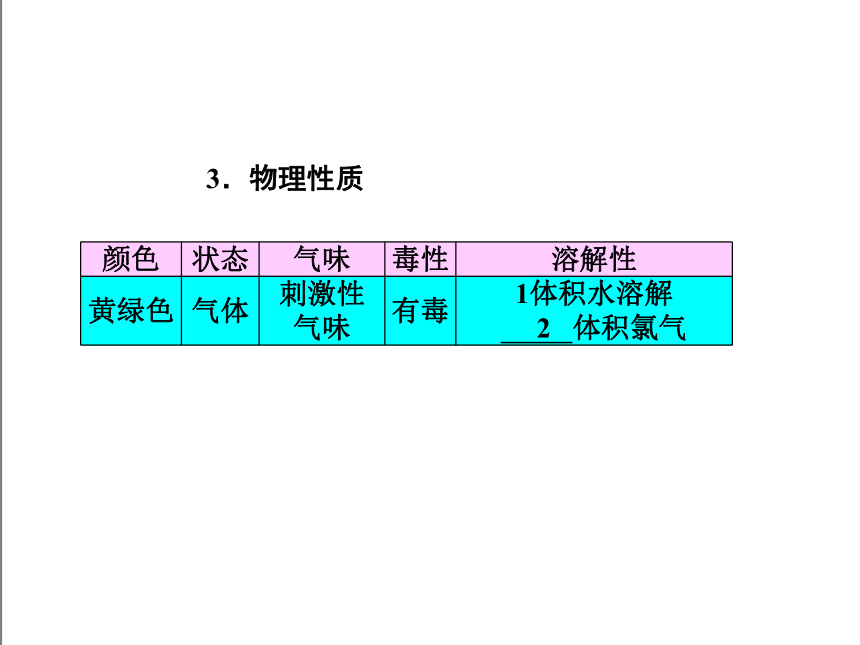
3.物理性质
颜色 状态 气味 毒性 溶解性
黄绿色 气体 刺激性
气味 有毒 1体积水溶解
2 体积氯气
4.化学性质
Cl2的化学性质很活泼,具有很强的 性。
(1)主要反应
氧化
苍白色
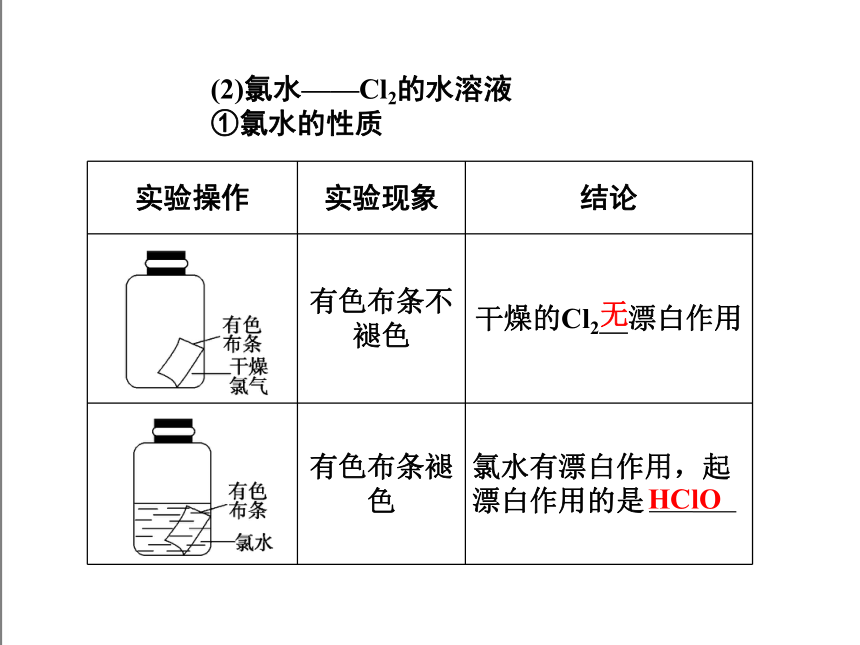
(2)氯水——Cl2的水溶液
①氯水的性质
实验操作 实验现象 结论
有色布条不褪色 干燥的Cl2 漂白作用
有色布条褪色 氯水有漂白作用,起漂白作用的是
无
HClO
②次氯酸的性质
弱
杀菌、消毒
(3)漂白剂的制取
①漂白液:反应的化学方程式为:Cl2+2NaOH===NaCl+NaClO+H2O,有效成分是 。
②漂白粉:反应的化学方程式为:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O,主要成分是 ,有效成分是 。
NaClO
CaCl2、Ca(ClO)2
Ca(ClO)2
(1)漂白粉和木炭都能使红墨水褪色,其原理相同吗?
(2)漂白粉露置于空气中会变质,发生的主要反应有哪些?
思考
【思考·提示】 (1)不同。漂白粉中的Ca(ClO)2在酸性溶液中具有强氧化性,使有色物质被氧化而褪色,而木炭则具有强的吸附性,可吸附色素而使红墨水褪色。
二、氯离子(Cl-)的检验
1.方法:先加 ,再加稀 。
2.现象:产生 ,加稀HNO3,沉淀
。
3.原理:Ag++Cl-===AgCl↓。
4.加稀硝酸的目的:排除 等离子的干扰。
AgNO3溶液
HNO3
白色沉淀
不溶解
CO32-
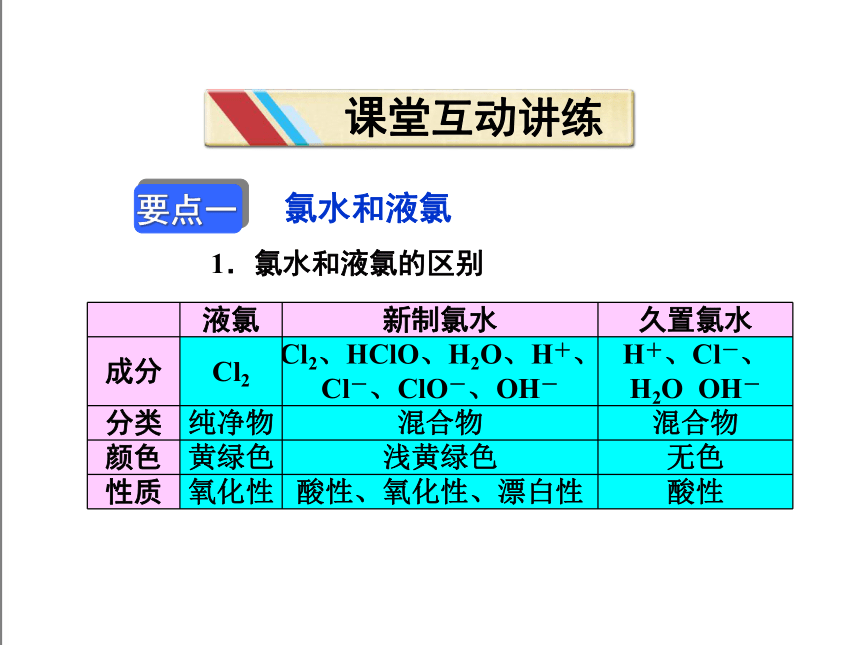
1.氯水和液氯的区别
课堂互动讲练
要点一
氯水和液氯
液氯 新制氯水 久置氯水
成分 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H+、Cl-、H2O OH-
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
2.新制氯水的性质
在不同的反应中,氯水起作用的成分不同,列表如下:
所加试剂 参与反应的微粒 实验现象 离子方程式或解释
AgNO3溶液 Cl- 白色沉淀 Cl-+Ag+===AgCl↓
Na2CO3固体 H+ 有气泡产生 2H++CO32-===CO2↑+H2O
有色布条 HClO 布条颜色褪去 发生氧化还原反应
FeCl2溶液 Cl2 溶液变棕黄色 2Fe2++Cl2===2Fe3++2Cl-
石蕊溶液 HClO、H+ 先变红后褪色 酸性和漂白性
镁粉 Cl2、H+ 氯水的颜色褪去并有气泡产生 Mg+Cl2===Mg2++2Cl-
Mg+2H+===Mg2++H2↑
氯水久置,会因HClO的分解导致其中的Cl2全部与H2O反应,HClO完全分解生成盐酸和O2,使溶液酸性增强,失去强氧化性而变质。
特别提醒
用滴管把新制的氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时,溶液的红色突然消失。对产生实验现象的原因有两种推测:①是氯水中的次氯酸的漂白性使它由红色变成无色;②是氯水的酸性(H+)使它由红色变成无色。假设其中一种是正确的。
请你设计一个实验,由实验现象对以上的推测作出判断。
(1)要使用的实验用品:_______________ ________________________________________________________________________________________________________________;
例1
(2)要进行的实验操作:____________ ________________________________________________________________________________________________________________;
(3)实验现象和结论:_______________ _______________________________________________________________________________________________________________。
【解析】 酚酞滴入碱液中呈红色,若①的推测正确,说明有色物质被次氯酸氧化,即酚酞已经变质,向其中加入NaOH溶液,溶液呈碱性,溶液不再变红色;若②的推测正确,向溶液中再加入NaOH溶液,溶液会呈红色。
【答案】 (1)NaOH溶液、pH试纸、玻璃棒
(2)向已褪色的溶液中滴加NaOH溶液至呈碱性
(3)滴加NaOH溶液后若溶液恢复红色说明推测②正确,若溶液仍为无色说明推测①正确
1.下列关于氯水的叙述,正确的是( )
A.新制氯水中只含有Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性增强
变式训练
解析:选BD。在新制的氯水中溶有大量Cl2分子,其中小部分Cl2与水发生反应生成盐酸和次氯酸,HCl完全电离成H+和Cl-,HClO部分电离产生H+、ClO-。所以氯水中含有H2O、Cl2、HClO分子和H+、Cl-、ClO-、OH-离子。HClO有强氧化性、漂白性,见光易分解放出O2。氯水放置数天后HClO分解接近完全,转化为盐酸,酸性增强。
1.反应原理
要点二
Cl2的实验室制取
主要仪器:铁架台、酒精灯、圆底烧瓶、分液漏斗、集气瓶、烧杯等。Cl2的制备、净化装置如图所示:
说明:C装置的作用是除去Cl2中的HCl,D装置的作用是干燥Cl2。F装置的作用是吸收多余的Cl2。
3.收集方法
(1)向上排空气法(Cl2密度大于空气)。
(2)排饱和食盐水法(Cl2在饱和NaCl溶液中的溶解度很小,且用此法可除去实验过程中挥发产生的HCl气体)。
4.尾气处理
Cl2有毒,易污染空气,需用NaOH溶液吸收。
气体的制备装置一般包括反应装置、除杂装置、收集装置、尾气处理装置等。反应装置的选择要依据反应物的状态和反应的条件。收集方法的选择应考虑气体密度、溶解性及在空气中的稳定性。是否处理尾气,要取决于该气体是否有毒。一个装置的选择实际上与气体的性质密切相关。
特别提醒
回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为_________________________________ _______________________________________________________________________________________________________________。
例2
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?____________,理由是__________ ______________________________________________________________。
(3)装置中能否省去盛浓硫酸的洗气瓶?_________________________________ ___________________________________,
理由是___________________________ _____________________________________________。
(4)装置中能否省去盛冰水的烧杯?______________,理由是____________。
【思路点拨】 解答本题要注意以下两点:
(1)分析实验原理,结合实验装置判断各种药品的作用。
(2)结合题中信息确定可能发生的副反应。
【答案】 (1)Cl2+2OH-===Cl-+ClO-+H2O
(2)否 氯气中混有的HCl气体进入大试管中也会和氢氧化钠溶液反应,降低了NaClO的产量和纯度
(3)能 少量水蒸气进入试管中不影响反应
(4)否 氯气和水的反应是放热反应,反应时温度升高,可能引起副反应,生成NaClO3
如制取NaClO3,需加热至70 ℃,而且要求温度较稳定,怎样才能实现?
【提示】 向烧杯内加入70 ℃的水,用温度计测量温度,用酒精灯进行间断性的水浴加热。
互动探究
2.在下图所示的装置中,A是Cl2发生装置,C、D为气体的净化装置,C中装有饱和食盐水,D中装有浓硫酸,E是硬质玻璃管(其中装有细铁丝网),F为干燥的广口瓶,烧杯G为尾气吸收装置。
变式训练
(1)A、B、G中各装有什么药品:
A________,B________,G________。
(2)分析A中生成的Cl2中可能含有哪些杂质气体?___________________________________ ____________________________________。
(3)为什么A中生成的气体一定要经过C、D两个装置?_______________________________ _______________________________________。
(4)反应时E中的现象为_______________,生成的物质是________(填化学式)。
(5)写出G和E中反应的化学方程式:_____ ___________________________________________________________________________________________________________________________________________。
解析:本题主要考查的是实验操作,应熟练地掌握实验室安全知识及注意事项。
由图可知,整套装置包括Cl2的发生、净化、与Fe粉的反应、收集和尾气吸收等几部分。由于浓盐酸易挥发,故生成的Cl2中必含有HCl和水蒸气等杂质,若不除去这些杂质,则会影响Cl2与Fe在高温下的反应,使生成物不纯。另外,FeCl3遇水极易水解变质,这一点将在以后学到。
答案:(1)MnO2 浓盐酸 NaOH溶液 (2)HCl和水蒸气 (3)除去HCl和水蒸气,否则会影响Cl2与Fe在高温下的反应,使生成物不纯 (4)有棕黄色烟 FeCl3
当堂达标训练
课时活页训练
学习目标
1.了解氯元素单质及其重要化合物的主要性质及应用。
2.了解实验室制取Cl2的原理和实验装置。
3.掌握Cl-的检验方法。
一、活泼的黄绿色气体——氯气(Cl2)
1.氯的原子结构及存在
(1)原子结构
原子结构示意图为??? ,氯原子容易得到一
个电子而形成Cl-,表现为典型的 性。
基础知识梳理
非金属
氯在自然界中以 态存在,主要以 的形式存在。
化合
NaCl
2.氯气的发现
3.物理性质
颜色 状态 气味 毒性 溶解性
黄绿色 气体 刺激性
气味 有毒 1体积水溶解
2 体积氯气
4.化学性质
Cl2的化学性质很活泼,具有很强的 性。
(1)主要反应
氧化
苍白色
(2)氯水——Cl2的水溶液
①氯水的性质
实验操作 实验现象 结论
有色布条不褪色 干燥的Cl2 漂白作用
有色布条褪色 氯水有漂白作用,起漂白作用的是
无
HClO
②次氯酸的性质
弱
杀菌、消毒
(3)漂白剂的制取
①漂白液:反应的化学方程式为:Cl2+2NaOH===NaCl+NaClO+H2O,有效成分是 。
②漂白粉:反应的化学方程式为:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O,主要成分是 ,有效成分是 。
NaClO
CaCl2、Ca(ClO)2
Ca(ClO)2
(1)漂白粉和木炭都能使红墨水褪色,其原理相同吗?
(2)漂白粉露置于空气中会变质,发生的主要反应有哪些?
思考
【思考·提示】 (1)不同。漂白粉中的Ca(ClO)2在酸性溶液中具有强氧化性,使有色物质被氧化而褪色,而木炭则具有强的吸附性,可吸附色素而使红墨水褪色。
二、氯离子(Cl-)的检验
1.方法:先加 ,再加稀 。
2.现象:产生 ,加稀HNO3,沉淀
。
3.原理:Ag++Cl-===AgCl↓。
4.加稀硝酸的目的:排除 等离子的干扰。
AgNO3溶液
HNO3
白色沉淀
不溶解
CO32-
1.氯水和液氯的区别
课堂互动讲练
要点一
氯水和液氯
液氯 新制氯水 久置氯水
成分 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H+、Cl-、H2O OH-
分类 纯净物 混合物 混合物
颜色 黄绿色 浅黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
2.新制氯水的性质
在不同的反应中,氯水起作用的成分不同,列表如下:
所加试剂 参与反应的微粒 实验现象 离子方程式或解释
AgNO3溶液 Cl- 白色沉淀 Cl-+Ag+===AgCl↓
Na2CO3固体 H+ 有气泡产生 2H++CO32-===CO2↑+H2O
有色布条 HClO 布条颜色褪去 发生氧化还原反应
FeCl2溶液 Cl2 溶液变棕黄色 2Fe2++Cl2===2Fe3++2Cl-
石蕊溶液 HClO、H+ 先变红后褪色 酸性和漂白性
镁粉 Cl2、H+ 氯水的颜色褪去并有气泡产生 Mg+Cl2===Mg2++2Cl-
Mg+2H+===Mg2++H2↑
氯水久置,会因HClO的分解导致其中的Cl2全部与H2O反应,HClO完全分解生成盐酸和O2,使溶液酸性增强,失去强氧化性而变质。
特别提醒
用滴管把新制的氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时,溶液的红色突然消失。对产生实验现象的原因有两种推测:①是氯水中的次氯酸的漂白性使它由红色变成无色;②是氯水的酸性(H+)使它由红色变成无色。假设其中一种是正确的。
请你设计一个实验,由实验现象对以上的推测作出判断。
(1)要使用的实验用品:_______________ ________________________________________________________________________________________________________________;
例1
(2)要进行的实验操作:____________ ________________________________________________________________________________________________________________;
(3)实验现象和结论:_______________ _______________________________________________________________________________________________________________。
【解析】 酚酞滴入碱液中呈红色,若①的推测正确,说明有色物质被次氯酸氧化,即酚酞已经变质,向其中加入NaOH溶液,溶液呈碱性,溶液不再变红色;若②的推测正确,向溶液中再加入NaOH溶液,溶液会呈红色。
【答案】 (1)NaOH溶液、pH试纸、玻璃棒
(2)向已褪色的溶液中滴加NaOH溶液至呈碱性
(3)滴加NaOH溶液后若溶液恢复红色说明推测②正确,若溶液仍为无色说明推测①正确
1.下列关于氯水的叙述,正确的是( )
A.新制氯水中只含有Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性增强
变式训练
解析:选BD。在新制的氯水中溶有大量Cl2分子,其中小部分Cl2与水发生反应生成盐酸和次氯酸,HCl完全电离成H+和Cl-,HClO部分电离产生H+、ClO-。所以氯水中含有H2O、Cl2、HClO分子和H+、Cl-、ClO-、OH-离子。HClO有强氧化性、漂白性,见光易分解放出O2。氯水放置数天后HClO分解接近完全,转化为盐酸,酸性增强。
1.反应原理
要点二
Cl2的实验室制取
主要仪器:铁架台、酒精灯、圆底烧瓶、分液漏斗、集气瓶、烧杯等。Cl2的制备、净化装置如图所示:
说明:C装置的作用是除去Cl2中的HCl,D装置的作用是干燥Cl2。F装置的作用是吸收多余的Cl2。
3.收集方法
(1)向上排空气法(Cl2密度大于空气)。
(2)排饱和食盐水法(Cl2在饱和NaCl溶液中的溶解度很小,且用此法可除去实验过程中挥发产生的HCl气体)。
4.尾气处理
Cl2有毒,易污染空气,需用NaOH溶液吸收。
气体的制备装置一般包括反应装置、除杂装置、收集装置、尾气处理装置等。反应装置的选择要依据反应物的状态和反应的条件。收集方法的选择应考虑气体密度、溶解性及在空气中的稳定性。是否处理尾气,要取决于该气体是否有毒。一个装置的选择实际上与气体的性质密切相关。
特别提醒
回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为_________________________________ _______________________________________________________________________________________________________________。
例2
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?____________,理由是__________ ______________________________________________________________。
(3)装置中能否省去盛浓硫酸的洗气瓶?_________________________________ ___________________________________,
理由是___________________________ _____________________________________________。
(4)装置中能否省去盛冰水的烧杯?______________,理由是____________。
【思路点拨】 解答本题要注意以下两点:
(1)分析实验原理,结合实验装置判断各种药品的作用。
(2)结合题中信息确定可能发生的副反应。
【答案】 (1)Cl2+2OH-===Cl-+ClO-+H2O
(2)否 氯气中混有的HCl气体进入大试管中也会和氢氧化钠溶液反应,降低了NaClO的产量和纯度
(3)能 少量水蒸气进入试管中不影响反应
(4)否 氯气和水的反应是放热反应,反应时温度升高,可能引起副反应,生成NaClO3
如制取NaClO3,需加热至70 ℃,而且要求温度较稳定,怎样才能实现?
【提示】 向烧杯内加入70 ℃的水,用温度计测量温度,用酒精灯进行间断性的水浴加热。
互动探究
2.在下图所示的装置中,A是Cl2发生装置,C、D为气体的净化装置,C中装有饱和食盐水,D中装有浓硫酸,E是硬质玻璃管(其中装有细铁丝网),F为干燥的广口瓶,烧杯G为尾气吸收装置。
变式训练
(1)A、B、G中各装有什么药品:
A________,B________,G________。
(2)分析A中生成的Cl2中可能含有哪些杂质气体?___________________________________ ____________________________________。
(3)为什么A中生成的气体一定要经过C、D两个装置?_______________________________ _______________________________________。
(4)反应时E中的现象为_______________,生成的物质是________(填化学式)。
(5)写出G和E中反应的化学方程式:_____ ___________________________________________________________________________________________________________________________________________。
解析:本题主要考查的是实验操作,应熟练地掌握实验室安全知识及注意事项。
由图可知,整套装置包括Cl2的发生、净化、与Fe粉的反应、收集和尾气吸收等几部分。由于浓盐酸易挥发,故生成的Cl2中必含有HCl和水蒸气等杂质,若不除去这些杂质,则会影响Cl2与Fe在高温下的反应,使生成物不纯。另外,FeCl3遇水极易水解变质,这一点将在以后学到。
答案:(1)MnO2 浓盐酸 NaOH溶液 (2)HCl和水蒸气 (3)除去HCl和水蒸气,否则会影响Cl2与Fe在高温下的反应,使生成物不纯 (4)有棕黄色烟 FeCl3
当堂达标训练
课时活页训练
