山东省临清市人教版化学选修4课件:第2章 第3节 第3课时 化学平衡常数及计算
文档属性
| 名称 | 山东省临清市人教版化学选修4课件:第2章 第3节 第3课时 化学平衡常数及计算 |
|
|
| 格式 | rar | ||
| 文件大小 | 86.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 00:00:00 | ||
图片预览









文档简介
(共28张PPT)
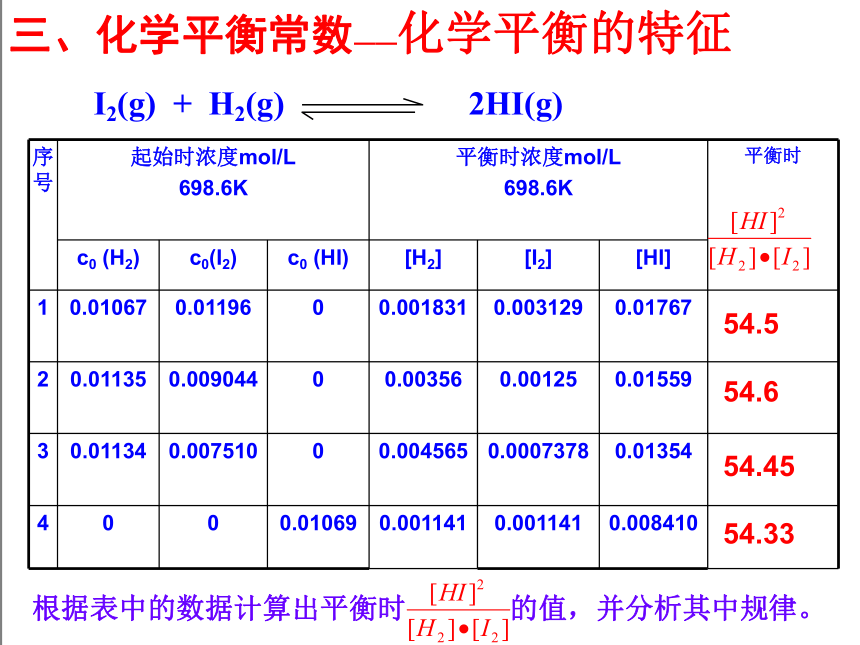
三、化学平衡常数——化学平衡的特征
序号 起始时浓度mol/L
698.6K 平衡时浓度mol/L
698.6K 平衡时
c0 (H2) c0(I2) c0 (HI) [H2] [I2] [HI]
1 0.01067 0.01196 0 0.001831 0.003129 0.01767
2 0.01135 0.009044 0 0.00356 0.00125 0.01559
3 0.01134 0.007510 0 0.004565 0.0007378 0.01354
4 0 0 0.01069 0.001141 0.001141 0.008410
I2(g) + H2(g) 2HI(g)
54.5
54.6
54.45
54.33
根据表中的数据计算出平衡时 的值,并分析其中规律。
通过分析实验数据得出:
1、温度不变时, 为常数 用K表示;
2、常数K与反应的起始浓度大小无关;
3、常数K与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。
其它平衡体系的数据进行分析,都有类似的关系。
对于反应: aA + bB cC + dD
一、定义:
一定温度下,对于已达平衡的反应体
系中,生成物以它的化学计量数为乘幂的
浓度之积除以反应物以它的化学计量数为
乘幂的浓度之积是个常数,这个常数叫做
该反应的化学平衡常数
三、平衡常数的单位
浓度的单位为mol·L-1
∴K的单位为(mol·L-1) n;
二、数学表达式:
对于一般的可逆反应mA+nB pC+qD
{c(C)}p{c(D)}q
{c(A)} m{c(B)} n
K =
练习:试写出下列反应的浓度平衡常数的数学表达式:
2SO2(g)+O2(g) 2SO3
C(s)+H2O(g) CO(g)+H2(g)
催化剂
注意:
反应中的固体或纯溶剂不列入平衡常数的表达式中!
1、如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。如:
CaCO3(s) CaO(s)+CO2(g)
Kc=[CO2]
CO2(g)+H2(g) CO(g)+H2O(l)
Kc=[CO]/([CO2][H2])
四、书写平衡常数关系式的规则
稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中,如:
Cr2O72-+H2O 2CrO42-+2H+
Kc=[CrO42-]2[H+]2/[Cr2O72-]
非水溶液中的反应,如有水生成或有水参加反应,此时水的浓度不可视为常数,必须表示在平衡关系式中。如酒精和醋酸的液相反应
C2H5OH+CH3COOH CH3COOC2H5+H2O
K=[CH3COOC2H5][H2O]/([C2H5OH][CH3COOH])
2、同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
例:N2O4(g) 2NO2(g)
Kc = [NO2]2/[N2O4]
1/2N2O4(g) NO2(g)
Kc = [NO2]/[N2O4]1/2
1/3N2O4(g) 2/3NO2(g)
Kc = [NO2]2/3/[N2O4]1/3
3、多重平衡规则
若干方程式相加(减),则总反应的平衡
常数等于分步平衡常数之乘积(商)
例1: 2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) +O2(g) N2O4 (g) K = K1 K2
例2:
C (s) + CO2(g) 2CO(g) K
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
K = K1/K2
返 回
播 放
解(1) Kc=[N2O4]/[NO2]2
(2) Kc=[NO2]2/[N2O4]
(3) Kc= [CO2]
课堂 练习:
1.写出下列各反应的平衡常数K
(1) 2NO2(g) N2O4(g)
(2) N2O4(g) 2NO2(g)
(3) CaCO3(g) CaO(s)+CO2(g)
4、平衡常数只表现反应进行的程度,即可能性问题,而不表现到达平衡所需的时间,即现实性问题.
5、平衡常数K与温度有关,与浓度无关,由K随温度的变化可推断正反应是吸热反应还是放热。 若正反应是吸热反应,升高温度,K 增大;若正反应是放热反应,升高温度,K 减少;
(5) K值大小标志反应能达到的最大限度,
K值大,反应完全。
返 回
播 放
http://www./upload/2003/7/12/20037121424166069.swf
http://www./flash/moreopen.asp id=3117
5. 小结:
(1) 平衡是有条件的、动态的。
(2) K不随起始浓度大而变。
(3) K与温度有关。
(4) K与方程式写法有关。
1.平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。因为平衡状态是反应进行的最大限度。如: N2(g)+O2(g) 2NO(g)
Kc=1×10-30(298K)
这意味着298K时,N2和O2基本上没有进行反应,反之NO分解的逆反应在该温度下将几乎完全进行,平衡时NO实际上全部分解为N2和O2。
三、平衡常数的意义
2、平衡常数K值的大小,可推断反应进行的程度。
K值越大,表示反应进行的程度越大,反应物的转化率越大;K值越小,表示反应进行的程度越小,反应物的转化率越小。
3、反应的平衡常数与反应可能进行的程度。一般来说,反应的平衡常数KC≥105,认为正反应进行得较完全;KC ≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。
例如:不同温度时,反应:H2(g)+I2(g) 2HI(g),的平衡常数与温度的关系如下:
△
温度 623K 698K 763K
浓度平衡常数 66 .9 54.4 45.9
通过改变温度,平衡常数大小的变化趋势可以判断
上面可逆反应的正方向是放热反应.
4、另外还有两点必须指出:
①平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:
2SO2(g)+O2===2SO3(g)
298K时Kp很大,但由于速度太慢,常温时,几乎不发生反应。
②平衡常数数值极小的反应,说明正反应在该条件下不可能进行,如:
N2+O2 2NO
Kc=10-30(298K)所以常温下用此反应固定氮气是不可能的。因此没有必要在该条件下进行实验,以免浪费人力物力。或者改变条件使反应在新的条件下进行比较好一些。
对于可逆反应达到平衡后各物质的浓度变化关系,在计算中注意:
(2)生成物:平衡浓度=初始浓度+转化浓度
生成物D: [D] = c0(D) +△c(D)
(3)各物质的转化浓度之比等于它们在化学方程式中相应的化学计量数之比。△c(A):△c(D)=a:d
(1)反应物:平衡浓度=初始浓度-转化浓度;
反应物A: [A]=c0(A) - △c(A)
5、与平衡常数有关的计算
例1:合成氨的反应N2+3H2 2NH3在某温度下各物质的浓度平衡是:[N2]=3mol·L-1,[H2]=9mol·L-1,[NH3] =4mol·L-1求该反应的平衡常数和N2、H2的初始浓度。
解:①求平衡常数Kc
Kc=[NH3]2/([N2][H2]3)=16/(3×93)=7.32×10-3
②求N2、H2的初始浓度。
N2+3H2 2NH3
反应1摩尔N2同时需3molH2生成2molNH3
N2 + 3H2 2NH3 平衡3mol·L-1 9mol·L-1 4mol·L-1
初始(3+2) (9+6) 0
即: 5 15 0
答:Kc=7.32×10-3,初始[N2]、[H2]为5.15mol·L-1。
播 放
返 回
课堂 练习:
2、 450K时往一空容器中通入氮N2和H2,反应达平衡后,测得[N2]=3mol/L,[H2]=9mol/L,[NH3] =4 mol/L, 求K、N2和H2的起始浓度
3 9 4
0
4
2 6
5 15
∴Kc= [NH3]2/[N2] [H2]3 = 42/(3×93) =7.3×10-3
解: N2 + 3H2 2NH3
起始浓度/mol/L
反应浓度/mol/L
平衡浓度/mol/L
四、平衡转化率
用平衡常数来表示反应的限度有时不够直观,常用平衡转化率α来表示反应限度。
对于可逆反应: mA(g)+nB (g) pC(g)+qD(g)
反应物A的平衡转化率(该条件最大转化率)可表示:
(a)已知初始浓度和平衡浓度求平衡常数和平衡转化率
例1:对于反应2SO2(g)+ O2(g) 2SO3(g) ,若在一定温度下,将0.1mol的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,当达到平衡状态时,测得容器中有0.088mol的SO3(g)试求在该温度下
(1)此反应的平衡常数。
(2)求SO2(g)和O2(g)的平衡转化率。
注:温度一定时,对于一个化学反应,平衡常数虽然一定,但不同的反应物的平衡转化率可能不同。不能脱离具体的反应物谈平衡转化率。
(b)已知平衡转化率和初始浓度求平衡常数
例2:反应SO2(g)+ NO2(g) SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为60%,试求:在该温度下。
(1)此反应的浓度平衡常数。
(2)若SO2(g) 的初始浓度均增大到3mol/L,则SO2转化率变为多少?
(c)知平衡常数和初始浓度求平衡浓度及转化率。
例3、在1200℃时测得下列反应达平衡时,k=2.25. CO2(g)+H2(g) CO(g)+H2O(g) 。若反应从CO2(g)和H2(g)开始,且CO2(g)和H2(g)的初始浓度分别为A、B、C三种情况。试计算A情况下各物质的平衡浓度及CO2(g)和H2(g)平衡转化率。
初始浓度 A B C
Co(H2)mol/L 0.0100 0.0120 0.0080
Co(CO2)mol/L 0.0100 0.0100 0.0100
将根据B、C组数据计算各物质的平衡浓度和平衡转化率(α),分析结果,得出什么结论?
播 放
返 回
K = [CO2][H2] / [CO][H2O]
=[(2.0α)(2.0α)] / [2.0(1-α)×2.0(1-α)]
=α2 / (1-α)2 = 2.6
∴α= 62 %
解:设CO的转化率为α,则
CO(g) + H2O (g) CO2 (g) + H2 (g)
起始浓度/ mol/L 2.0 2.0 0 0
变化浓度/ mol/L (-2.0α) ( -2.0α) ( 2.0α) ( 2.0α)
平衡浓度/ mol/L 2.0(1-α) 2.0(1-α) 2.0α 2.0α
例题、
反应CO (g) + H2O (g) CO2 (g) + H2 (g)在749K达平衡,Kc=2.60,求:当CO、H2O (g)的起始浓度都为 2.0 mol/L达平衡后,CO的转化率 。
练习1、在密闭容器中,将NO2加热到某温度时,可进行如下反应:2NO2 2NO+O2,在平衡时各物质的浓度分别是:[NO2]=0.06mol/L,[NO]=0.24mol/L,
[O2]=0.12mol/L.试求:
(1)该温度下反应的平衡常数。
(2)开始时NO2的浓度。
(3) NO2的转化率。
练习2:在2L的容器中充入 1mol CO和 1mol H2O(g),发生反应:CO(g)+H2O(g) CO2(g)+H2(g) 800℃时反应达平衡,若k=1.求:
(1)CO的平衡浓度和转化率。
(2)若温度不变,上容器中充入 的是1mol CO和 2mol H2O(g), CO和H2O(g),的平衡浓度和转化率是多少。
(3)若温度不变,上容器中充入 的是1mol CO和 4mol H2O(g), CO和H2O(g),的平衡浓度和转化率是多少。
(4)若温度不变,要使CO的转化率达到90%,在题干的条件下还要充入 H2O(g) 物质的量为多少。
三、化学平衡常数——化学平衡的特征
序号 起始时浓度mol/L
698.6K 平衡时浓度mol/L
698.6K 平衡时
c0 (H2) c0(I2) c0 (HI) [H2] [I2] [HI]
1 0.01067 0.01196 0 0.001831 0.003129 0.01767
2 0.01135 0.009044 0 0.00356 0.00125 0.01559
3 0.01134 0.007510 0 0.004565 0.0007378 0.01354
4 0 0 0.01069 0.001141 0.001141 0.008410
I2(g) + H2(g) 2HI(g)
54.5
54.6
54.45
54.33
根据表中的数据计算出平衡时 的值,并分析其中规律。
通过分析实验数据得出:
1、温度不变时, 为常数 用K表示;
2、常数K与反应的起始浓度大小无关;
3、常数K与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。
其它平衡体系的数据进行分析,都有类似的关系。
对于反应: aA + bB cC + dD
一、定义:
一定温度下,对于已达平衡的反应体
系中,生成物以它的化学计量数为乘幂的
浓度之积除以反应物以它的化学计量数为
乘幂的浓度之积是个常数,这个常数叫做
该反应的化学平衡常数
三、平衡常数的单位
浓度的单位为mol·L-1
∴K的单位为(mol·L-1) n;
二、数学表达式:
对于一般的可逆反应mA+nB pC+qD
{c(C)}p{c(D)}q
{c(A)} m{c(B)} n
K =
练习:试写出下列反应的浓度平衡常数的数学表达式:
2SO2(g)+O2(g) 2SO3
C(s)+H2O(g) CO(g)+H2(g)
催化剂
注意:
反应中的固体或纯溶剂不列入平衡常数的表达式中!
1、如果反应中有固体和纯液体参加,它们的浓度不应写在平衡关系式中,因为它们的浓度是固定不变的,化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。如:
CaCO3(s) CaO(s)+CO2(g)
Kc=[CO2]
CO2(g)+H2(g) CO(g)+H2O(l)
Kc=[CO]/([CO2][H2])
四、书写平衡常数关系式的规则
稀溶液中进行的反应,如有水参加,水的浓度也不必写在平衡关系式中,如:
Cr2O72-+H2O 2CrO42-+2H+
Kc=[CrO42-]2[H+]2/[Cr2O72-]
非水溶液中的反应,如有水生成或有水参加反应,此时水的浓度不可视为常数,必须表示在平衡关系式中。如酒精和醋酸的液相反应
C2H5OH+CH3COOH CH3COOC2H5+H2O
K=[CH3COOC2H5][H2O]/([C2H5OH][CH3COOH])
2、同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。
例:N2O4(g) 2NO2(g)
Kc = [NO2]2/[N2O4]
1/2N2O4(g) NO2(g)
Kc = [NO2]/[N2O4]1/2
1/3N2O4(g) 2/3NO2(g)
Kc = [NO2]2/3/[N2O4]1/3
3、多重平衡规则
若干方程式相加(减),则总反应的平衡
常数等于分步平衡常数之乘积(商)
例1: 2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) +O2(g) N2O4 (g) K = K1 K2
例2:
C (s) + CO2(g) 2CO(g) K
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
K = K1/K2
返 回
播 放
解(1) Kc=[N2O4]/[NO2]2
(2) Kc=[NO2]2/[N2O4]
(3) Kc= [CO2]
课堂 练习:
1.写出下列各反应的平衡常数K
(1) 2NO2(g) N2O4(g)
(2) N2O4(g) 2NO2(g)
(3) CaCO3(g) CaO(s)+CO2(g)
4、平衡常数只表现反应进行的程度,即可能性问题,而不表现到达平衡所需的时间,即现实性问题.
5、平衡常数K与温度有关,与浓度无关,由K随温度的变化可推断正反应是吸热反应还是放热。 若正反应是吸热反应,升高温度,K 增大;若正反应是放热反应,升高温度,K 减少;
(5) K值大小标志反应能达到的最大限度,
K值大,反应完全。
返 回
播 放
http://www./upload/2003/7/12/20037121424166069.swf
http://www./flash/moreopen.asp id=3117
5. 小结:
(1) 平衡是有条件的、动态的。
(2) K不随起始浓度大而变。
(3) K与温度有关。
(4) K与方程式写法有关。
1.平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。因为平衡状态是反应进行的最大限度。如: N2(g)+O2(g) 2NO(g)
Kc=1×10-30(298K)
这意味着298K时,N2和O2基本上没有进行反应,反之NO分解的逆反应在该温度下将几乎完全进行,平衡时NO实际上全部分解为N2和O2。
三、平衡常数的意义
2、平衡常数K值的大小,可推断反应进行的程度。
K值越大,表示反应进行的程度越大,反应物的转化率越大;K值越小,表示反应进行的程度越小,反应物的转化率越小。
3、反应的平衡常数与反应可能进行的程度。一般来说,反应的平衡常数KC≥105,认为正反应进行得较完全;KC ≤10-5则认为这个反应的正反应很难进行(逆反应较完全)。
例如:不同温度时,反应:H2(g)+I2(g) 2HI(g),的平衡常数与温度的关系如下:
△
温度 623K 698K 763K
浓度平衡常数 66 .9 54.4 45.9
通过改变温度,平衡常数大小的变化趋势可以判断
上面可逆反应的正方向是放热反应.
4、另外还有两点必须指出:
①平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:
2SO2(g)+O2===2SO3(g)
298K时Kp很大,但由于速度太慢,常温时,几乎不发生反应。
②平衡常数数值极小的反应,说明正反应在该条件下不可能进行,如:
N2+O2 2NO
Kc=10-30(298K)所以常温下用此反应固定氮气是不可能的。因此没有必要在该条件下进行实验,以免浪费人力物力。或者改变条件使反应在新的条件下进行比较好一些。
对于可逆反应达到平衡后各物质的浓度变化关系,在计算中注意:
(2)生成物:平衡浓度=初始浓度+转化浓度
生成物D: [D] = c0(D) +△c(D)
(3)各物质的转化浓度之比等于它们在化学方程式中相应的化学计量数之比。△c(A):△c(D)=a:d
(1)反应物:平衡浓度=初始浓度-转化浓度;
反应物A: [A]=c0(A) - △c(A)
5、与平衡常数有关的计算
例1:合成氨的反应N2+3H2 2NH3在某温度下各物质的浓度平衡是:[N2]=3mol·L-1,[H2]=9mol·L-1,[NH3] =4mol·L-1求该反应的平衡常数和N2、H2的初始浓度。
解:①求平衡常数Kc
Kc=[NH3]2/([N2][H2]3)=16/(3×93)=7.32×10-3
②求N2、H2的初始浓度。
N2+3H2 2NH3
反应1摩尔N2同时需3molH2生成2molNH3
N2 + 3H2 2NH3 平衡3mol·L-1 9mol·L-1 4mol·L-1
初始(3+2) (9+6) 0
即: 5 15 0
答:Kc=7.32×10-3,初始[N2]、[H2]为5.15mol·L-1。
播 放
返 回
课堂 练习:
2、 450K时往一空容器中通入氮N2和H2,反应达平衡后,测得[N2]=3mol/L,[H2]=9mol/L,[NH3] =4 mol/L, 求K、N2和H2的起始浓度
3 9 4
0
4
2 6
5 15
∴Kc= [NH3]2/[N2] [H2]3 = 42/(3×93) =7.3×10-3
解: N2 + 3H2 2NH3
起始浓度/mol/L
反应浓度/mol/L
平衡浓度/mol/L
四、平衡转化率
用平衡常数来表示反应的限度有时不够直观,常用平衡转化率α来表示反应限度。
对于可逆反应: mA(g)+nB (g) pC(g)+qD(g)
反应物A的平衡转化率(该条件最大转化率)可表示:
(a)已知初始浓度和平衡浓度求平衡常数和平衡转化率
例1:对于反应2SO2(g)+ O2(g) 2SO3(g) ,若在一定温度下,将0.1mol的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,当达到平衡状态时,测得容器中有0.088mol的SO3(g)试求在该温度下
(1)此反应的平衡常数。
(2)求SO2(g)和O2(g)的平衡转化率。
注:温度一定时,对于一个化学反应,平衡常数虽然一定,但不同的反应物的平衡转化率可能不同。不能脱离具体的反应物谈平衡转化率。
(b)已知平衡转化率和初始浓度求平衡常数
例2:反应SO2(g)+ NO2(g) SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为60%,试求:在该温度下。
(1)此反应的浓度平衡常数。
(2)若SO2(g) 的初始浓度均增大到3mol/L,则SO2转化率变为多少?
(c)知平衡常数和初始浓度求平衡浓度及转化率。
例3、在1200℃时测得下列反应达平衡时,k=2.25. CO2(g)+H2(g) CO(g)+H2O(g) 。若反应从CO2(g)和H2(g)开始,且CO2(g)和H2(g)的初始浓度分别为A、B、C三种情况。试计算A情况下各物质的平衡浓度及CO2(g)和H2(g)平衡转化率。
初始浓度 A B C
Co(H2)mol/L 0.0100 0.0120 0.0080
Co(CO2)mol/L 0.0100 0.0100 0.0100
将根据B、C组数据计算各物质的平衡浓度和平衡转化率(α),分析结果,得出什么结论?
播 放
返 回
K = [CO2][H2] / [CO][H2O]
=[(2.0α)(2.0α)] / [2.0(1-α)×2.0(1-α)]
=α2 / (1-α)2 = 2.6
∴α= 62 %
解:设CO的转化率为α,则
CO(g) + H2O (g) CO2 (g) + H2 (g)
起始浓度/ mol/L 2.0 2.0 0 0
变化浓度/ mol/L (-2.0α) ( -2.0α) ( 2.0α) ( 2.0α)
平衡浓度/ mol/L 2.0(1-α) 2.0(1-α) 2.0α 2.0α
例题、
反应CO (g) + H2O (g) CO2 (g) + H2 (g)在749K达平衡,Kc=2.60,求:当CO、H2O (g)的起始浓度都为 2.0 mol/L达平衡后,CO的转化率 。
练习1、在密闭容器中,将NO2加热到某温度时,可进行如下反应:2NO2 2NO+O2,在平衡时各物质的浓度分别是:[NO2]=0.06mol/L,[NO]=0.24mol/L,
[O2]=0.12mol/L.试求:
(1)该温度下反应的平衡常数。
(2)开始时NO2的浓度。
(3) NO2的转化率。
练习2:在2L的容器中充入 1mol CO和 1mol H2O(g),发生反应:CO(g)+H2O(g) CO2(g)+H2(g) 800℃时反应达平衡,若k=1.求:
(1)CO的平衡浓度和转化率。
(2)若温度不变,上容器中充入 的是1mol CO和 2mol H2O(g), CO和H2O(g),的平衡浓度和转化率是多少。
(3)若温度不变,上容器中充入 的是1mol CO和 4mol H2O(g), CO和H2O(g),的平衡浓度和转化率是多少。
(4)若温度不变,要使CO的转化率达到90%,在题干的条件下还要充入 H2O(g) 物质的量为多少。
