山东省临清市人教版化学选修4课件:第3章 第1节 弱电解质的电离
文档属性
| 名称 | 山东省临清市人教版化学选修4课件:第3章 第1节 弱电解质的电离 |

|
|
| 格式 | rar | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
选修四 第三章 第一节
临清一中 王者齐
知识回顾:
电解质:
非电解质:
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态时都不能导电的化合物。
①NaCl溶液 ②NaOH ③HCl
④Cu ⑤CH3COOH ⑥NH3·H2O
⑦CO2 ⑧乙醇 ⑨水
②③⑤⑥⑨
⑦⑧
化合物
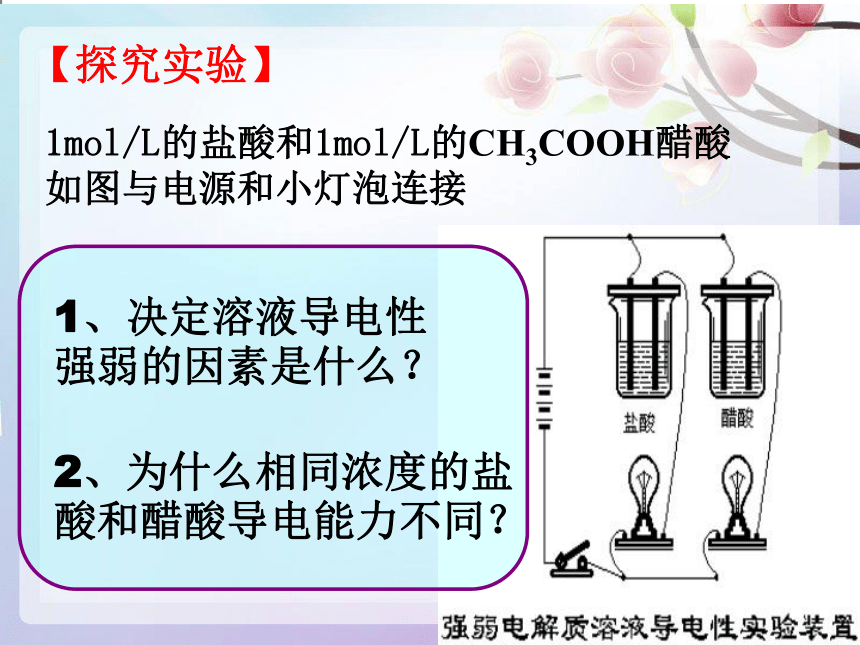
【探究实验】
1mol/L的盐酸和1mol/L的CH3COOH醋酸
如图与电源和小灯泡连接
1、决定溶液导电性
强弱的因素是什么?
2、为什么相同浓度的盐
酸和醋酸导电能力不同?
电解质的电离
HCl电离
醋酸电离
部分电离成离子的电解质(其离子有分子化倾向)包括弱酸(如HAc、H2S)、弱碱(如NH3·H2O)、水。
强电解质:
能全部电离成离子的电解质(其离子无 分子化倾向)。包括大多数盐类、强酸、强碱。
弱电解质:
一、强电解质和弱电解质
根据:是否完全电离
强电解质 弱电解质
相同点
不同点 电离程度
电离过程是否可逆
表示方法
溶液中有哪些微粒
都是 ,在水溶液中均发生 。
电离
电离
不可逆
可逆
水合离子
分子和水合离子
练一练
HCl
NH3·H2O
Fe(OH)3
H2CO3
写出下列物质在水溶液中的电离方程式。
H+ +Cl-
NH4++OH—
H++HCO3—
Fe3++3OH—
HCO3—
H++CO32—
选修四 第三章 第一节
临清一中 高海嫣
二、弱电解质的电离
CH3COOH CH3COO - + H+
离子化
分子化
你能画出这个过程的V~t图吗?
V离子化= V分子化
平衡状态
V分子化
t1
0
t
V
弱电解质电离的V-t图
V离子化
CH3COOH CH3COO - + H+
离子化
分子化
电离平衡状态
在一定条件下,当电解质分子离解成离子的速率和离子结合成分子的速率相等时,电离过程就达到了平衡状态,这种状态叫做电离平衡状态。
由于醋酸溶液中醋酸根离子浓度的增大,使得醋酸的电离平衡逆向移动。
醋酸中加入醋酸铵,醋酸的电离平衡会移动吗?
CH3COOH CH3COO - + H+
离子化
分子化
弱电解质的电离平衡符合 原理
在CH3COOH溶液中分别加入下列物质,对CH3COOH的电离平衡各有什么影响?
CH3COOH CH3COO—+H+
加入物质或方法 盐酸 NaOH固体 加热 CH3COONa 大量水
电离平衡移动方向
逆
逆
正
正
正
总结:影响弱电解质电离的因素
温度
升高温度有利于电离
(因为电离过程是 的)
浓度
稀释有利于电离
加入与弱电解质具有相同离子的
强电解质会 电离
加入能与弱电解质电离产生的某种
离子反应的物质可 电离
NH3·H2O NH4 + + OH -
加入
物质 盐酸 NaOH 溶液 NH4Cl
溶液 加大量水
平衡移动方向
正
逆
逆
正
练习
1 .在氨水中存在怎样的电离平衡?向其中分别加入适量的盐酸、NaOH溶液、NH4Cl溶液以及大量的水,对平衡有什么影响?
问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
四、电离平衡常数(K)
看课本自学相关内容并思考:
(1)什么叫电离平衡常数?
(2)电离平衡常数的化学含义是什么?
(3)怎样用电离平衡常数比较弱电解质的相对强弱?
(4)影响电离平衡常数的因素是什么?
弱电解质电离程度相对大小的参数一
电离平衡常数(K)
意义:K值越大,电离程度越 ,
相应酸 (或碱)的酸(或碱)性越 。
K值只随 变化。
对于多元酸:
多元弱酸是分步电离的,K1》K2(一般要相差105)。
多元弱酸的酸性由第一步电离决定。
试根据课本中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
草酸>磷酸>柠檬酸>碳酸
小结
[达标检测]
请看学案
教材P43习题
作业:
选修四 第三章 第一节
临清一中 王者齐
知识回顾:
电解质:
非电解质:
在水溶液中或熔融状态时能够导电的化合物。
在水溶液中和熔融状态时都不能导电的化合物。
①NaCl溶液 ②NaOH ③HCl
④Cu ⑤CH3COOH ⑥NH3·H2O
⑦CO2 ⑧乙醇 ⑨水
②③⑤⑥⑨
⑦⑧
化合物
【探究实验】
1mol/L的盐酸和1mol/L的CH3COOH醋酸
如图与电源和小灯泡连接
1、决定溶液导电性
强弱的因素是什么?
2、为什么相同浓度的盐
酸和醋酸导电能力不同?
电解质的电离
HCl电离
醋酸电离
部分电离成离子的电解质(其离子有分子化倾向)包括弱酸(如HAc、H2S)、弱碱(如NH3·H2O)、水。
强电解质:
能全部电离成离子的电解质(其离子无 分子化倾向)。包括大多数盐类、强酸、强碱。
弱电解质:
一、强电解质和弱电解质
根据:是否完全电离
强电解质 弱电解质
相同点
不同点 电离程度
电离过程是否可逆
表示方法
溶液中有哪些微粒
都是 ,在水溶液中均发生 。
电离
电离
不可逆
可逆
水合离子
分子和水合离子
练一练
HCl
NH3·H2O
Fe(OH)3
H2CO3
写出下列物质在水溶液中的电离方程式。
H+ +Cl-
NH4++OH—
H++HCO3—
Fe3++3OH—
HCO3—
H++CO32—
选修四 第三章 第一节
临清一中 高海嫣
二、弱电解质的电离
CH3COOH CH3COO - + H+
离子化
分子化
你能画出这个过程的V~t图吗?
V离子化= V分子化
平衡状态
V分子化
t1
0
t
V
弱电解质电离的V-t图
V离子化
CH3COOH CH3COO - + H+
离子化
分子化
电离平衡状态
在一定条件下,当电解质分子离解成离子的速率和离子结合成分子的速率相等时,电离过程就达到了平衡状态,这种状态叫做电离平衡状态。
由于醋酸溶液中醋酸根离子浓度的增大,使得醋酸的电离平衡逆向移动。
醋酸中加入醋酸铵,醋酸的电离平衡会移动吗?
CH3COOH CH3COO - + H+
离子化
分子化
弱电解质的电离平衡符合 原理
在CH3COOH溶液中分别加入下列物质,对CH3COOH的电离平衡各有什么影响?
CH3COOH CH3COO—+H+
加入物质或方法 盐酸 NaOH固体 加热 CH3COONa 大量水
电离平衡移动方向
逆
逆
正
正
正
总结:影响弱电解质电离的因素
温度
升高温度有利于电离
(因为电离过程是 的)
浓度
稀释有利于电离
加入与弱电解质具有相同离子的
强电解质会 电离
加入能与弱电解质电离产生的某种
离子反应的物质可 电离
NH3·H2O NH4 + + OH -
加入
物质 盐酸 NaOH 溶液 NH4Cl
溶液 加大量水
平衡移动方向
正
逆
逆
正
练习
1 .在氨水中存在怎样的电离平衡?向其中分别加入适量的盐酸、NaOH溶液、NH4Cl溶液以及大量的水,对平衡有什么影响?
问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
四、电离平衡常数(K)
看课本自学相关内容并思考:
(1)什么叫电离平衡常数?
(2)电离平衡常数的化学含义是什么?
(3)怎样用电离平衡常数比较弱电解质的相对强弱?
(4)影响电离平衡常数的因素是什么?
弱电解质电离程度相对大小的参数一
电离平衡常数(K)
意义:K值越大,电离程度越 ,
相应酸 (或碱)的酸(或碱)性越 。
K值只随 变化。
对于多元酸:
多元弱酸是分步电离的,K1》K2(一般要相差105)。
多元弱酸的酸性由第一步电离决定。
试根据课本中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
草酸>磷酸>柠檬酸>碳酸
小结
[达标检测]
请看学案
教材P43习题
作业:
