山东省临清市人教版化学选修4课件:第3章 第2节 水的电离和溶液的酸碱性(1)
文档属性
| 名称 | 山东省临清市人教版化学选修4课件:第3章 第2节 水的电离和溶液的酸碱性(1) |
|
|
| 格式 | rar | ||
| 文件大小 | 222.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 00:00:00 | ||
图片预览




文档简介
(共16张PPT)
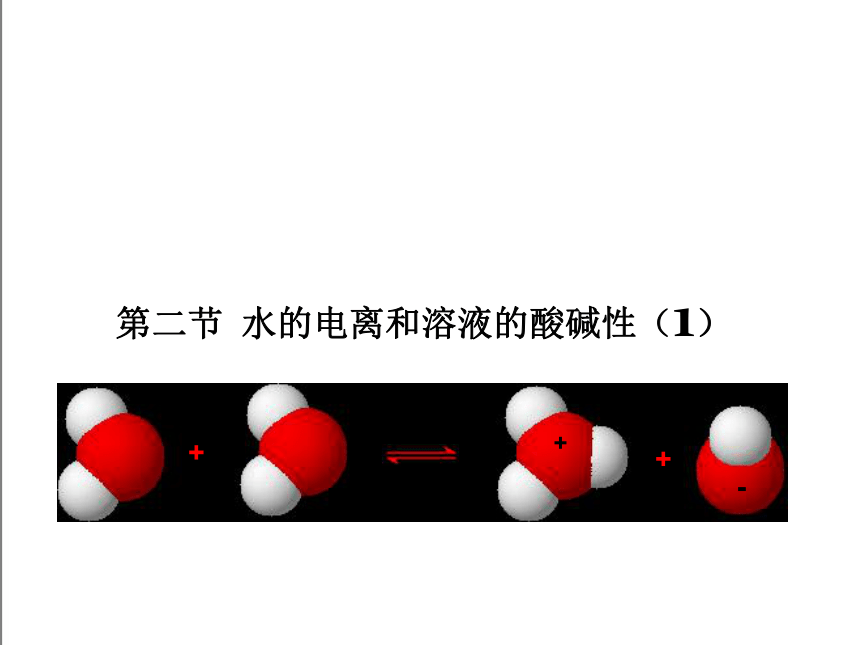
第二节 水的电离和溶液的酸碱性(1)
+
+
+
-
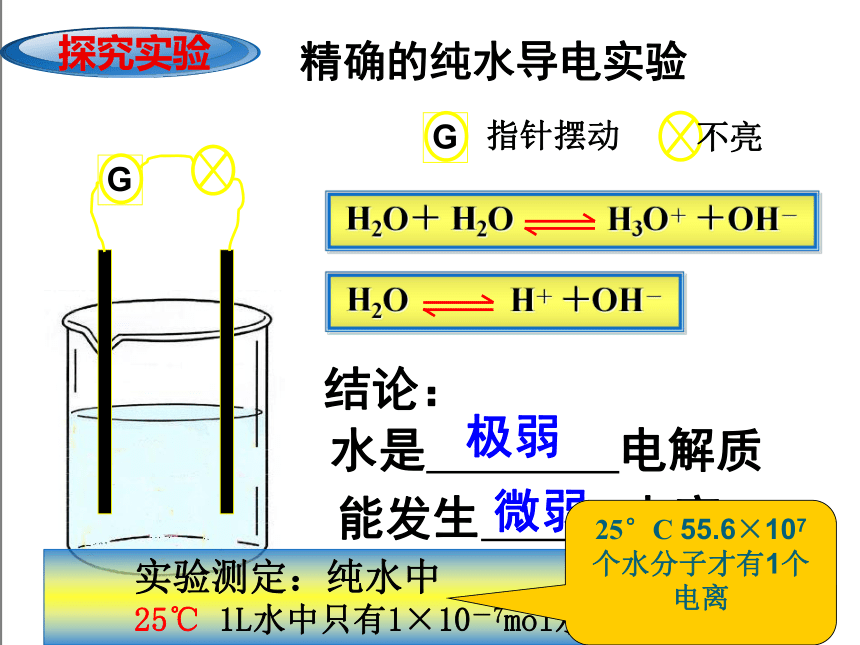
探究实验
精确的纯水导电实验
G
G
现象:
指针摆动
不亮
H2O+ H2O H3O+ +OH-
H2O H+ +OH-
灵敏电流计
灯泡
结论:
水是 电解质
能发生 电离
极弱
微弱
实验测定:纯水中
25℃ 1L水中只有1×10-7mol水发生了电离
25°C 55.6×107个水分子才有1个电离
一、水的电离:
H2O+ H2O H3O + +OH-
简写为:H2O H+ +OH-
1、水的电离:
△H>0
K电离 =
c(H+) · c(OH-)
c(H2O)
c(H+) · c(OH-)
c(H2O) ·
K电离 =
为常数
2.水的离子积: kw =
(25℃时,Kw=1×10-14)
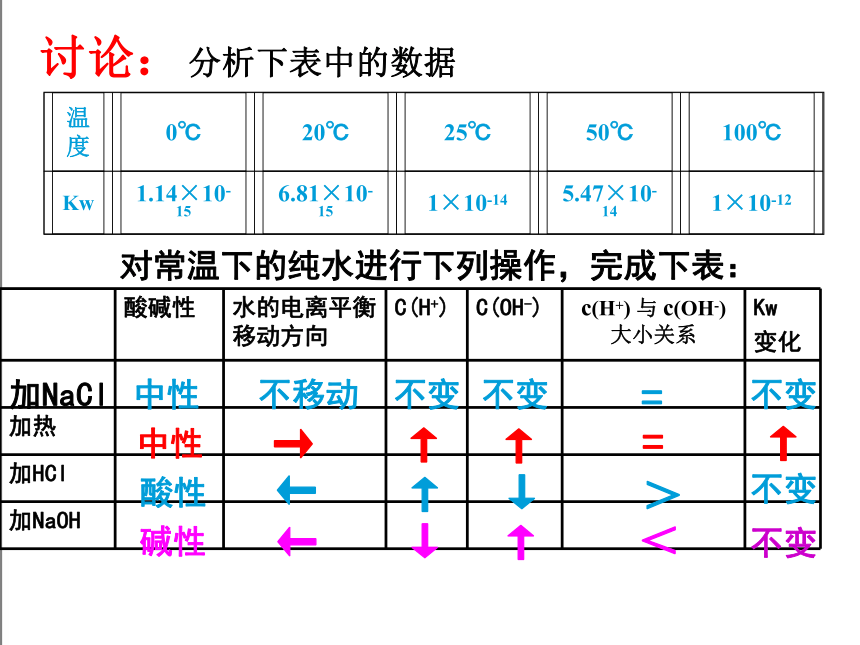
对常温下的纯水进行下列操作,完成下表:
酸碱性 水的电离平衡移动方向 C(H+) C(OH-) c(H+) 与 c(OH-)
大小关系 Kw
变化
加热
加HCl
加NaOH
中性
→
↑
↑
=
↑
酸性
←
↑
↓
>
不变
碱性
←
↓
↑
<
不变
中性
不移动
不变
不变
=
不变
加NaCl
讨论:
分析下表中的数据
温度
0℃
20℃
25℃
50℃
100℃
Kw
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
1×10-12
讨论:
根据前面所学知识,水的电离会受什么外界条件影响?
水的离子积又如何改变?
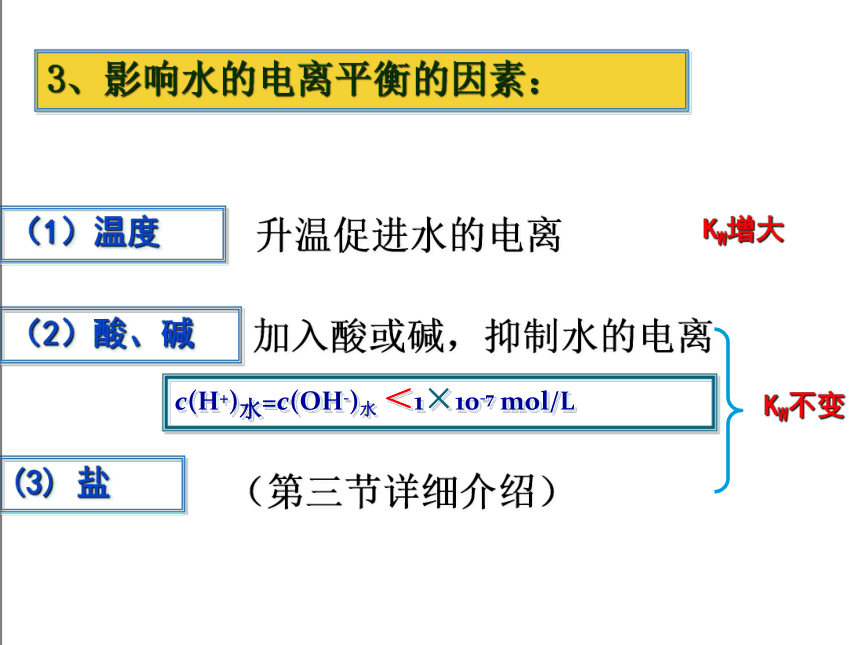
3、影响水的电离平衡的因素:
(2)酸、碱
(1)温度
(3) 盐
升温促进水的电离
加入酸或碱,抑制水的电离
(第三节详细介绍)
KW不变
KW增大
c(H+)水=c(OH-)水 <1×10-7 mol/L
常温下(25℃),任何稀的水溶液中总满足:
Kw= C(H+)×C(OH-)=1×10-14
注意:
②任何水溶液中(不论是在中性溶液还是在酸、碱性溶液),H+和OH-总是同时存在。
① Kw只与温度有关,而与浓度大小无关。
如:KW25℃=10-14 KW100℃=10-12
③任何水溶液中,水电离出的 C(H+)水=C(OH-)水
巩固练习
1、常温下,浓度为1×10-5 mol/L的盐酸溶液中,由水电离产生的c(H+)是多少?
1×10-9 mol/L
2、常温下,浓度为1×10-5 mol/L的NaOH溶液中,由水电离产生的c(OH-)是多少?
1×10-9 mol/L
思考题:在常温下,由水电离产生的C(H+)=1×10-9 mol/L的溶液,则该溶液的酸碱性如何?
可能是酸性也可能是碱性
√
√
√
×
×
---正误判断
6、如果C H+不等于COH-则溶液一定呈现酸碱性。
5、在水中加酸会抑制水的电离。
1、任何水溶液中都有CH+和COH-。
2、对水升高温度, CH+增大,酸性增强。
练习:
3、在水中加入稀盐酸或NaOH后,水的离子积发生改变
4、在酸碱溶液中,水电离出来的C H+和COH-相等
√
×
7.有含H+的水溶液一定是酸;含OH-的水溶液一定是碱.
酸性溶液中只含H+;碱性溶液中只含OH-.
二、溶液酸碱性与pH
1、溶液酸碱性的表示法
(1)c(H+) 和 c(OH-)
(2)c(H+) 和 c(OH-)都较小的稀溶液(<1mol/L)
用pH表示。
pH = - lgc(H+)
例:c(H+) = 1×10-7mol/L
pH = - lg10-7 = 7
2、c(H+) 和 c(OH-)与溶液酸碱性、 pH的关系
溶液的酸碱性 c(H+)和c(OH-)的关系 pH
酸性
中性
碱性
常温下
c(H+) > c(OH-)
c(H+) = c(OH-)
c(H+) < c(OH-)
>7
= 7
<7
pH=7的溶液一定是中性溶液吗?
答:不一定,只有在常温下才显中性。
注意: [H+]与[OH—]的关系才是判断溶液酸碱性的依据.
3、pH的测定方法
测定方法: pH试纸 pH计
用法:用玻璃棒蘸溶液,点在pH试纸中央,半分钟后与比色卡比色
讨论: pH试纸的使用
能否直接把pH试纸伸到待测液中?
是否要先湿润pH试纸后,再将待测液滴到pH试纸上?
如用湿润的pH试纸检验待测液,对该溶液pH值的测定:
A、一定有影响 B、偏大 C、偏小 D、不确定
能否用广泛pH试纸测出pH=7.1来?
标准比色卡中的数据都是整数
√
注意:
①不能用水润湿
②要放在玻璃片(或表面皿)上
③不是将试纸伸到溶液中
④广泛pH试纸只能读出整数
方法二:用pH计测定
第二节 水的电离和溶液的酸碱性(1)
+
+
+
-
探究实验
精确的纯水导电实验
G
G
现象:
指针摆动
不亮
H2O+ H2O H3O+ +OH-
H2O H+ +OH-
灵敏电流计
灯泡
结论:
水是 电解质
能发生 电离
极弱
微弱
实验测定:纯水中
25℃ 1L水中只有1×10-7mol水发生了电离
25°C 55.6×107个水分子才有1个电离
一、水的电离:
H2O+ H2O H3O + +OH-
简写为:H2O H+ +OH-
1、水的电离:
△H>0
K电离 =
c(H+) · c(OH-)
c(H2O)
c(H+) · c(OH-)
c(H2O) ·
K电离 =
为常数
2.水的离子积: kw =
(25℃时,Kw=1×10-14)
对常温下的纯水进行下列操作,完成下表:
酸碱性 水的电离平衡移动方向 C(H+) C(OH-) c(H+) 与 c(OH-)
大小关系 Kw
变化
加热
加HCl
加NaOH
中性
→
↑
↑
=
↑
酸性
←
↑
↓
>
不变
碱性
←
↓
↑
<
不变
中性
不移动
不变
不变
=
不变
加NaCl
讨论:
分析下表中的数据
温度
0℃
20℃
25℃
50℃
100℃
Kw
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
1×10-12
讨论:
根据前面所学知识,水的电离会受什么外界条件影响?
水的离子积又如何改变?
3、影响水的电离平衡的因素:
(2)酸、碱
(1)温度
(3) 盐
升温促进水的电离
加入酸或碱,抑制水的电离
(第三节详细介绍)
KW不变
KW增大
c(H+)水=c(OH-)水 <1×10-7 mol/L
常温下(25℃),任何稀的水溶液中总满足:
Kw= C(H+)×C(OH-)=1×10-14
注意:
②任何水溶液中(不论是在中性溶液还是在酸、碱性溶液),H+和OH-总是同时存在。
① Kw只与温度有关,而与浓度大小无关。
如:KW25℃=10-14 KW100℃=10-12
③任何水溶液中,水电离出的 C(H+)水=C(OH-)水
巩固练习
1、常温下,浓度为1×10-5 mol/L的盐酸溶液中,由水电离产生的c(H+)是多少?
1×10-9 mol/L
2、常温下,浓度为1×10-5 mol/L的NaOH溶液中,由水电离产生的c(OH-)是多少?
1×10-9 mol/L
思考题:在常温下,由水电离产生的C(H+)=1×10-9 mol/L的溶液,则该溶液的酸碱性如何?
可能是酸性也可能是碱性
√
√
√
×
×
---正误判断
6、如果C H+不等于COH-则溶液一定呈现酸碱性。
5、在水中加酸会抑制水的电离。
1、任何水溶液中都有CH+和COH-。
2、对水升高温度, CH+增大,酸性增强。
练习:
3、在水中加入稀盐酸或NaOH后,水的离子积发生改变
4、在酸碱溶液中,水电离出来的C H+和COH-相等
√
×
7.有含H+的水溶液一定是酸;含OH-的水溶液一定是碱.
酸性溶液中只含H+;碱性溶液中只含OH-.
二、溶液酸碱性与pH
1、溶液酸碱性的表示法
(1)c(H+) 和 c(OH-)
(2)c(H+) 和 c(OH-)都较小的稀溶液(<1mol/L)
用pH表示。
pH = - lgc(H+)
例:c(H+) = 1×10-7mol/L
pH = - lg10-7 = 7
2、c(H+) 和 c(OH-)与溶液酸碱性、 pH的关系
溶液的酸碱性 c(H+)和c(OH-)的关系 pH
酸性
中性
碱性
常温下
c(H+) > c(OH-)
c(H+) = c(OH-)
c(H+) < c(OH-)
>7
= 7
<7
pH=7的溶液一定是中性溶液吗?
答:不一定,只有在常温下才显中性。
注意: [H+]与[OH—]的关系才是判断溶液酸碱性的依据.
3、pH的测定方法
测定方法: pH试纸 pH计
用法:用玻璃棒蘸溶液,点在pH试纸中央,半分钟后与比色卡比色
讨论: pH试纸的使用
能否直接把pH试纸伸到待测液中?
是否要先湿润pH试纸后,再将待测液滴到pH试纸上?
如用湿润的pH试纸检验待测液,对该溶液pH值的测定:
A、一定有影响 B、偏大 C、偏小 D、不确定
能否用广泛pH试纸测出pH=7.1来?
标准比色卡中的数据都是整数
√
注意:
①不能用水润湿
②要放在玻璃片(或表面皿)上
③不是将试纸伸到溶液中
④广泛pH试纸只能读出整数
方法二:用pH计测定
