山东省临清市人教版化学选修4课件:第3章 第3节 盐类的水解(第1、2课时)
文档属性
| 名称 | 山东省临清市人教版化学选修4课件:第3章 第3节 盐类的水解(第1、2课时) |

|
|
| 格式 | rar | ||
| 文件大小 | 55.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
第三节
盐类的水解
CH3COONa:
Na2CO3:
Na2S:
NaHCO3:
FeCl3:
实验:下列盐溶液分别显酸性、碱性还是中性?
NH4Cl:
NaCl:
(NH4)2SO4:
碱性
碱性
碱性
碱性
酸性
酸性
酸性
中性
讨论:从上述实验结果分析,盐溶液
的酸碱性与生成该盐的酸和碱
的强弱间有什么关系?
CH3COONa
Na2CO3
Na2S
NaHCO3
强碱弱酸盐
水溶液显碱性
一、盐类的水解:
FeCl3
NH4Cl
(NH4)2SO4
强酸弱碱盐
水溶液显酸性
NaCl
强酸强碱盐
水溶液显中性
问:为什么不同类型的盐溶液的
酸碱性会不同呢?
盐的水解:在溶液中盐电离出来的离子跟水电离出来的氢离子或氢氧根离子结合成弱电解质的反应,叫做盐的水解。
酸 + 碱 盐 + 水
中和
水解
只有可溶性盐,且在水溶液中,才能发生水解。
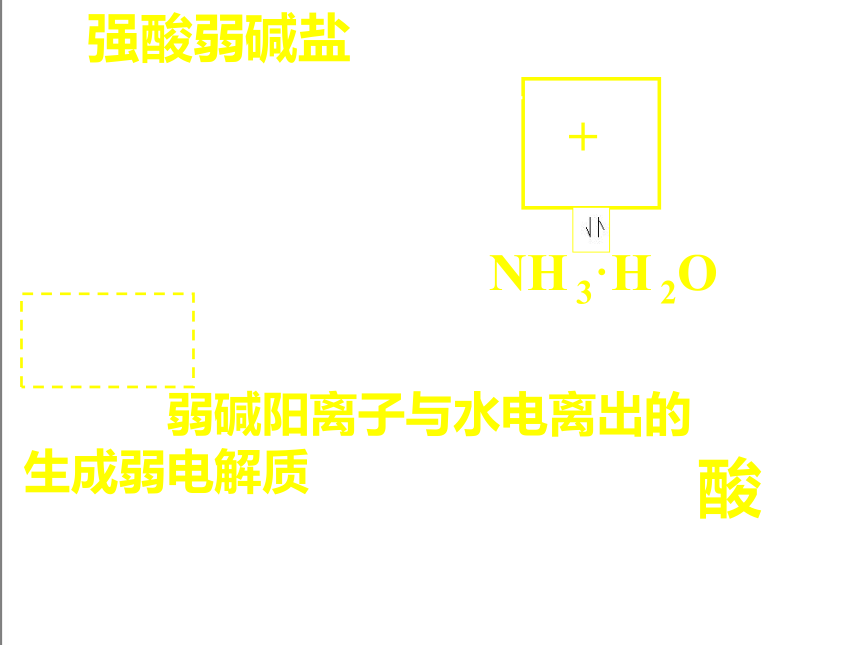
1、强酸弱碱盐:
NH4Cl = Cl- + NH4+
+
NH 3·H 2O
NH4Cl +H2O HCl + NH 3·H 2O
H2O H+ + OH-
电离出弱碱阳离子与水电离出的OH-生成弱电解质
水解,溶液呈酸性
如: FeCl3、Cu(NO3)2、(NH4)2SO4等
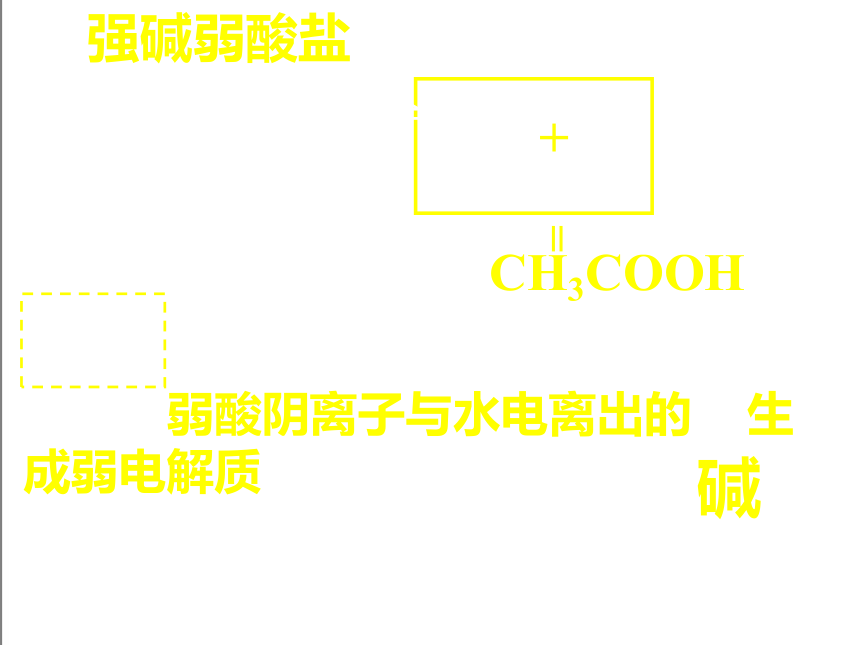
2、强碱弱酸盐:
CH3COONa = CH3COO- + Na+
+
=
CH3COOH
NaAc + H2O HAc + NaOH
H2O H+ + OH-
电离出弱酸阴离子与水电离出的H+生成弱电解质
水解,溶液呈碱性
如: Na2CO3、NaHCO3、NaF、Na2S等
3、强酸强碱盐:
无弱酸阴离子、弱碱阳离子
不水解,溶液呈中性。
如:KNO3、NaCl、K2SO4等
4、弱酸弱碱盐:
电离出弱酸阴离子、弱碱阳离子
均水解
溶液酸碱性由弱酸阴离子和
弱碱阳离子的相对强弱来定。
水解规律:
谁弱谁水解,不弱不水解;
越弱越水解,谁强显谁性。
常见的弱酸阴离子:
CO32-、HCO3-、CH3COO-、S2-、
HS-、F-、ClO-等
常见的弱碱阳离子:
Fe3+、Fe2+、Al3+、Cu2+、NH4+等
注意点:
1、盐类水解实质上是水的电离平衡
发生了移动,促进水的电离。
2、只有能与H+和OH-结合生成难电离物质的离子才能使水的电离平衡发生移动。
4、盐类的水解可以看作酸碱中和反应的逆过程。
3、水解程度往往是很微弱的。
水解方程式的书写
1、盐类水解是可逆反应,反应方程
式中要写“ ”。
2、一般水解程度很小,水解产物很
少,通常不生成沉淀和气体,不
用“↓”、“↑”符号,生成物(如
H2CO3等)也不写分解产物。
3、多元弱酸盐分步水解,以第一步
为主,水解方程式一般只写第一
步;多元弱碱盐水解一步到位。
4、多元弱酸酸式根离子既存在水解平衡,又存在电离平衡,其中只有HSO3-、H2PO4-以电离为主,显酸性,其他均以水解为主,显碱性。
5、当弱酸与其对应的盐(两者浓度相当时)共存时,溶液以酸的电离为主,显酸性;当弱碱与其对应的盐(两者浓度相当时)共存时,溶液以碱的电离为主,显碱性。
练习:判断下列盐溶液的酸碱性;
若能水解的写出水解反应的方程
式及离子方程式。
NaNO3、Cu(NO3)2、Na2S、FeCl3、
NaClO、NaF、(NH4)2SO4、K2CO3、
AgNO3、Na2SO4
思考:在NH4Cl溶液中,下列关系式
正确的是:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(NH4+)<c(H+)=c(OH-)
D.c(NH4+)=c(Cl-)>c(H+)>c(OH-)
A
二、影响水解平衡的因素:
问:相同物质的量浓度的NaHCO3、
Na2CO3溶液的PH值大小比较?
思考:越弱越水解
比较相应的弱酸的酸性相对强弱
Na2CO3---HCO3-
NaHCO3---H2CO3
酸性:
HCO3-Na2CO3水解程度大,溶液碱性强
1、弱碱越弱,其金属阳离子的水
解程度越大,溶液酸性越强;
弱酸越弱,其酸根阴离子的水
解程度越大,溶液的碱性越强。
例:比较NaClO和KHCO3溶液的
酸碱性强弱。
碱性:NaClO > KHCO3
练习:相同物质的量浓度的NaX、
NaY、NaZ三种盐溶液的PH分别为
7、8、9,则相同物质的量浓度
的HX、HY、HZ的酸性强弱顺序是:
HX > HY > HZ
2、水解反应是吸热反应,温度
升高,有利于水解反应。
问:向Na2CO3溶液中滴入NaOH溶液;
FeCl3溶液中滴入HCl溶液,
对盐的水解平衡有何影响?
3、加入碱能抑制强酸弱碱盐的水解;加入碱能抑制强碱弱酸盐的水解。
4、加水稀释溶液,水解平衡正
向移动,水解程度增大;
加大水解离子的浓度,水解平
衡仍正向移动,但水解程度减小。
三、盐类水解的应用:
解释下列问题:
1、实验室在配制AgNO3溶液时,为什么常加入一些HNO3?
2、为什么生活中常用Na2CO3溶液来代替NaOH溶液去油污?热溶液去污
效果好还是冷的好?
3、将下列物质的水溶液蒸干灼烧,最后
得到的固体物质是什么?原因是?
FeCl3、Fe2(SO4)3
哪些盐的溶液加热蒸干,再灼烧得到盐本身:
哪些盐的溶液加热蒸干,再灼烧得不到盐本身:
如何利用FeCl3溶液制得无水FeCl3?
水解产物无挥发性的盐,如:CuSO4、Al2(SO4)3等
水解产物有挥发性的盐,如:CuCl2、AlCl3、FeCl3、 MgCl2等。(Na2CO3例外)
4、下列化肥不能同时使用的是:
①NH3·H2O②草木灰③重钙④硫铵
第三节
盐类的水解
CH3COONa:
Na2CO3:
Na2S:
NaHCO3:
FeCl3:
实验:下列盐溶液分别显酸性、碱性还是中性?
NH4Cl:
NaCl:
(NH4)2SO4:
碱性
碱性
碱性
碱性
酸性
酸性
酸性
中性
讨论:从上述实验结果分析,盐溶液
的酸碱性与生成该盐的酸和碱
的强弱间有什么关系?
CH3COONa
Na2CO3
Na2S
NaHCO3
强碱弱酸盐
水溶液显碱性
一、盐类的水解:
FeCl3
NH4Cl
(NH4)2SO4
强酸弱碱盐
水溶液显酸性
NaCl
强酸强碱盐
水溶液显中性
问:为什么不同类型的盐溶液的
酸碱性会不同呢?
盐的水解:在溶液中盐电离出来的离子跟水电离出来的氢离子或氢氧根离子结合成弱电解质的反应,叫做盐的水解。
酸 + 碱 盐 + 水
中和
水解
只有可溶性盐,且在水溶液中,才能发生水解。
1、强酸弱碱盐:
NH4Cl = Cl- + NH4+
+
NH 3·H 2O
NH4Cl +H2O HCl + NH 3·H 2O
H2O H+ + OH-
电离出弱碱阳离子与水电离出的OH-生成弱电解质
水解,溶液呈酸性
如: FeCl3、Cu(NO3)2、(NH4)2SO4等
2、强碱弱酸盐:
CH3COONa = CH3COO- + Na+
+
=
CH3COOH
NaAc + H2O HAc + NaOH
H2O H+ + OH-
电离出弱酸阴离子与水电离出的H+生成弱电解质
水解,溶液呈碱性
如: Na2CO3、NaHCO3、NaF、Na2S等
3、强酸强碱盐:
无弱酸阴离子、弱碱阳离子
不水解,溶液呈中性。
如:KNO3、NaCl、K2SO4等
4、弱酸弱碱盐:
电离出弱酸阴离子、弱碱阳离子
均水解
溶液酸碱性由弱酸阴离子和
弱碱阳离子的相对强弱来定。
水解规律:
谁弱谁水解,不弱不水解;
越弱越水解,谁强显谁性。
常见的弱酸阴离子:
CO32-、HCO3-、CH3COO-、S2-、
HS-、F-、ClO-等
常见的弱碱阳离子:
Fe3+、Fe2+、Al3+、Cu2+、NH4+等
注意点:
1、盐类水解实质上是水的电离平衡
发生了移动,促进水的电离。
2、只有能与H+和OH-结合生成难电离物质的离子才能使水的电离平衡发生移动。
4、盐类的水解可以看作酸碱中和反应的逆过程。
3、水解程度往往是很微弱的。
水解方程式的书写
1、盐类水解是可逆反应,反应方程
式中要写“ ”。
2、一般水解程度很小,水解产物很
少,通常不生成沉淀和气体,不
用“↓”、“↑”符号,生成物(如
H2CO3等)也不写分解产物。
3、多元弱酸盐分步水解,以第一步
为主,水解方程式一般只写第一
步;多元弱碱盐水解一步到位。
4、多元弱酸酸式根离子既存在水解平衡,又存在电离平衡,其中只有HSO3-、H2PO4-以电离为主,显酸性,其他均以水解为主,显碱性。
5、当弱酸与其对应的盐(两者浓度相当时)共存时,溶液以酸的电离为主,显酸性;当弱碱与其对应的盐(两者浓度相当时)共存时,溶液以碱的电离为主,显碱性。
练习:判断下列盐溶液的酸碱性;
若能水解的写出水解反应的方程
式及离子方程式。
NaNO3、Cu(NO3)2、Na2S、FeCl3、
NaClO、NaF、(NH4)2SO4、K2CO3、
AgNO3、Na2SO4
思考:在NH4Cl溶液中,下列关系式
正确的是:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(NH4+)<c(H+)=c(OH-)
D.c(NH4+)=c(Cl-)>c(H+)>c(OH-)
A
二、影响水解平衡的因素:
问:相同物质的量浓度的NaHCO3、
Na2CO3溶液的PH值大小比较?
思考:越弱越水解
比较相应的弱酸的酸性相对强弱
Na2CO3---HCO3-
NaHCO3---H2CO3
酸性:
HCO3-
1、弱碱越弱,其金属阳离子的水
解程度越大,溶液酸性越强;
弱酸越弱,其酸根阴离子的水
解程度越大,溶液的碱性越强。
例:比较NaClO和KHCO3溶液的
酸碱性强弱。
碱性:NaClO > KHCO3
练习:相同物质的量浓度的NaX、
NaY、NaZ三种盐溶液的PH分别为
7、8、9,则相同物质的量浓度
的HX、HY、HZ的酸性强弱顺序是:
HX > HY > HZ
2、水解反应是吸热反应,温度
升高,有利于水解反应。
问:向Na2CO3溶液中滴入NaOH溶液;
FeCl3溶液中滴入HCl溶液,
对盐的水解平衡有何影响?
3、加入碱能抑制强酸弱碱盐的水解;加入碱能抑制强碱弱酸盐的水解。
4、加水稀释溶液,水解平衡正
向移动,水解程度增大;
加大水解离子的浓度,水解平
衡仍正向移动,但水解程度减小。
三、盐类水解的应用:
解释下列问题:
1、实验室在配制AgNO3溶液时,为什么常加入一些HNO3?
2、为什么生活中常用Na2CO3溶液来代替NaOH溶液去油污?热溶液去污
效果好还是冷的好?
3、将下列物质的水溶液蒸干灼烧,最后
得到的固体物质是什么?原因是?
FeCl3、Fe2(SO4)3
哪些盐的溶液加热蒸干,再灼烧得到盐本身:
哪些盐的溶液加热蒸干,再灼烧得不到盐本身:
如何利用FeCl3溶液制得无水FeCl3?
水解产物无挥发性的盐,如:CuSO4、Al2(SO4)3等
水解产物有挥发性的盐,如:CuCl2、AlCl3、FeCl3、 MgCl2等。(Na2CO3例外)
4、下列化肥不能同时使用的是:
①NH3·H2O②草木灰③重钙④硫铵
