山东省临清市人教版化学选修4课件:第3章 第4节 难溶电解质的溶解平衡
文档属性
| 名称 | 山东省临清市人教版化学选修4课件:第3章 第4节 难溶电解质的溶解平衡 |  | |
| 格式 | rar | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-01-01 21:18:39 | ||
图片预览









文档简介
(共36张PPT)
难溶电解质的溶解平衡
必修4:化学反应原理
思考与讨论
(3)要使NaCl饱和溶液中析出NaCl固体,还可以采取什么措施?
(2)预计在饱和NaCl溶液中加入浓盐酸有何现象?
NaCl (s) Na+ (aq) +Cl - (aq)
加热浓缩、降温、加入钠离子浓度更大的其它溶液
(1)NaCl在水溶液里达到溶液平衡状态时有何特征?
一、电解质的溶解平衡
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
探究
Ag+和Cl-的反应能进行到底吗?
阅读课本P61~62
2、根据对溶解度及反应限度、化学平衡原理的认识,说明生成沉淀的离子反应是否能真正进行到底。
1、谈谈对部分酸、碱和盐的溶解度表中“溶”与”不溶“的理解。
20℃时,溶解度:
大于10g,易溶
1g~10g,可溶
0.01g~1g,微溶
小于0.01g,难溶
思考与交流
3、生成沉淀的离子反应能发生的原因
生成物的溶解度很小
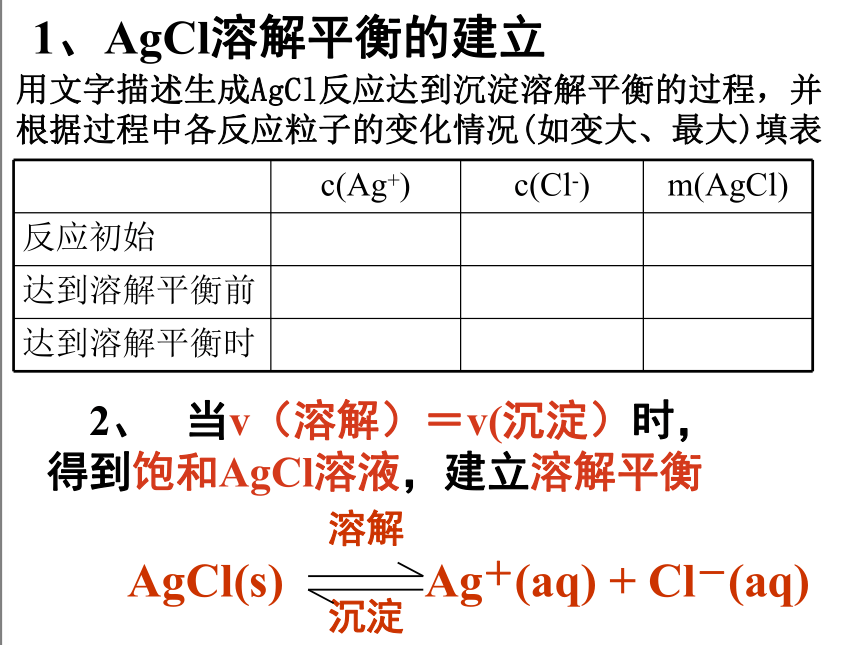
4、AgCl溶解平衡的建立
1、AgCl溶解平衡的建立
2、 当v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡
溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
用文字描述生成AgCl反应达到沉淀溶解平衡的过程,并根据过程中各反应粒子的变化情况(如变大、最大)填表
c(Ag+) c(Cl-) m(AgCl)
反应初始
达到溶解平衡前
达到溶解平衡时
3、溶解平衡的特征
逆、等、动、定、变
4、生成难溶电解质的离子反应的限度
难溶电解质的溶解度小于0.01g,离子反应生成难溶电解质,离子浓度小于1×10-5mol/L时,认为反应完全,但溶液中还有相应的离子。
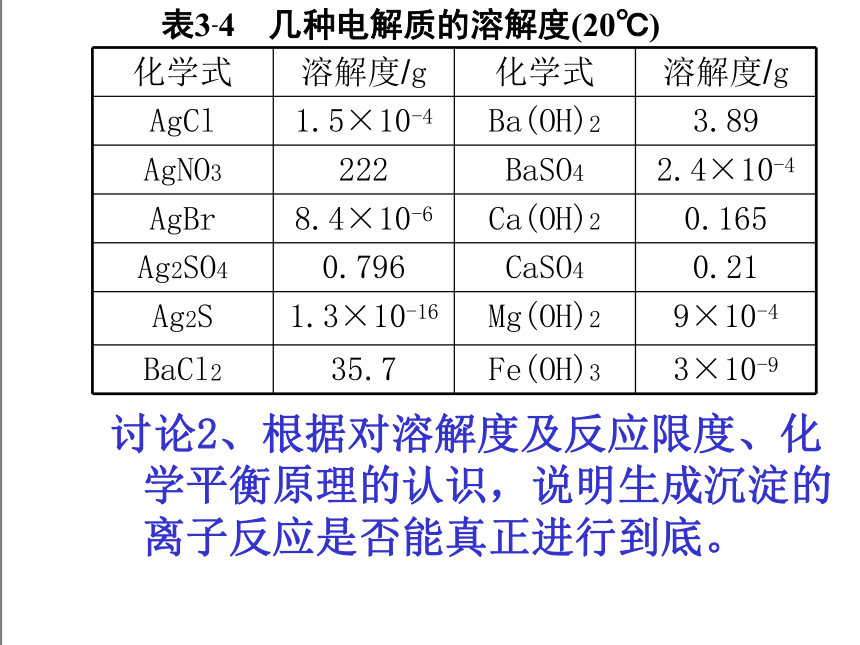
表3-4 几种电解质的溶解度(20℃)
化学式 溶解度/g 化学式 溶解度/g
AgCl 1.5×10-4 Ba(OH)2 3.89
AgNO3 222 BaSO4 2.4×10-4
AgBr 8.4×10-6 Ca(OH)2 0.165
Ag2SO4 0.796 CaSO4 0.21
Ag2S 1.3×10-16 Mg(OH)2 9×10-4
BaCl2 35.7 Fe(OH)3 3×10-9
讨论2、根据对溶解度及反应限度、化学平衡原理的认识,说明生成沉淀的离子反应是否能真正进行到底。
石灰乳中存在下列平衡:
Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A、Na2CO3溶液 B、AlCl3溶液
C、NaOH溶液 D、CaCl2溶液
AB
1、溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.
2、表达式:(MmAn的饱和溶液) Ksp=cm(Mn+) · cn(Am-)
3、溶度积规则:离子积Qc=cm(Mn+) · cn(Am-)
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.
二、溶度积和溶度积规则
阅读课本P65(科学视野)
2)特征:“逆、等、动、定、变”
沉淀的溶解和生成速率相等
平衡可移动
3)平衡常数---------溶度积
KsP= c(Ag+ ).c(Cl-) (离子浓度幂的乘积)
思考:a)KsP的意义
b)根据前面数据计算20ocAgCl 的KsP,
并与P64 表中数据比较
你的结论是?
课堂练习
2.铬酸银(Ag2CrO4)在298K时的溶解度为0.0045g,求其溶度积。
1.在100mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3 溶液,有沉淀(已知AgCl KSP=1.8×10-10) ?
Ag+沉淀是否完全
三、沉淀反应的应用
1、沉淀的生成
(1)沉淀生成的应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
阅读课本P62~64
⑵ 沉淀法工业流程示意图
(3)沉淀的方法
a 、调pH值
如:工业原料氯化铵中混有氯化铁,
加氨水调pH值至7-8
Fe3+ + 3NH3 H2O=Fe(OH)3↓+3NH4+
b 、加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂
Cu2++S2-=CuS↓ Hg2++S2-=HgS↓
⑷ 不同沉淀法的应用
① 直接沉淀法 除去指定的溶液中某种离子.、获取该难溶电解质
② 分步沉淀法 鉴别溶液中含有哪些离子或分别获取不同该难溶电解质
③共沉淀法 除去一组某种性质相似的离子,加入合的沉淀剂
④氧化还原法 改变某离子的存在形式,促使其转变为溶解度更小的难溶电解质便于分离
思考与交流
1、如果要除去某溶液中的SO42-,你选择加 入钡盐还是钙盐?为什么?
加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42-沉淀更完全
2、以你现有的知识,你认为判断沉淀能否生成可从哪方面考虑?是否可能使要除去的离子通过沉淀反应全部除去?说明原因。
从溶解度方面可判断沉淀能否生成
不可能使要除去的离子通过沉淀完全除去
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是( )
A、MgO B、MgCO3
C、NaOH D、Mg(OH)2
c
2、沉淀的溶解
(1)原理
设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动
(2)举例
a 、难溶于水的盐溶于酸中
如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸
b 、难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液
思考与交流
用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因
解释
在溶液中存在Mg(OH)2的溶解平衡:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
加入NH4Cl时,
1、NH4+直接结合OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
2、NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
探究活动2
—— AgCl能和KI溶液反应吗?
[实验演示] 向盛有10滴0.1mol/L AgNO3
溶 液的试管中滴加0.1mol/LNaCl溶液,
至不再有白色沉淀生成。向其中滴加
0.1mol/L KI溶液,观察实验现象。
[实验现象]
白色沉淀渐渐转化为黄色。
1、该反应中滴加KI溶液前,如何检验AgNO3
是否反应完全, 此时溶液中还有Ag+吗?
2、黄色沉淀的成分是什么?其阳离子来自哪里?
3、如果难溶电解质也存在溶解平衡,请从平衡
移动的角度分析沉淀从白色转变成黄色的可
能原因。
AgCl的溶解平衡
难溶电解质在水溶液中也存在溶解平衡;
AgCl(s) Ag+(aq) + Cl-(aq)
一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面溶入水中;另一方面,溶液中的Ag+和Cl-受表面正、负离子的吸引,回到AgCl的表面析出—沉淀。
当沉淀溶解和生成的速率相等时,得到AgCl的饱和溶液。
小结:难溶电解质溶解的规律
不断减小溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动,从而使沉淀溶解
牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
。
已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小、质地更坚固。用离子方程表示当牙膏中配有氟化物添加剂后能防止龋齿的原因 。
生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿
5Ca2++3PO43-+F-=Ca5(PO4)3F↓
交 流 与 讨 论
阅读P83 氟化物防治龋齿的化学原理
+ F-
羟基磷灰石
氟磷灰石
难溶物 溶解度(25℃)
Ca5(PO4)3(OH) 1.5×10-10g
Ca5(PO4)3F 9.5×10-11g
(1)沉淀转化的方法
对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀。
(2)沉淀转化的实质
沉淀转化的实质是沉淀溶解平衡移动。一般溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
(3)沉淀转化的应用
沉淀的转化在科研和生产中具有重要的应用价值。
①锅炉除水垢
3、沉淀的转化
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
+
CO32-
CaCO3
②对一些自然现象的解释
科学视野:溶度积
资料:氟化物防治龋齿的化学原理
四、同离子效应和盐效应
(一) 同离子效应
在难溶强电解质 饱和溶液中加入含有相
同离子 或 的易溶强电解质,沉淀-溶解平衡
向生成 沉淀的方向移动,降低了 的溶
解度。这种因加入与难溶强电解质含有相同离子的
易溶强电解质,使难溶强电解质的溶解度降低的现
象也称为同离子效应。
例题
在难溶强电解质溶液中加入不具有相同离子的易溶强电解质,将使难溶强电解质的溶解度增大,这种现象也称为盐效应。这是由于加入易溶强电解质后,溶液中阴、阳离子的浓度增大,难溶强电解质的阴、阳离子受到了较强的牵制作用,使沉淀反应速率减慢,难溶强电解质的溶解速率暂时大于沉淀速率,平衡向沉淀溶解的方向移动。
加入具有相同离子的易溶强电解质,在产生同离子效应的同时,也能产生盐效应。由于盐效应的影响较小,通常可以忽略不计。
(二)盐效应
谢谢同学们的认真听讲!
下课
难溶电解质的溶解平衡
必修4:化学反应原理
思考与讨论
(3)要使NaCl饱和溶液中析出NaCl固体,还可以采取什么措施?
(2)预计在饱和NaCl溶液中加入浓盐酸有何现象?
NaCl (s) Na+ (aq) +Cl - (aq)
加热浓缩、降温、加入钠离子浓度更大的其它溶液
(1)NaCl在水溶液里达到溶液平衡状态时有何特征?
一、电解质的溶解平衡
可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
探究
Ag+和Cl-的反应能进行到底吗?
阅读课本P61~62
2、根据对溶解度及反应限度、化学平衡原理的认识,说明生成沉淀的离子反应是否能真正进行到底。
1、谈谈对部分酸、碱和盐的溶解度表中“溶”与”不溶“的理解。
20℃时,溶解度:
大于10g,易溶
1g~10g,可溶
0.01g~1g,微溶
小于0.01g,难溶
思考与交流
3、生成沉淀的离子反应能发生的原因
生成物的溶解度很小
4、AgCl溶解平衡的建立
1、AgCl溶解平衡的建立
2、 当v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡
溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
用文字描述生成AgCl反应达到沉淀溶解平衡的过程,并根据过程中各反应粒子的变化情况(如变大、最大)填表
c(Ag+) c(Cl-) m(AgCl)
反应初始
达到溶解平衡前
达到溶解平衡时
3、溶解平衡的特征
逆、等、动、定、变
4、生成难溶电解质的离子反应的限度
难溶电解质的溶解度小于0.01g,离子反应生成难溶电解质,离子浓度小于1×10-5mol/L时,认为反应完全,但溶液中还有相应的离子。
表3-4 几种电解质的溶解度(20℃)
化学式 溶解度/g 化学式 溶解度/g
AgCl 1.5×10-4 Ba(OH)2 3.89
AgNO3 222 BaSO4 2.4×10-4
AgBr 8.4×10-6 Ca(OH)2 0.165
Ag2SO4 0.796 CaSO4 0.21
Ag2S 1.3×10-16 Mg(OH)2 9×10-4
BaCl2 35.7 Fe(OH)3 3×10-9
讨论2、根据对溶解度及反应限度、化学平衡原理的认识,说明生成沉淀的离子反应是否能真正进行到底。
石灰乳中存在下列平衡:
Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是( )
A、Na2CO3溶液 B、AlCl3溶液
C、NaOH溶液 D、CaCl2溶液
AB
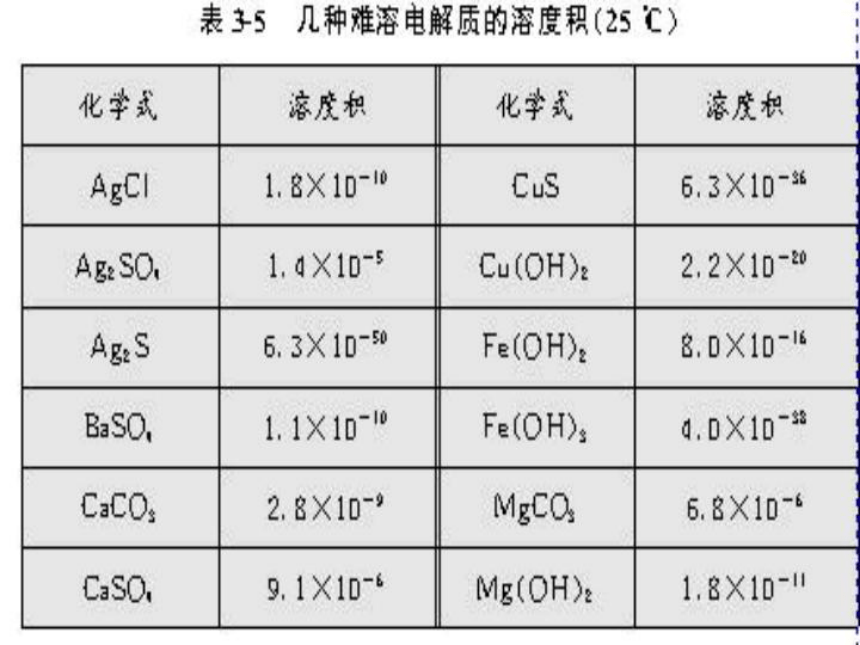
1、溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.
2、表达式:(MmAn的饱和溶液) Ksp=cm(Mn+) · cn(Am-)
3、溶度积规则:离子积Qc=cm(Mn+) · cn(Am-)
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.
二、溶度积和溶度积规则
阅读课本P65(科学视野)
2)特征:“逆、等、动、定、变”
沉淀的溶解和生成速率相等
平衡可移动
3)平衡常数---------溶度积
KsP= c(Ag+ ).c(Cl-) (离子浓度幂的乘积)
思考:a)KsP的意义
b)根据前面数据计算20ocAgCl 的KsP,
并与P64 表中数据比较
你的结论是?
课堂练习
2.铬酸银(Ag2CrO4)在298K时的溶解度为0.0045g,求其溶度积。
1.在100mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3 溶液,有沉淀(已知AgCl KSP=1.8×10-10) ?
Ag+沉淀是否完全
三、沉淀反应的应用
1、沉淀的生成
(1)沉淀生成的应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
阅读课本P62~64
⑵ 沉淀法工业流程示意图
(3)沉淀的方法
a 、调pH值
如:工业原料氯化铵中混有氯化铁,
加氨水调pH值至7-8
Fe3+ + 3NH3 H2O=Fe(OH)3↓+3NH4+
b 、加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂
Cu2++S2-=CuS↓ Hg2++S2-=HgS↓
⑷ 不同沉淀法的应用
① 直接沉淀法 除去指定的溶液中某种离子.、获取该难溶电解质
② 分步沉淀法 鉴别溶液中含有哪些离子或分别获取不同该难溶电解质
③共沉淀法 除去一组某种性质相似的离子,加入合的沉淀剂
④氧化还原法 改变某离子的存在形式,促使其转变为溶解度更小的难溶电解质便于分离
思考与交流
1、如果要除去某溶液中的SO42-,你选择加 入钡盐还是钙盐?为什么?
加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42-沉淀更完全
2、以你现有的知识,你认为判断沉淀能否生成可从哪方面考虑?是否可能使要除去的离子通过沉淀反应全部除去?说明原因。
从溶解度方面可判断沉淀能否生成
不可能使要除去的离子通过沉淀完全除去
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是( )
A、MgO B、MgCO3
C、NaOH D、Mg(OH)2
c
2、沉淀的溶解
(1)原理
设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动
(2)举例
a 、难溶于水的盐溶于酸中
如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸
b 、难溶于水的电解质溶于某些盐溶液
如:Mg(OH)2溶于NH4Cl溶液
思考与交流
用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因
解释
在溶液中存在Mg(OH)2的溶解平衡:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
加入盐酸时,H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
加入NH4Cl时,
1、NH4+直接结合OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
2、NH4+水解,产生的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解
探究活动2
—— AgCl能和KI溶液反应吗?
[实验演示] 向盛有10滴0.1mol/L AgNO3
溶 液的试管中滴加0.1mol/LNaCl溶液,
至不再有白色沉淀生成。向其中滴加
0.1mol/L KI溶液,观察实验现象。
[实验现象]
白色沉淀渐渐转化为黄色。
1、该反应中滴加KI溶液前,如何检验AgNO3
是否反应完全, 此时溶液中还有Ag+吗?
2、黄色沉淀的成分是什么?其阳离子来自哪里?
3、如果难溶电解质也存在溶解平衡,请从平衡
移动的角度分析沉淀从白色转变成黄色的可
能原因。
AgCl的溶解平衡
难溶电解质在水溶液中也存在溶解平衡;
AgCl(s) Ag+(aq) + Cl-(aq)
一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面溶入水中;另一方面,溶液中的Ag+和Cl-受表面正、负离子的吸引,回到AgCl的表面析出—沉淀。
当沉淀溶解和生成的速率相等时,得到AgCl的饱和溶液。
小结:难溶电解质溶解的规律
不断减小溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动,从而使沉淀溶解
牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
。
已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小、质地更坚固。用离子方程表示当牙膏中配有氟化物添加剂后能防止龋齿的原因 。
生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿
5Ca2++3PO43-+F-=Ca5(PO4)3F↓
交 流 与 讨 论
阅读P83 氟化物防治龋齿的化学原理
+ F-
羟基磷灰石
氟磷灰石
难溶物 溶解度(25℃)
Ca5(PO4)3(OH) 1.5×10-10g
Ca5(PO4)3F 9.5×10-11g
(1)沉淀转化的方法
对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀。
(2)沉淀转化的实质
沉淀转化的实质是沉淀溶解平衡移动。一般溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
(3)沉淀转化的应用
沉淀的转化在科研和生产中具有重要的应用价值。
①锅炉除水垢
3、沉淀的转化
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
+
CO32-
CaCO3
②对一些自然现象的解释
科学视野:溶度积
资料:氟化物防治龋齿的化学原理
四、同离子效应和盐效应
(一) 同离子效应
在难溶强电解质 饱和溶液中加入含有相
同离子 或 的易溶强电解质,沉淀-溶解平衡
向生成 沉淀的方向移动,降低了 的溶
解度。这种因加入与难溶强电解质含有相同离子的
易溶强电解质,使难溶强电解质的溶解度降低的现
象也称为同离子效应。
例题
在难溶强电解质溶液中加入不具有相同离子的易溶强电解质,将使难溶强电解质的溶解度增大,这种现象也称为盐效应。这是由于加入易溶强电解质后,溶液中阴、阳离子的浓度增大,难溶强电解质的阴、阳离子受到了较强的牵制作用,使沉淀反应速率减慢,难溶强电解质的溶解速率暂时大于沉淀速率,平衡向沉淀溶解的方向移动。
加入具有相同离子的易溶强电解质,在产生同离子效应的同时,也能产生盐效应。由于盐效应的影响较小,通常可以忽略不计。
(二)盐效应
谢谢同学们的认真听讲!
下课
