2020_2021学年人教版(五四学制)化学九年级全册 第二单元 课题3 溶质的质量分数 课件(共35张PPT)
文档属性
| 名称 | 2020_2021学年人教版(五四学制)化学九年级全册 第二单元 课题3 溶质的质量分数 课件(共35张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 497.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-05 16:14:41 | ||
图片预览









文档简介
一、溶质的质量分数
判断:
这三支试管中溶液的组成是否相同?
判断溶液浓稀的根据是什么?
【判断溶液浓稀】
试管编号
溶液颜色比较
溶剂质量/g
溶质质量/g
溶液质量/
1
2
3
浅
较深
深
10.5
11.0
11.5
10
10
10
0.5
1.0
1.5
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
表示溶液组成的方法很多,这里主要介绍溶质的质量分数。
溶质的质量分数= ×100%
溶质质量
溶液质量
溶液中溶质的质量分数是溶质质量与溶液质量之比,可用下式计算:
试管编号
溶液颜色比较
溶剂质量/g
溶质质量/g
溶液质量/
溶质的
质量分数
1
浅
10
0.5
10.5
2
较深
10
1.0
11.0
3
深
10
1.5
11.5
4.8%
9.1%
13.0%
按下表所定的量配制氯化钠溶液?
溶质质量
溶剂(水)质量/g
溶液中溶质的质量分数
10
90
20
80
10%
20%
按下表所定的量配制氯化钠溶液?
想一想:已知溶质和溶剂的量,这样的溶液我们会配制了。那么如果告诉你一定量的一定溶质质量分数的溶液,你会配制吗?
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
【解】
溶质质量= 溶液质量×溶质的质量分数
= 150kg×16%=24kg
溶剂质量=溶液质量-溶质质量
= 150kg-24kg=126kg
溶质的质量分数= ×100%
溶质质量
溶液质量
答:配150kg质量分数为16%的氯化钠溶液需24kg氯化钠和126kg的水。
二、配制溶质质量分数一定的溶液
称:托盘天平,药匙
量:量筒,胶头滴管
称量
溶解:烧杯,玻璃棒
1、步骤:计算,称量,溶解,装瓶,贴标签
2、仪器:
【例题2】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
【讨论】解这道题的关键是什么?
【分析】抓住关键:溶液稀释前后溶质的质量不变。
【例题2】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
【分析】溶液稀释前后,溶质的质量不变。
【解】设:稀释后溶液的质量为x。
50g×98%=x×20%
=245g
需要水的质量=245g-50g=195g
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要195g水。
50g×98%
20%
x=
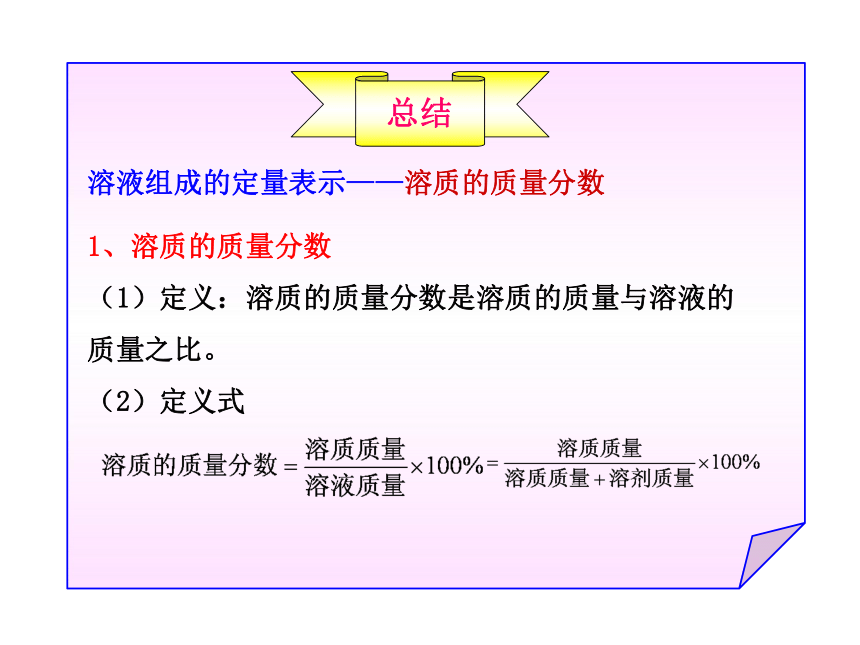
总结
溶液组成的定量表示——溶质的质量分数
1、溶质的质量分数
(1)定义:溶质的质量分数是溶质的质量与溶液的质量之比。
(2)定义式
2、配制一定溶质质量分数的溶液,一般要经过计算、
称量(或量取)、溶解(或稀释)、装瓶存放等步骤。
1、将70℃的硝酸钠饱和溶液降温到10℃,有晶体析
出(晶体中不含水),下列各量没有发生变化的是
( )
A.硝酸钠的溶解度 B.溶液中溶质的质量
C.溶液中溶剂的质量 D.溶液中溶质的质量分数
C
当堂达标
2、甲、乙两种固体的溶解度曲线如右下图。将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。升高温度后,下列有关说法正确的是( )
A. ①②两溶液的质量一定相等
B. ①②两溶液均变为不饱和溶液
C. ①溶液质量增加,②溶液质量减少
D. ①溶液中溶质的质量分数一定大于②溶液
C
3、把10克氯化钠放入40克水中,完全溶解后,溶液中氯
化钠的质量分数为( )
A.10% B.20% C.25% D.33.3%
4、配制100克质量分数为19.6%的稀硫酸,需要质量分
数为98%的浓硫酸 克。
B
20
5、将5g碳酸钠粉末加到95g溶质质量分数为10%的碳酸
钠溶液中,完全溶解后溶液的溶质的质量分数为______。
6、现有100g溶质质量分数为10%的食盐溶液,若使溶
液的溶质质量分数增加一倍,应向此溶液中加入食盐
g,或蒸发掉水 g.
14.5%
50
12.25
7、在某温度下,NaCl的溶解度为36g,求:
(1)在此温度下200g水最多可溶解 克NaCl
(2)20℃10g此温度下的饱和溶液里溶质的质量分数 为______%(精确到0.1%)
72
26.5
试管
编号
溶液颜色比较
溶质
质量
溶剂
质量
溶液
质量
溶质质量分数
1
较浅
0.5g
10g
10.5g
4.76 %
2
适中
1g
10g
11g
9.09 %
3
较深
1.5g
10g
11.5g
13.04 %
溶质的质量分数
2、定义式:
1、定义:溶质的质量分数是溶质的质量与溶液的质量之比。
我会做
已知50g氯化钠溶液中含5g氯化钠,计算该溶液中氯化钠的质量分数。
解:该溶液中氯化钠的质量分数
=
=10%
答:该溶液中氯化钠的质量分数为10%
我会做
如配制150kg16%的氯化钠溶液,需要氯化钠和水各多少千克?
解:150kg16%的氯化钠溶液中含NaCl的质量为:
150kg×16%=24kg
需水的质量为:150kg-24kg= 126kg
答:配制150kg16%的氯化钠溶液,需要氯化钠24kg,需要水126kg。
饱和溶液的溶质质量分数=
溶解度
100g+溶解度
溶质的质量分数36%是指: 100g溶液中含有36g溶质。
溶质T℃时溶解度36g是指: 在T℃时,100g水最多溶解 该溶质36g。
溶质质量分数与溶解度的比较
已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为
=26.5%
36g
100g+36g
答:略.
例题
溶液的质量(g)
=溶液的体积(cm3)×溶液的密度(g·cm-3)
M(溶液)=V(溶液) ×ρ(溶液)
注意:
溶液的稀释
化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸。需要水的质量是多少?
原则:稀释前后溶质的质量不变,需要水的质量为:
- 50g=195g
配制溶液:
一般步骤:计算、称量、量取溶解、装瓶存放
用固体配制溶液所用的仪器(以固体NaCl为例):
托盘天平、烧杯、玻璃棒、量筒、 胶头滴管、药匙
用液体配制溶液所用的仪器:(例如稀释浓硫酸)
烧杯、玻璃棒、量筒、 胶头滴管
注意药品的名称
左“物”右“码”
选用适合量程的量筒
配制溶液操作过程需注意:
配制溶液的过程中,量取水时,如果俯视、仰视刻度线,分别导致的后果是什么?
猜一猜
讨论
量取水时,如果俯视刻度线会使取用的水的体积偏少,最终导致所配制溶液的浓度偏大;相反,仰视刻度线会使所配制溶液的浓度偏小。
总结
溶液组成的定量表示——溶质的质量分数
1、溶质的质量分数
(1)定义:溶质的质量分数是溶质的质量与溶液的质量之比。
(2)定义式
2、配制一定溶质质量分数的溶液,一般要经过计算、
称量(或量取)、溶解(或稀释)、装瓶存放等步骤。
1、将70℃的硝酸钠饱和溶液降温到10℃,有晶体析
出(晶体中不含水),下列各量没有发生变化的是
( )
A.硝酸钠的溶解度 B.溶液中溶质的质量
C.溶液中溶剂的质量 D.溶液中溶质的质量分数
C
当堂达标
2、甲、乙两种固体的溶解度曲线如右下图。将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。升高温度后,下列有关说法正确的是( )
A. ①②两溶液的质量一定相等
B. ①②两溶液均变为不饱和溶液
C. ①溶液质量增加,②溶液质量减少
D. ①溶液中溶质的质量分数一定大于②溶液
C
3、把10克氯化钠放入40克水中,完全溶解后,溶液中氯
化钠的质量分数为( )
A.10% B.20% C.25% D.33.3%
4、配制100克质量分数为19.6%的稀硫酸,需要质量分
数为98%的浓硫酸 克。
B
20
5、将5g碳酸钠粉末加到95g溶质质量分数为10%的碳酸
钠溶液中,完全溶解后溶液的溶质的质量分数为______。
6、现有100g溶质质量分数为10%的食盐溶液,若使溶
液的溶质质量分数增加一倍,应向此溶液中加入食盐
g,或蒸发掉水 g.
14.5%
50
12.25
7、在某温度下,NaCl的溶解度为36g,求:
(1)在此温度下200g水最多可溶解 克NaCl
(2)20℃10g此温度下的饱和溶液里溶质的质量分数 为______%(精确到0.1%)
72
26.5
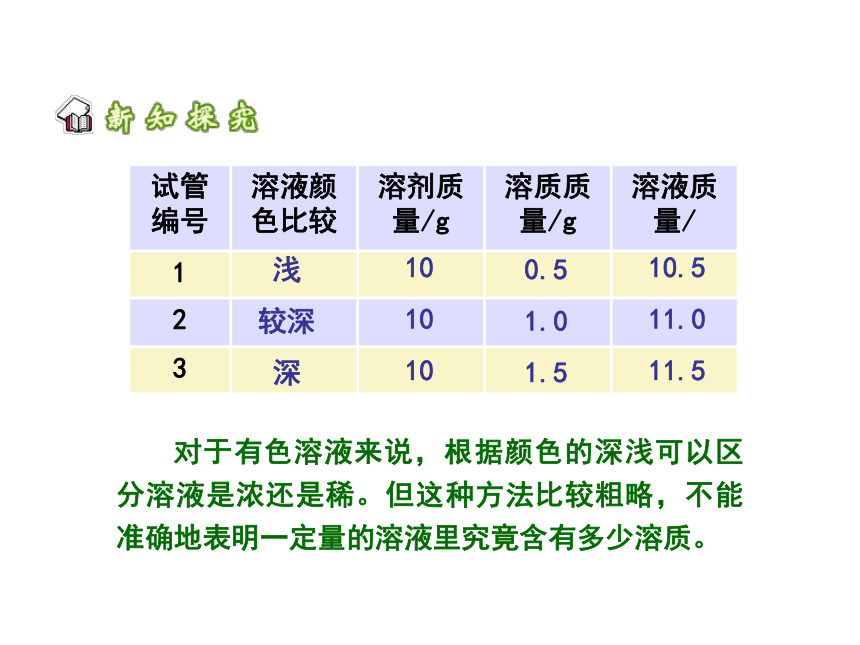
判断:
这三支试管中溶液的组成是否相同?
判断溶液浓稀的根据是什么?
【判断溶液浓稀】
试管编号
溶液颜色比较
溶剂质量/g
溶质质量/g
溶液质量/
1
2
3
浅
较深
深
10.5
11.0
11.5
10
10
10
0.5
1.0
1.5
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
表示溶液组成的方法很多,这里主要介绍溶质的质量分数。
溶质的质量分数= ×100%
溶质质量
溶液质量
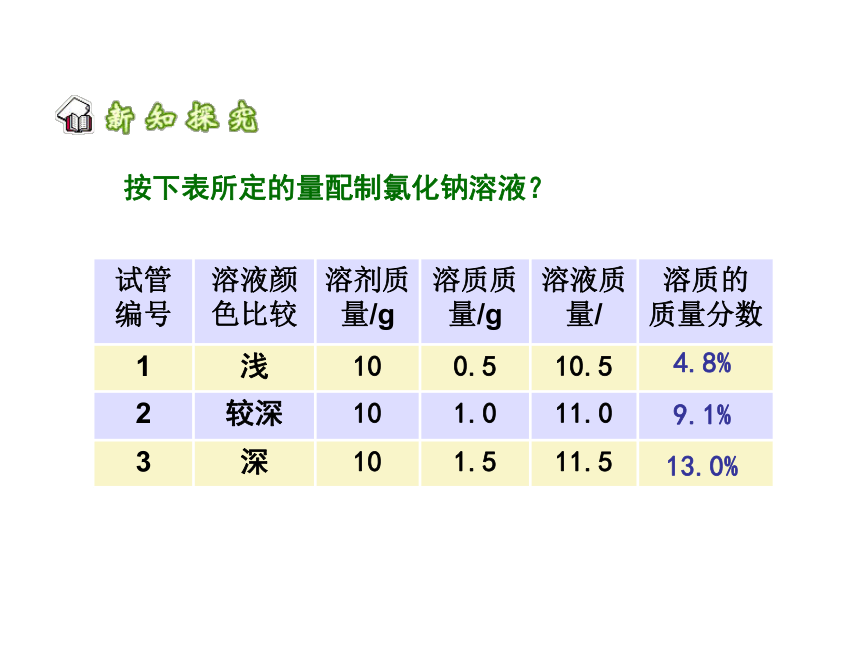
溶液中溶质的质量分数是溶质质量与溶液质量之比,可用下式计算:
试管编号
溶液颜色比较
溶剂质量/g
溶质质量/g
溶液质量/
溶质的
质量分数
1
浅
10
0.5
10.5
2
较深
10
1.0
11.0
3
深
10
1.5
11.5
4.8%
9.1%
13.0%
按下表所定的量配制氯化钠溶液?
溶质质量
溶剂(水)质量/g
溶液中溶质的质量分数
10
90
20
80
10%
20%
按下表所定的量配制氯化钠溶液?
想一想:已知溶质和溶剂的量,这样的溶液我们会配制了。那么如果告诉你一定量的一定溶质质量分数的溶液,你会配制吗?
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
【解】
溶质质量= 溶液质量×溶质的质量分数
= 150kg×16%=24kg
溶剂质量=溶液质量-溶质质量
= 150kg-24kg=126kg
溶质的质量分数= ×100%
溶质质量
溶液质量
答:配150kg质量分数为16%的氯化钠溶液需24kg氯化钠和126kg的水。
二、配制溶质质量分数一定的溶液
称:托盘天平,药匙
量:量筒,胶头滴管
称量
溶解:烧杯,玻璃棒
1、步骤:计算,称量,溶解,装瓶,贴标签
2、仪器:
【例题2】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
【讨论】解这道题的关键是什么?
【分析】抓住关键:溶液稀释前后溶质的质量不变。
【例题2】化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
【分析】溶液稀释前后,溶质的质量不变。
【解】设:稀释后溶液的质量为x。
50g×98%=x×20%
=245g
需要水的质量=245g-50g=195g
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要195g水。
50g×98%
20%
x=
总结
溶液组成的定量表示——溶质的质量分数
1、溶质的质量分数
(1)定义:溶质的质量分数是溶质的质量与溶液的质量之比。
(2)定义式
2、配制一定溶质质量分数的溶液,一般要经过计算、
称量(或量取)、溶解(或稀释)、装瓶存放等步骤。
1、将70℃的硝酸钠饱和溶液降温到10℃,有晶体析
出(晶体中不含水),下列各量没有发生变化的是
( )
A.硝酸钠的溶解度 B.溶液中溶质的质量
C.溶液中溶剂的质量 D.溶液中溶质的质量分数
C
当堂达标
2、甲、乙两种固体的溶解度曲线如右下图。将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。升高温度后,下列有关说法正确的是( )
A. ①②两溶液的质量一定相等
B. ①②两溶液均变为不饱和溶液
C. ①溶液质量增加,②溶液质量减少
D. ①溶液中溶质的质量分数一定大于②溶液
C
3、把10克氯化钠放入40克水中,完全溶解后,溶液中氯
化钠的质量分数为( )
A.10% B.20% C.25% D.33.3%
4、配制100克质量分数为19.6%的稀硫酸,需要质量分
数为98%的浓硫酸 克。
B
20
5、将5g碳酸钠粉末加到95g溶质质量分数为10%的碳酸
钠溶液中,完全溶解后溶液的溶质的质量分数为______。
6、现有100g溶质质量分数为10%的食盐溶液,若使溶
液的溶质质量分数增加一倍,应向此溶液中加入食盐
g,或蒸发掉水 g.
14.5%
50
12.25
7、在某温度下,NaCl的溶解度为36g,求:
(1)在此温度下200g水最多可溶解 克NaCl
(2)20℃10g此温度下的饱和溶液里溶质的质量分数 为______%(精确到0.1%)
72
26.5
试管
编号
溶液颜色比较
溶质
质量
溶剂
质量
溶液
质量
溶质质量分数
1
较浅
0.5g
10g
10.5g
4.76 %
2
适中
1g
10g
11g
9.09 %
3
较深
1.5g
10g
11.5g
13.04 %
溶质的质量分数
2、定义式:
1、定义:溶质的质量分数是溶质的质量与溶液的质量之比。
我会做
已知50g氯化钠溶液中含5g氯化钠,计算该溶液中氯化钠的质量分数。
解:该溶液中氯化钠的质量分数
=
=10%
答:该溶液中氯化钠的质量分数为10%
我会做
如配制150kg16%的氯化钠溶液,需要氯化钠和水各多少千克?
解:150kg16%的氯化钠溶液中含NaCl的质量为:
150kg×16%=24kg
需水的质量为:150kg-24kg= 126kg
答:配制150kg16%的氯化钠溶液,需要氯化钠24kg,需要水126kg。
饱和溶液的溶质质量分数=
溶解度
100g+溶解度
溶质的质量分数36%是指: 100g溶液中含有36g溶质。
溶质T℃时溶解度36g是指: 在T℃时,100g水最多溶解 该溶质36g。
溶质质量分数与溶解度的比较
已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质量分数为
=26.5%
36g
100g+36g
答:略.
例题
溶液的质量(g)
=溶液的体积(cm3)×溶液的密度(g·cm-3)
M(溶液)=V(溶液) ×ρ(溶液)
注意:
溶液的稀释
化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸。需要水的质量是多少?
原则:稀释前后溶质的质量不变,需要水的质量为:
- 50g=195g
配制溶液:
一般步骤:计算、称量、量取溶解、装瓶存放
用固体配制溶液所用的仪器(以固体NaCl为例):
托盘天平、烧杯、玻璃棒、量筒、 胶头滴管、药匙
用液体配制溶液所用的仪器:(例如稀释浓硫酸)
烧杯、玻璃棒、量筒、 胶头滴管
注意药品的名称
左“物”右“码”
选用适合量程的量筒
配制溶液操作过程需注意:
配制溶液的过程中,量取水时,如果俯视、仰视刻度线,分别导致的后果是什么?
猜一猜
讨论
量取水时,如果俯视刻度线会使取用的水的体积偏少,最终导致所配制溶液的浓度偏大;相反,仰视刻度线会使所配制溶液的浓度偏小。
总结
溶液组成的定量表示——溶质的质量分数
1、溶质的质量分数
(1)定义:溶质的质量分数是溶质的质量与溶液的质量之比。
(2)定义式
2、配制一定溶质质量分数的溶液,一般要经过计算、
称量(或量取)、溶解(或稀释)、装瓶存放等步骤。
1、将70℃的硝酸钠饱和溶液降温到10℃,有晶体析
出(晶体中不含水),下列各量没有发生变化的是
( )
A.硝酸钠的溶解度 B.溶液中溶质的质量
C.溶液中溶剂的质量 D.溶液中溶质的质量分数
C
当堂达标
2、甲、乙两种固体的溶解度曲线如右下图。将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。升高温度后,下列有关说法正确的是( )
A. ①②两溶液的质量一定相等
B. ①②两溶液均变为不饱和溶液
C. ①溶液质量增加,②溶液质量减少
D. ①溶液中溶质的质量分数一定大于②溶液
C
3、把10克氯化钠放入40克水中,完全溶解后,溶液中氯
化钠的质量分数为( )
A.10% B.20% C.25% D.33.3%
4、配制100克质量分数为19.6%的稀硫酸,需要质量分
数为98%的浓硫酸 克。
B
20
5、将5g碳酸钠粉末加到95g溶质质量分数为10%的碳酸
钠溶液中,完全溶解后溶液的溶质的质量分数为______。
6、现有100g溶质质量分数为10%的食盐溶液,若使溶
液的溶质质量分数增加一倍,应向此溶液中加入食盐
g,或蒸发掉水 g.
14.5%
50
12.25
7、在某温度下,NaCl的溶解度为36g,求:
(1)在此温度下200g水最多可溶解 克NaCl
(2)20℃10g此温度下的饱和溶液里溶质的质量分数 为______%(精确到0.1%)
72
26.5
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
