2020-2021学年九年级化学人教版(五四学制)全册 第四单元 课题1 生活中常见的盐 课件(22张PPT)
文档属性
| 名称 | 2020-2021学年九年级化学人教版(五四学制)全册 第四单元 课题1 生活中常见的盐 课件(22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 780.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-03-05 00:00:00 | ||
图片预览







文档简介
生活中常见的盐
为什么叫纯碱?
我也不知道。
情境导入
我来探究
“纯碱是盐”
它的水溶液显碱性
生活中还有哪些常见的盐?
生活中常见的盐(1)
第一课时
NaCl
Na2CO3
NaHCO3
CaCO3
自主学习、展示评价
环节一
1.食盐和盐是一回事吗?
2.工业用盐含有什么物质?能食用吗?若误食会发生什么后果?
3.除调味外,你还能说出食盐的其它用途吗?
4.在自然界中,氯化钠如何分布的?
5.如何去除粗盐中难溶性杂质?
盐是含有金属离子和酸根离子的化合物。食盐是盐的一种。
工业用盐中含有亚硝酸钠(NaNO2),误食会引起中毒
医疗 生理盐水是0.9%的氯化钠溶液
工业 制取纯碱、烧碱、氯气、盐酸等
农业 氯化钠可以用来选种
生活 调味品、腌制蔬菜、鱼、肉、蛋等
交通 公路上的积雪用氯化钠来消除
分布很广,海水、盐湖、盐井和盐矿都是氯化钠的来源。
溶解、沉淀、过滤、蒸发、结晶等
教学过程
{3C2FFA5D-87B4-456A-9821-1D502468CF0F}
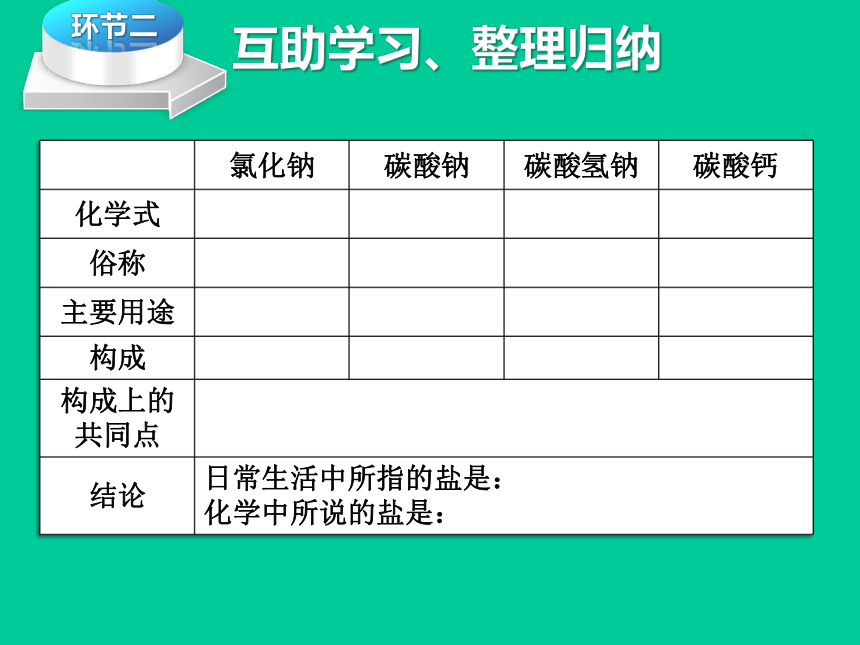
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗称
主要用途
构成
构成上的共同点
结论
日常生活中所指的盐是:
化学中所说的盐是:
环节二
互助学习、整理归纳
{3C2FFA5D-87B4-456A-9821-1D502468CF0F}
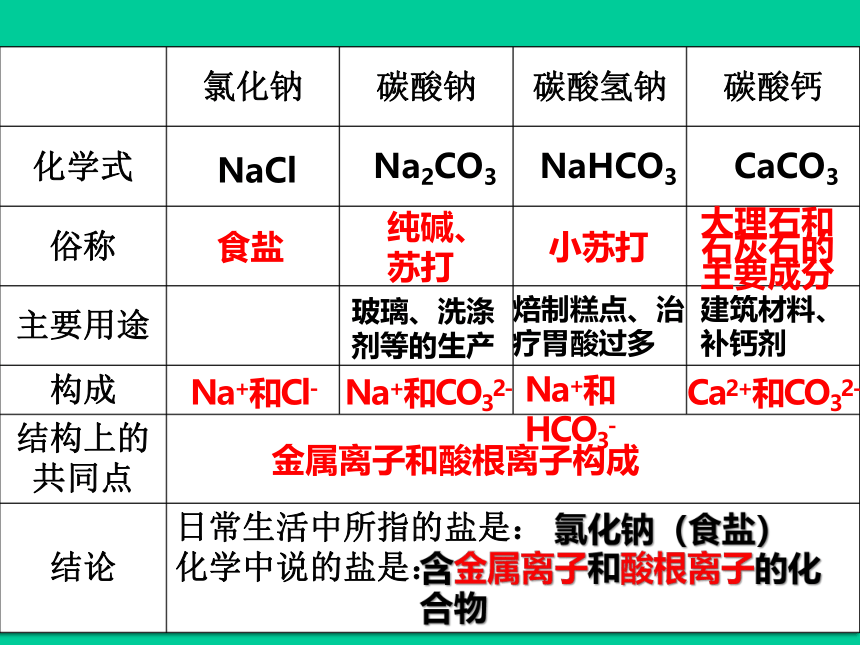
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗称
主要用途
构成
结构上的共同点
结论
日常生活中所指的盐是:
化学中说的盐是:
食盐
纯碱、
苏打
小苏打
NaCl
Na2CO3
NaHCO3
CaCO3
大理石和石灰石的主要成分
金属离子和酸根离子构成
Na+和Cl-
Na+和CO32-
Na+和HCO3-
Ca2+和CO32-
建筑材料、补钙剂
焙制糕点、治疗胃酸过多
玻璃、洗涤剂等的生产
氯化钠(食盐)
含金属离子和酸根离子的化合物
指出下列物质中哪些是酸?哪些是碱?哪些是盐?
H2O、CaCO3、HCl、Na2CO3 、
Ca(OH)2、H2SO4、NaOH
酸:HCl、H2SO4
碱:NaOH、Ca(OH)2
盐:CaCO3、Na2CO3
应用反馈
回顾实验室制取二氧化碳的反应原理
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
环节三
实验探究、提升规律
(1)酒石酸(HR)是一种易溶于水的固体有机酸
(2)发酵粉能使面包松软,发泡是因为发酵粉产生 二氧化碳的原因
(3)碳酸氢钠受热分解会生成碳酸钠
(4)碳酸钠受热不分解
小明查询资料得知以下信息:
探究一
碳酸氢钠在发酵粉加水或者加热时如何产生二氧化碳?
猜想1:碳酸氢钠与水反应产生二氧化碳
猜想2:碳酸氢钠与酒石酸反应产生二氧化碳
猜想3:碳酸氢钠加热产生二氧化碳
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
实验
加水
加酸
加热
现象
无
产生气泡
大试管内壁有水珠,烧杯中有气泡,澄清石灰石变浑浊
结论:
碳酸氢钠在发酵粉中产生二氧化碳的条件是加热或加酸
探究二
碳酸氢钠加热完全分解后生成的碳酸钠能否与酸反应?
结论:
碳酸钠能与酸发生反应
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Na2CO3
NaHCO3
+ 2 HR = 2NaR+ H2O + CO2↑
+ HR = NaR +H2O + CO2↑
提升规律
通过以上三个反应,从它们的组成和性质上你发现了什么规律?
环节三
实验探究、提升规律
各组代表汇报交流情况
含碳酸根离子和碳酸氢根离子的物质的检验:与酸反应,生成能使澄清石灰水变浑浊的气体
得出结论:
探究三
碳酸氢钠溶液和碳酸钠溶液的酸碱性
结论:
碳酸氢钠溶液和碳酸钠溶液都呈碱性
1.下列各组物质都不属于盐的是( )
A.KMnO4和KCl B.CaO和Ca(OH)2
C.CuSO4和NaCl D.Na2CO3和H2SO4
2.下列常见的盐在生产、生活中的用途不合理的是( )
A.用食盐生产烧碱 B.亚硝酸钠可以腌制食品
C.碳酸钙可用作补钙剂 D.碳酸钠可用于洗涤剂的生产
检测学习目标1
环节四
检测反馈
B
B
检测学习目标2
3.盛放NaOH 溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。甲同学和乙同学对这两种白色粉末的成分进行了如下猜测和验证
(I)可能是 NaOH (II)可能是Na2CO3 (III)可能是NaOH与Na2CO3 的混合物
(1)甲同学向所取少量粉末中滴加一种溶液后,排除了(I)的可能性。请你推测他所加的试剂和所观察到的现象
(2)乙同学提议用酚酞溶液来鉴定,你认为可行吗?请简要说明理由
学习进步!
祝同学们:
为什么叫纯碱?
我也不知道。
情境导入
我来探究
“纯碱是盐”
它的水溶液显碱性
生活中还有哪些常见的盐?
生活中常见的盐(1)
第一课时
NaCl
Na2CO3
NaHCO3
CaCO3
自主学习、展示评价
环节一
1.食盐和盐是一回事吗?
2.工业用盐含有什么物质?能食用吗?若误食会发生什么后果?
3.除调味外,你还能说出食盐的其它用途吗?
4.在自然界中,氯化钠如何分布的?
5.如何去除粗盐中难溶性杂质?
盐是含有金属离子和酸根离子的化合物。食盐是盐的一种。
工业用盐中含有亚硝酸钠(NaNO2),误食会引起中毒
医疗 生理盐水是0.9%的氯化钠溶液
工业 制取纯碱、烧碱、氯气、盐酸等
农业 氯化钠可以用来选种
生活 调味品、腌制蔬菜、鱼、肉、蛋等
交通 公路上的积雪用氯化钠来消除
分布很广,海水、盐湖、盐井和盐矿都是氯化钠的来源。
溶解、沉淀、过滤、蒸发、结晶等
教学过程
{3C2FFA5D-87B4-456A-9821-1D502468CF0F}
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗称
主要用途
构成
构成上的共同点
结论
日常生活中所指的盐是:
化学中所说的盐是:
环节二
互助学习、整理归纳
{3C2FFA5D-87B4-456A-9821-1D502468CF0F}
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
化学式
俗称
主要用途
构成
结构上的共同点
结论
日常生活中所指的盐是:
化学中说的盐是:
食盐
纯碱、
苏打
小苏打
NaCl
Na2CO3
NaHCO3
CaCO3
大理石和石灰石的主要成分
金属离子和酸根离子构成
Na+和Cl-
Na+和CO32-
Na+和HCO3-
Ca2+和CO32-
建筑材料、补钙剂
焙制糕点、治疗胃酸过多
玻璃、洗涤剂等的生产
氯化钠(食盐)
含金属离子和酸根离子的化合物
指出下列物质中哪些是酸?哪些是碱?哪些是盐?
H2O、CaCO3、HCl、Na2CO3 、
Ca(OH)2、H2SO4、NaOH
酸:HCl、H2SO4
碱:NaOH、Ca(OH)2
盐:CaCO3、Na2CO3
应用反馈
回顾实验室制取二氧化碳的反应原理
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
环节三
实验探究、提升规律
(1)酒石酸(HR)是一种易溶于水的固体有机酸
(2)发酵粉能使面包松软,发泡是因为发酵粉产生 二氧化碳的原因
(3)碳酸氢钠受热分解会生成碳酸钠
(4)碳酸钠受热不分解
小明查询资料得知以下信息:
探究一
碳酸氢钠在发酵粉加水或者加热时如何产生二氧化碳?
猜想1:碳酸氢钠与水反应产生二氧化碳
猜想2:碳酸氢钠与酒石酸反应产生二氧化碳
猜想3:碳酸氢钠加热产生二氧化碳
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}
实验
加水
加酸
加热
现象
无
产生气泡
大试管内壁有水珠,烧杯中有气泡,澄清石灰石变浑浊
结论:
碳酸氢钠在发酵粉中产生二氧化碳的条件是加热或加酸
探究二
碳酸氢钠加热完全分解后生成的碳酸钠能否与酸反应?
结论:
碳酸钠能与酸发生反应
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Na2CO3
NaHCO3
+ 2 HR = 2NaR+ H2O + CO2↑
+ HR = NaR +H2O + CO2↑
提升规律
通过以上三个反应,从它们的组成和性质上你发现了什么规律?
环节三
实验探究、提升规律
各组代表汇报交流情况
含碳酸根离子和碳酸氢根离子的物质的检验:与酸反应,生成能使澄清石灰水变浑浊的气体
得出结论:
探究三
碳酸氢钠溶液和碳酸钠溶液的酸碱性
结论:
碳酸氢钠溶液和碳酸钠溶液都呈碱性
1.下列各组物质都不属于盐的是( )
A.KMnO4和KCl B.CaO和Ca(OH)2
C.CuSO4和NaCl D.Na2CO3和H2SO4
2.下列常见的盐在生产、生活中的用途不合理的是( )
A.用食盐生产烧碱 B.亚硝酸钠可以腌制食品
C.碳酸钙可用作补钙剂 D.碳酸钠可用于洗涤剂的生产
检测学习目标1
环节四
检测反馈
B
B
检测学习目标2
3.盛放NaOH 溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。甲同学和乙同学对这两种白色粉末的成分进行了如下猜测和验证
(I)可能是 NaOH (II)可能是Na2CO3 (III)可能是NaOH与Na2CO3 的混合物
(1)甲同学向所取少量粉末中滴加一种溶液后,排除了(I)的可能性。请你推测他所加的试剂和所观察到的现象
(2)乙同学提议用酚酞溶液来鉴定,你认为可行吗?请简要说明理由
学习进步!
祝同学们:
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
